Tumorpatienten haben ein erhöhtes Risiko, eine venöse Thromboembolie (VTE) zu erleiden. Die Gründe dafür sind vielfältig. Die Thrombosebehandlung wurde in den letzten Jahren durch moderne Antikoagulanzien wie DOAK zwar leichter – skeptisch bleiben die Fachgesellschaften jedoch bei malignen Erkrankungen und empfehlen niedermolekulares Heparin. Möglicherweise wird sich das in Zukunft ändern.
Die geschätzte VTE-Inzidenz, definiert als tiefe Venenthrombosen (TVT) und Lungenembolien (LE), liegt bei jährlich ein bis zwei je 1.000 Personenjahre. Bei Patienten mit malignen Erkrankungen ist sie gegenüber Menschen ohne Tumorerkrankung um bis zu 6,5-fach erhöht [11, 7].
Man nimmt an, dass etwa 18 % aller VTE-Fälle bei Tumorpatienten auftreten [13, 8]. Der Vergleich zeigt, dass bei Personen mit malignen Erkrankungen und VTE die Überlebensraten niedriger und die Therapiekosten höher sind. Die VTE-Problematik bei Krebspatienten scheint trotz etablierter Prophylaxemaßnahmen eher zu- als abzunehmen. Eine amerikanische Analyse von mehr als 66.000 hospitalisierten Patienten mit malignen Erkrankungen ergab von 1995 bis 2002 eine Zunahme der Ereignisse um 36 %. Eine weitere Analyse von Krankenhausentlassdaten zeigt für 1980 bis 1999 eine Verdopplung der VTE-Inzidenz bei diesen Patienten.
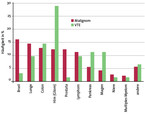
Venöse Thromboembolien bei Tumorpatienten haben zwar die gleiche Endstrecke der venösen Thrombusbildung, sind aber eine sehr heterogene Entität. Das VTE-Risiko ist nicht bei allen Malignomen gleich – vor allem Krebsgeschwulste des Gehirns, des Pankreas, des Magens, des Kolons und der Lunge sind hier riskant (Abb. 1).
Auch metastasierte Malignome erhöhen das Risiko stärker als nicht metastasierte. Hämatologische Erkrankungen wie die Lymphome weisen ein höheres VTE-Risiko auf als andere Malignome.
Ursachen der VTE
Die Ursachen der VTE-Entstehung reichen vom echten paraneoplastischen Geschehen über die lokale Tumorummauerung von Gefäßen bis zu therapieassoziierten Komplikationen (Abb. 2 und 3).
- Komorbiditäten (Charlson-Index > 3)
- Varikosis
- Z. n. VTE
- Hereditäre Thrombophilie
- sehr hoch: Magen, Pankreas
- hoch: Lunge, Hirn, Niere, Blase
- Chemotherapie
- Antiangiogenetische Therapie
- Hormontherapie
- Operation
- Bestrahlung
- Bluttransfusion
- Zentralvenöser Katheter
- Immobilität
- Blutbild: Anämie, Leukozytose, Thrombozythämie
- D-Dimere
- P-Selectin
- Prothrombinfragment 1 + 2
- Mikropartikel-Tissue-Faktor
- C-reaktives Protein
Abb. 2: Risikofaktoren für die Entwicklung von VTE bei Tumorpatienten, gruppiert in Tumor-, Patienten-, behandlungsassoziierte Risiken und wichtige Biomarker [3].
Paraneoplastische Ursachen
Tumoren führen zu Veränderungen zellulärer und molekularer Mechanismen, die sie für ihr Wachstum und ihre Metastasierung benötigen. Dazu gehört z.B. die tumorzelluläre Überexpression von Tissue-Faktor, dem Initiator der extrinsischen Gerinnungskaskade, und die Freisetzung von Tissue-Faktor-tragenden Mikropartikeln aus dem Tumor in die Blutzirkulation [9]. Der Tissue-Faktor, dessen Expression zumindest teilweise der Kontrolle durch Mutationen in Onkogenen (z. B. K-ras, EGFR, PML/RAR-alpha) und Tumorsuppressorgenen (z. B. p53, PTEN) unterliegt, ist dabei sowohl in die Thrombusentstehung als auch in die Progression maligner Erkrankungen involviert.
Lokale Tumorkomplikationen
Die Ummauerung der Venen und ihre Infiltration sind lokale Tumorkomplikationen, die besonders bei fortgeschrittenen zentralen Tumoren bedeutsam, aber auch für einzelne wie das Nierenzellkarzinom recht spezifisch sind. Typische Krankheitsbilder der Tumorummauerung sind die untere oder obere Einflussstauung. Letztere ist vor allem für das lokal verdrängende Bronchialkarzinom und für die mediastinale Metastasierung anderer Tumoren beschrieben. Eine untere oder obere Einflussstauung findet sich aber auch als Erstsymptom eines Seminoms oder Lymphoms.
Operative Therapie maligner Erkrankungen
Eine VTE ist eine häufige Komplikation bei Patienten mit malignen Erkrankungen, die sich einer Operation unterziehen, da die Krebserkrankung das VTE-Risiko verdoppelt. So entwickeln ohne Prophylaxe etwa 10 – 20 % aller operierten Tumorpatienten proximale Venenthrombosen und 4 – 10 % eine Lungenembolie [5]. Bis zu einem Viertel der symptomatischen venösen Thromboembolien treten erst nach Entlassung auf und erfordern einen erneuten stationären Aufenthalt. Klinische Studien zeigen, dass sich 40 % der VTE-Ereignisse innerhalb der ersten 21 Tage nach der Op. ereignen [1].
Intravenöse Verweilkatheter und Port-Systeme
Zentrale Venenkatheter sind in der Therapie und der Pflege von Tumorpatienten weit verbreitet. Sie dienen der Verabreichung von Chemotherapie, Transfusionen, Blutabnahme und unterstützenden Maßnahmen wie Hydratation, Schmerzkontrolle und Ernährung. Venographische Studien haben gezeigt, dass diese Katheter schon binnen 24 Stunden nach Implantation von einer Fibrinscheide umhüllt sind. Die Inzidenz katheterassoziierter VTE bei malignen Erkrankungen ist hoch und liegt bei systematischem Screening mit Venographie bei 27 bis 66 % [10].
Chemotherapie
Jede maligne Erkrankung bringt ein erhöhtes VTE-Risiko mit sich, eine Chemotherapie erhöht es noch. In einer bevölkerungsbasierten Studie wurde das malignomassoziierte VTE-Risiko auf das etwa Vierfache geschätzt. Die Chemotherapie erhöhte es auf circa das 6,5-Fache [8, 7]. Die Angiogenese ist ein Schlüsselfaktor für das Wachstum von Malignomen. So ist die Angiogenese-Hemmung ein attraktives Ziel für die Chemotherapie und hat die Therapieergebnisse einer Vielzahl von Malignomen verbessert. Für Thalidomid und sein Analogon Lenalidomid, auch in Kombination mit Dexamethason oder Anthrazyklinen, gelten VTE-Raten von 12 – 28 % [12, 4]. Um diese hohen Raten zu verhindern, gab es sogar Studien, die den Effekt einer konsequenten Antikoagulation mit Warfarin zusätzlich zur Thalidomid- oder Lenalidomid-Therapie propagierten.
Strahlentherapie
Eine Strahlentherapie wird z. B. bei frühen Stadien maligner Erkrankungen initiiert, wenn das Risiko einer VTE hoch ist, oder als Teil radikaler Behandlungen für lokalisierte Tumoren mit oder ohne Chemotherapie. Die Strahlentherapie ist zudem häufig eine palliative Behandlung bei Patienten mit fortgeschrittenen Malignomen, um ihre Schmerzen zu kon-trollieren und nicht-resezierbare Hirntumoren, Hirnmetastasen oder die medulläre Kompression zu behandeln. Die ionisierende Strahlung führt zur endothelialen Aktivierung, zu proinflammatorischen endothelial vermittelten Prozessen und prothrombotischen Reaktionen [6].
Wie kann man vorbeugen?
Die Pathogenese von tumorassoziierten VTE ist multifaktoriell und umfasst viele Mechanismen, zum Teil auch parallel. Alle Aspekte der Virchow’schen Trias wie die venöse Stase, die Hyperkoagulabilität und die Gefäßwandverletzungen spielen bei Tumorpatienten wie bei allen anderen Menschen ohne Tumor eine Rolle. Beim Patienten mit Tumorleiden kommen die erhöhte Immobilität, die therapeutischen Zellschädigungen durch chemo-, strahlen- und/oder tumorchirurgische Maßnahmen und die tumorspezifische Hyperkoagulabilität hinzu. Die klinische Bedeutung der VTE wird noch durch das erhöhte Rezidivrisiko gesteigert. Die aktuellen Leitlinien empfehlen daher auch nach einer drei- bis sechsmonatigen Therapiephase eine sogenannte verlängerte Erhaltungstherapie, solange die Tumorerkrankung weiter aktiv ist und keine Kontraindikationen bestehen. Hierzu wird wegen der bisherigen Studienlage und der klinischen Erfahrung in der Regel ein niedermolekulares Heparin verwendet (NMH).
Die VTE-Therapie hat sich durch die Einführung der DOAK in den letzten zehn Jahren deutlich vereinfacht. Eine der letzten therapeutischen Indikationen, denen man bei den DOAK bisher mit viel Skepsis gegenüberstand, ist die VTE-Therapie bei Patienten mit malignen Erkrankungen. Bei dieser Patientengruppe werden in den nationalen und internationalen Leitlinien bisher immer die NMHs bevorzugt. Durch neue Studien zu Edoxaban (HOKUSAI Cancer Trail) und Rivaroxaban (SELECT D) wird sich dies jedoch vermutlich ändern.
Bei der Diskussion um das geeignete Antikoagulans ist es wichtig, den Patienten nicht aus den Augen zu verlieren und die beschriebene Vielfalt der VTE-Ursachen bei Tumorpatienten zu kennen. Eine postoperative Thrombose bei einem Patienten mit einem Tumor, der kurativ operiert wurde, oder eine inzidentelle LE einige Monate nach Abschluss der Tumortherapie lässt sich mit einem DOAK sicher therapieren. Die Wahl des richtigen Antikoagulans und dessen spezifische Dosis ist bei einem Patienten mit akuter VTE und Hochdosischemotherapie, der sich im Zelltief befindet und nur noch 20.000/µl Thrombozyten hat, allerdings für jeden Arzt eine Herausforderung.
Interessenkonflikte: KK hat honorierte Vorträge für Sanofi, Bayer Vital, GSK, Amgen, Daiichi Sankyo, medi GmbH, BSN und BMS gehalten. CM hat keine Interessenkonflikte deklariert.
Erschienen in: Der Allgemeinarzt, 2019; 41 (2) Seite 54-58