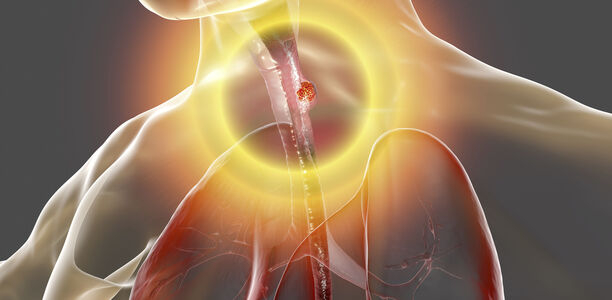
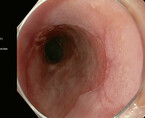
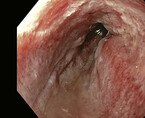
Ein gastroösophagealer Reflux, der die Ösophagusschleimhaut schädigt, kann letztlich in einen Speiseröhrenkrebs münden. Die Diagnose und Therapie früher Stadien ist entscheidend, da bei den ersten Symptomen eines Adenokarzinoms der Tumor oft schon weit fortgeschritten ist. Zudem erlaubt eine frühe Diagnose meist eine endoskopische Resektion, die im Vergleich zur chirurgischen Therapie weniger komplikationsbehaftet ist.
Die Inzidenz des Adenokarzinoms der Speiseröhre hat sich in den letzten 40 Jahren in den westlichen Ländern versechsfacht [1, 2].
Während in Asien das Plattenepithelkarzinom die vorherrschende Tumorentität ist, macht das Adenokarzinom in den USA bereits 60 % der Ösophaguskarzinome aus [3]. Die Fünf-Jahres-Überlebensrate liegt bei circa 20 %.
Man geht davon aus, dass alle Adenokarzinome der Speiseröhre aus Barrettepithel hervorgehen. Die Pathogenese beginnt mit einer chronischen Schleimhautschädigung durch gastroösophagealen Reflux. Hierdurch wird das Plattenepithel der Speiseröhre durch Zylinderepithel ersetzt, wobei der histologische Nachweis einer spezialisierten intestinalen Metaplasie gefordert wird. Die Entwicklung des Adenokarzinoms vollzieht sich schrittweise von Barrettschleimhaut ohne Dysplasie zu Barrettschleimhaut mit einer niedriggradigen intraepithelialen Neoplasie und über eine hochgradige intraepitheliale Neoplasie bis schließlich zum Karzinom. Etwa 5 – 15 % der Patienten mit chronischem Reflux entwickeln eine Barrettschleimhaut. Die Prävalenz in der Gesamtbevölkerung beträgt 1 – 2 % [4, 5]. Die Diagnose Barrettösophagus wird endoskopisch gestellt, wenn in der Speiseröhre über eine Mindeststrecke von
10 mm Zylinderepithel nachgewiesen wird, das histologisch eine spezialisierte intestinale Metaplasie enthält. Die gastroösophageale Refluxerkrankung ist der wichtigste Risikofaktor für das Auftreten eines Barrettösophagus. Alle Faktoren, die das Auftreten von Reflux begünstigen, sind auch an der Pathogenese des Barrettösophagus beteiligt. Männer sind deutlich häufiger als Frauen betroffen, unter 50 Jahren ist das Verhältnis 4:1 [6]. Zigarettenrauchen verursacht ein zwei- bis vierfaches Risiko für einen Barrettösophagus [7]. Alkohol ist dagegen kein Risikofaktor, mäßigem Weingenuss wird sogar ein protektiver Effekt zugeschrieben [8]. Weitere Risiken sind eine zentrale Adipositas, ein Lebensalter über 50 Jahre und eine positive Familienanamnese für Barrettösophagus oder -karzinom. Das Risiko von Verwandten ersten Grades liegt bei 24 % [9].
Eine generelle Empfehlung für eine Screeninguntersuchung besteht nicht, sollte jedoch bei langjährigen Refluxbeschwerden und mehreren weiteren Risikofaktoren erwogen werden. Bei Nachweis eines Barrettösophagus sollte der Arzt hingegen regelmäßige Kontrolluntersuchungen vornehmen. Hochauflösende Endoskope (HD-Endoskopie) sind hier empfohlen. Zu einer routinemäßigen Anwendung optischer Färbe- und Bildverbesserungsverfahren wird grundsätzlich nicht geraten, bei der Beurteilung lokaler Veränderungen innerhalb der Barrettschleimhaut können sie aber hilfreich sein. Die Beschreibung der Schleimhautveränderungen erfolgt anhand der Prag-Klassifikation, bei der die maximale zirkumferentielle und die maximale Ausdehnung nach oral in Zentimetern angegeben wird. Es werden zunächst Biopsien aus allen fokalen Schleimhautveränderungen vorgenommen. Bei der Suche nach fokalen Veränderungen sollte man eine Chromoendoskopie oder ein virtuelles Färbeverfahren anwenden [10]. Auch wenn ein kontrastverstärkendes Verfahren durch einen erfahrenen Untersucher die ungezielte Biopsieentnahme nicht mehr erfordert, empfehlen die Leitlinien der Fachgesellschaften Quadrantenbiopsien im Abstand von 2 cm, beginnend am oberen Ende der Magenfalten [11, 12].
Barrettösophagus ohne Dysplasie
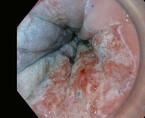
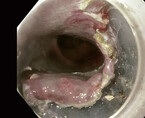
Mit einer Prävalenz von 1 – 2 % ist der Barrett-ösophagus ein häufiges Phänomen. Auch wenn dieser eine Präkanzerose darstellt, erkrankt nur ein kleiner Teil der Patienten tatsächlich an einem Adenokarzinom (Abb. 1 und 2). Der Dysplasiegrad ist dabei der wichtigste Prädiktor. Liegt keine Dysplasie vor, ist das jährliche Karzinomrisiko mit 0,33 % sehr gering. Eine ablative Therapie ist hier nicht gerechtfertigt, es sollten regelmäßige Kontrolluntersuchungen stattfinden. Die Länge des Barrettsegments ist ein wichtiger Risikofaktor für eine Neoplasie. So steigt das Dysplasierisiko pro Zentimeter Barrettlänge um 14 % [13]. Liegt diese bei bis zu
3 cm, sollte man nach fünf Jahren, bei einer Länge bis zu 10 cm nach drei Jahren endoskopisch nachkontrollieren. Bei einer Barrettlänge von über 10 cm ist das Neoplasierisiko vergleichbar mit einer niedriggradigen intraepithelialen Neoplasie. Diese Patienten sollten in einem tertiären Zentrum betreut werden.
Barrettösophagus mit LGIEN oder HGIEN
Die Diagnose einer intraepithelialen Neoplasie sollte grundsätzlich ein Referenzpathologe bestätigen. Die Bedeutung einer Zweitbeurteilung wird durch die Arbeit von Curvers et al. [14] deutlich, bei der durch die Referenzbeurteilung 85 % der Befunde auf Barrettschleimhaut ohne Dysplasie zurückgestuft wurden. Zudem lässt sich die Diagnose einer niedriggradigen intraepithelialen Neoplasie (LGIEN) in 30 % der Fälle in nachfolgenden Endoskopien nicht reproduzieren. Diese Patienten sollten in Tertiärzentren vorstellig und nach sechs Monaten nachkontrolliert werden. Bestätigt sich die Diagnose, liegt ein relevantes Risiko für eine HGIEN oder ein Karzinom vor [15]. Eine ablative Therapie sollte erfolgen. Die Diagnose einer hochgradigen Dysplasie (HGIEN) sollte ebenfalls ein Referenzpathologe bestätigen. Im endoskopischen Referenzzentrum werden dann alle sichtbaren Veränderungen endoskopisch reseziert. Eine hochgradige intraepitheliale Neoplasie ohne endoskopisch sichtbare Veränderungen ist bei nur 20 % der Patienten selten [11].
In der Regel kann das Tertiärzentrum die Dysplasie endoskopisch lokalisieren. Andernfalls ist die Ablation des Barrettsegments mittels Radiofrequenzablation (RFA) empfohlen.
Barrettfrühkarzinom
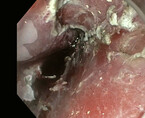
Hier kommen die endoskopische Mukosaresektion (EMR) und die endoskopische Submukosadissektion (ESD; Abb. 3 und 4) zum Einsatz. Die EMR ist technisch leichter durchführbar, hat ab einer Läsionsgröße von 10 – 15 mm jedoch den Nachteil der mehrteiligen Resektion (Piecemeal-Resektion). Eine Resektion nach onkologischen Kriterien ist dann nicht mehr gegeben. Die ESD ist technisch anspruchsvoller, bietet aber die Möglichkeit einer En-bloc-Resektion, prinzipiell unabhängig von der Resektatgröße. Während beim Plattenepithelkarzinom des Ösophagus aufgrund des frühen Risikos einer Lymphknotenmetastasierung die ESD im Fokus steht, gilt in der westlichen Welt für das Barrettkarzinom die EMR als Standardverfahren. Bei mukosalen Karzinomen konnte man in einer großen Serie mit 1.000 Patienten einen Therapieerfolg in 96 % der Fälle und bei einem Komplikationsrisiko von 1,5 % erzielen. Bei 14,5 % traten Rezidive oder metachrone Läsionen auf, die man aber meist ebenfalls endoskopisch therapieren konnte [16]. Auf die Mukosa beschränkte Karzinome weisen ein geringes Lymphknotenmetastasierungsrisiko auf. Sie können als endoskopisch kurativ reseziert gelten, wenn sie gut bis mäßig differenziert sind (G1 und G2) und keine Lymphknoten- oder Gefäßinvasion (L0 und V0) zeigen [17, 18]. Bleibt die Tiefeninvasion auf die oberen 500 μm der Submukosa beschränkt und liegt eine "Low-Risk-Situation" (G1-2, L0,V0, Tumorgröße < 3 cm) vor, ist das Risiko eines Lymphknotenbefalls mit 1,4 % immer noch relativ gering [19, 20]. Angesichts der Mortalität und Morbidität der chirurgischen Therapie können diese Patienten ebenfalls als kurativ therapiert gewertet werden. Die Entscheidung sollte der Arzt multidisziplinär und mit dem Patienten treffen. Bei bereits vor Therapie erfolgtem Nachweis eines Karzinoms kommt der histologischen Beurteilung eine große Bedeutung zu, so dass die Autoren in diesem Fall der ESD trotz des größeren technischen Aufwands den Vorzug geben.
Restbarrettschleimhaut nach Resektion
21,5 % der Patienten mit kurativ endoskopisch therapiertem Frühkarzinom oder hochgradiger intraepithelialer Neoplasie entwickeln eine metachrone Läsion nach einem mittleren Follow-up von circa fünf Jahren [21]. Die alleinige endoskopische Resektion aller sichtbaren Veränderungen ist daher nicht ausreichend. Es muss sich die Eradikation des kompletten Barrettsegments in einem zweiten Schritt anschließen (Zwei-Stufen-Konzept). Die endoskopische Resektion zirkulärer Barrettareale geht mit einer Strikturrate von bis zu 88 % einher, so dass sich die komplikationsarme Radiofrequenzablation als Verfahren der Wahl etabliert hat [22].
Nach kompletter Entfernung des Barrettepithels durch endoskopische Resektion und Radiofrequenzablation (Abb. 5 und 6) liegt das Risiko bei etwa 25 % für ein Rezidiv der intestinalen Metaplasie [23, 24]. Die Rezidivrate ist abhängig von der initialen Histologie vor der Therapie [25]. Als Standard für hochgradige intestinale Metaplasie und Karzinom gelten vierteljährliche Kontrollen im ersten Jahr, halbjährliche im zweiten sowie anschließende jährliche Kontrollen. Bei initialer Low-Grade-Neoplasie sind halbjährliche Kontrollen im ersten Jahr und danach jährliche Untersuchungen zulässig.
Interessenkonflikte: Die Autoren haben keine deklariert.
- Gastroösophagealer Reflux: Wann macht die Endoskopie Sinn?
- Eosinophile Ösophagitis: Wenn die Speiseröhre zum starren Rohr wird
- Dysphagie: Wenn Schlucken zum Problem wird
- Refluxerkrankung: Welche operativen Möglichkeiten stehen zur Verfügung?
- Gastroösophagealer Reflux: Wann macht die Endoskopie Sinn?
Erschienen in: Der Allgemeinarzt, 2020; 42 (14) Seite 34-37