Die Gastroösophageale Refluxerkrankung (GERD) gewinnt hierzulande zunehmend an Bedeutung. Veränderungen der Lebensgewohnheiten, insbesondere eine Gewichtsreduktion, können die Beschwerden bereits deutlich verbessern. Sie werden jedoch nur von wenigen Patienten angenommen und konsequent gelebt. Die konservative Therapie mit Protonenpumpeninhibitoren (PPI) ist effektiv, sie ist aber in jüngster Zeit in die Kritik geraten.
Es steht eine Vielzahl von Therapieoptionen zur Verfügung. Dabei ist die konservative Therapie mit PPI vorerst die Therapie der Wahl [3, 4]. Aktuelle Studienergebnisse zeigen jedoch eine unzureichende Reflux-Kontrolle unter einer PPI-Dauertherapie bei 39 % der Patienten [5]. Die Medikamenteneinnahme wird deutlich von den Beschwerden der Patienten beeinflusst. Die Compliance einer täglichen PPI-Einnahme liegt nach 6 Monaten bei 55 % und fällt nach 12 Monaten auf 30 % [6, 79].
Eine hochdosierte dauerhafte PPI-Therapie wird zunehmend kritisch gesehen. Mehrere Studien berichten über die Begünstigung der Osteoporose unter PPI durch eine verminderte Kalziumresorption [8]. Es mehren sich Berichte über weitere relevante Nebenwirkungen einer dauerhaften PPI-Einnahme (z. B. Niereninsuffizienz, Demenz, kardiovaskuläre Ereignisse etc.). Die Evidenz dieser Studien ist äußerst fragwürdig. Dennoch verunsichern die Berichte den Patienten, sodass die PPI-Einnahme zunehmend hinterfragt wird [9].
Genaue Anamnese ist wichtig
Voraussetzung für eine erfolgreiche Therapie der Refluxerkrankung ist eine genaue Anamnese, die sowohl typische Refluxbeschwerden als auch extraösophageale Symptome erfasst, und eine exakte Diagnostik. Gemäß Evidenz- und Erfahrungskriterien werden die nachfolgenden 4 diagnostischen Verfahren als zwingend erforderlich klassifiziert [10]:
- Obere Endoskopie: strukturelle Veränderungen (Mukosa, Neoplasieausschluss)
- Bariumbreischluck: anatomische Abnormitäten (Hernientyp)
- 24-h-pH-Metrie: Objektivierung der GERD
- Manometrie: funktionelle Abnormitäten (unterer Ösophagussphinkter, Peristaltik).
Refluxkontrolle durch chirurgische Eingriffe
Die klassischen anitrefluxchirurgischen Eingriffe – laparoskopische Hiatoplastik und Fundoplicatio – erreichen in direkten Vergleichen mit den PPI eine äquivalente Refluxkontrolle. Dies bestätigte die LOTUS-Studie, die in 11 europäischen Ländern durchgeführt wurde und 545 Patienten einschloss. Nach 5 Jahren bestanden in der Esomeprazolgruppe im Vergleich zur laparoskopischen Nissen-Fundoplicatio Sodbrennen bei 16 % vs. 8 % (p = 0,14) und saure Regurgitationen bei 13 % vs. 2 % (p < 0,001) [11]. In einem Positionspapier der American Gastroenterological Association (AGA) [12] wird die laparoskopische Antirefluxoperation als Behandlungsoption der GERD mit absteigender Stärke (A–C) empfohlen, für:
- Patienten, die auf die PPI-Behandlung ansprechen, diese aber nicht tolerieren (Grad-A-Empfehlung);
- Patienten mit typischen Refluxsymptomen, insbesondere Regurgitationen (Volumenreflux), trotz PPI-Behandlung (Grad-B-Empfehlung) und
- Patienten mit anhaltenden extraösophagealen Symptomen trotz PPI-Therapie (Grad-C-Empfehlung).
Laparoskopische Fundoplicatio
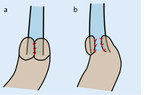
Das Verfahren der Wahl zur Antirefluxoperation ist die laparoskopische Fundoplicatio (LF), die am häufigsten in 2 Varianten ausgeführt wird. Bei der laparoskopischen Fundoplicatio nach Nissen (LFN) wird eine maximal 3 cm lange lockere 360°-Fundusmanschette um den distalen Ösophagus und die Kardia gelegt. Bei der Fundoplicatio nach Toupet (LFT) wird die Manschette nicht geschlossen und umfasst etwa 230–270° (Abb. 1) [13]. Die beiden Manschetten wurden in einer Vielzahl von Studien miteinander verglichen und zeigen kaum signifikante Unterschiede [14, 15]. Die LFN zeigte tendenziell eine geringfügig bessere Refluxkontrolle im Langzeitvergleich. Dagegen scheinen Probleme wie Dysphagie und Gas-Bloat (durch die Unfähigkeit, Luft aufstoßen zu können, kommt es zu einem geblähten Magen) etwas häufiger vorzukommen. Eine einwandfreie Überlegenheit des einen oder anderen Verfahrens konnte bis dato aber nicht zweifelsfrei nachgewiesen werden [13]. Es zeigen sich insgesamt gute Langzeitergebnisse zwischen 83 und 94,2 % mit einem Auftreten von Refluxrezidiven zwischen 11 und 22,9 % [13].
Neue Therapieverfahren
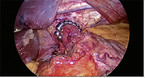
In jüngster Zeit stehen 2 neue antirefluxchirurgische Therapieverfahren zur Verfügung. Beim magnetischen Antireflux-System (LINX®) bildet eine Kette aus titanummantelten Magnetkernen eine flexible Antirefluxbarriere (vgl. Abb. 2) [16]. Bei der Passage des Speisebolus weichen die einzelnen Elemente auseinander, sodass sich dieser Magnetring weitet. Anschließend kehren die einzelnen Elemente wieder an ihre Ausgangsposition zurück, sodass sich der gastroösophageale Übergang wieder verjüngt und ein gastroösophagealer Reflux verhindert wird. Die Wirksamkeit wurde in mehreren klinischen Studien belegt. Ganz et al. (2013) beobachteten in einem Kollektiv von 100 Patienten nach 3 Jahren einen deutlichen Rückgang der Säureexposition bei 64 % der Patienten. Die Lebensqualität verbesserte sich bei 92 % der Patienten und die Notwendigkeit einer PPI-Behandlung reduzierte sich bei 93 % der Patienten [17]. Die Vorteile des Verfahrens liegen in der Einfachheit der Implantation. LINX® wird nach der Versorgung einer Hiatushernie um den Ösophagus gelegt. Der Magenfundus muss hierfür nicht präpariert werden und bleibt erhalten. Im Vergleich zu anderen Verfahren tritt das Gas-Bloat-Syndrom postoperativ seltener auf. Der Umfang der Speiseröhre wird während der Operation ausgemessen und dementsprechend die Größe des Implantates ausgewählt. Trotzdem treten Schluckbeschwerden, die in den meisten Fällen nach 4–6 Wochen vorübergehen, relativ häufig auf. Zu einer dauerhaften Dysphagie kommt es relativ selten. Eine Explantation ist in ca. 3,4 % der Fälle notwendig [18]. Eine präoperative Dysphagie oder eine reduzierte Kontraktionskraft der Speiseröhre in der präoperativen Manometrie sind daher Kontraindikationen. Obwohl bereits erste Ergebnisse über die Effektivität auch bei größeren Hernien vorliegen, ist das Verfahren nur für Hernien unter 3 cm zugelassen.
Ein weiteres neues Therapieverfahren ist ein elektronischer Stimulator des unteren Ösophagussphinkters (Endostim®). Dabei werden laparoskopisch 2 Elektroden in den gastroösophagealen Übergang eingebracht und an einen subkutan implantierten Schrittmacher angeschlossen. Der Schrittmacher kann elektromagnetisch über ein Tablet eingestellt werden. Die elektrischen Impulse führen zu einem Aufbau der Muscularis des unteren Ösophagussphinkters. Die Wirksamkeit des Verfahrens wurde in mehreren monozentrischen und 1 Multicenterstudie belegt [19–21]. Unter dieser Therapie trat bis jetzt weder eine Dysphagie noch ein Gas-Bloat auf. Das Verfahren kommt für Patienten mit Hernien unter 3 cm infrage. Für eine höhergradige Refluxösophagitis bzw. einen Barrett-Ösophagus ist Endostim® nicht zugelassen.
Alle beiden Verfahren sind derzeit in Deutschland zugelassen und werden klinisch angewandt. Eine Übersicht über die Vor- und Nachteile der unterschiedlichen antirefluxchirurgischen Operationen gibt die Tabelle 1. Hinreichende Studien über einen unmittelbaren Vergleich der neuen Therapieverfahren liegen noch nicht vor.
An der Uniklinik Mainz werden sowohl LINX® als auch Endostim® als alternative Verfahren zur Fundoplicatio bei Hernien unter 3 cm angeboten. Dabei wird Endostim® bevorzugt bei der Präsenz relevanter ösophagealer Motilitätsstörungen eingesetzt.
Interessenkonflikte: Der Autor hat keine deklariert
Erschienen in: Der Allgemeinarzt, 2018; 40 (6) Seite 48-52