Ist eine Salzrestriktion allgemein empfehlenswert oder nur für bestimmte Risikogruppen? Ist es günstig, die Zufuhr von Kohlenhydraten im Allgemeinen zu begrenzen oder muss man das differenziert betrachten? Hat Wein nur schädliche Effekte oder können sich moderate Mengen sogar gesundheitsfördernd auswirken? Im folgenden Beitrag sollen neue Erkenntnisse zu gängigen Ernährungsregeln vorgestellt werden.
Altbekannte und für Patienten mit erhöhtem Blutdruck relevante Ernährungsregeln werden derzeit durch aktuelle Daten infrage gestellt. Es geht dabei um die Salzrestriktion, den Kohlenhydratanteil der Nahrung und den moderaten Weingenuss im Rahmen einer mediterranen Ernährung [1, 4, 8, 9, 10, 14, 15, 16, 19, 20]. Die neue Evidenz ist Endpunkt-basiert und dürfte alte Surrogatparameter-basierte Sichtweisen ablösen. Zum anderen kristallisiert sich für die genannten Nahrungs- und Genussmittel ein "physiologischer" Bereich heraus mit dem jeweils geringsten Gesundheitsrisiko sowie die Notwendigkeit, im Einzelfall persönliche Präferenzen und die jeweilige kardiovaskuläre und metabolische Ausgangssituation zu berücksichtigen.
Salz
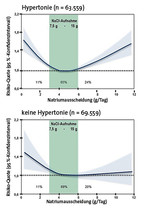
Eine aktuelle Metaanalyse deckt auf, dass bevölkerungsweite Salzrestriktion keineswegs allen nützt und einigen sogar schadet [15]. In die Analyse gingen Daten aus vier prospektiven Studien ein mit insgesamt 133.118 Studienteilnehmern (63.559 mit Hypertonie und 69.559 ohne Hypertonie; [2, 23, 24, 25]). Die Natriumausscheidung wurde über einen Zeitraum von vier Jahren mit tödlichen und nicht-tödlichen kardiovaskulären Endpunkten korreliert. Dabei zeigte die nach dem Merkmal Hypertonie differenzierte Auswertung erstmals, dass die bekannte U-förmige Assoziation zwischen der Natriumausscheidung und den kardiovaskulären Endpunkten nur für Menschen mit Hypertonie gilt. Deren Risiko für kardiovaskuläre Ereignisse stieg ab einer täglichen Natriumausscheidung von 6 g kontinuierlich an, während Menschen ohne Hypertonie selbst bei einer Natriumausscheidung von 12 g kein höheres Risiko hatten (Abb. 1). Im Gegensatz dazu nahm das kardiovaskuläre Risiko unterhalb einer täglichen Natriumausscheidung von 3 g unabhängig vom Blutdruck wieder zu.
Kohlenhydrate im Allgemeinen und Süßgetränke im Besonderen
Bei den Empfehlungen zum Kohlenhydratverzehr geht der Trend weg von der quantitativen Begrenzung – die Berechnung von Kohlenhydraten in Gramm bzw. das Zählen von Broteinheiten ist nur bei insulinbehandelten Diabetespatienten sinnvoll. Vielmehr sollte auf Ernährungsstile (z. B. mediterran) und vor allem auf die Qualität der Kohlenhydrate geachtet werden [1, 3, 7, 9, 14, 16, 20]. So sind die hochwertigen langsamen (faserreichen) Kohlenhydrate mit niedrigem glykämischen Index gegenüber den minderwertigen schnellen (Haushalts- und Fruchtzucker-haltigen) Kohlenhydraten generell und insbesondere bei Adipositas und Diabetes zu bevorzugen. Körperliche Aktivität eröffnet die Möglichkeit, zusätzliche Kohlenhydrate zu gestatten.
Vor allem für die sogenannten Süßgetränke wurden wiederholt gesundheitsschädigende Effekte im Zusammenhang mit Adipositas und Diabetes nachgewiesen, sie geraten daher völlig zu Recht zunehmend in die Kritik [22]. Wozu unbewusstes Ernährungsfehlverhalten im Zusammenhang mit dem Zuckerkonsum führen kann, zeigt exemplarisch das nicht seltene postbariatrische Hypoglykämiesyndrom (PBHS) [12]. Nach einer Magenbypassoperation gelangen aufgrund der anatomischen Veränderungen des Magens vornehmlich Flüssigkeiten und Glukose ohne Zeitverzögerung in die Roux-Schlinge. Akzelerierte Glukoseabsorption führt zu schnelleren und höheren prandialen Glukosespitzen. Hinzu kommt die in Relation zur postbariatrisch verbesserten Insulinsensitivität inadäquat gesteigerte Empfindlichkeit der Betazelle gegenüber Glukose [5, 6, 18]. Die nährstoffliche Analyse von 27 PBHS-Patienten (Tabelle 1) zeigt eine auf den ersten Blick eher niedrige Kohlenhydrataufnahme bei allerdings für die anatomische Situation viel zu hohem Haushaltszucker- und viel zu geringem Faseranteil [17].
Wein
Bereits Ende des vorletzten Jahrhunderts hat Carl von Noorden mit Hafertagen sowie der täglichen Gabe von bis zu 50 g Alkohol (in Form von Wein zu den Hauptmahlzeiten) die Glukoseausscheidung fast halbiert [21]. Die CASCADE-Studie [CArdiovaSCulAr Diabetes & Ethanol; 10] untermauert den günstigen Effekt moderaten Weinkonsums auf den Diabetes in einer Kohorte von 224 zielgerecht behandelten Typ-2-Diabetikern. Die Probanden konsumierten über einen Zeitraum von zwei Jahren im Rahmen einer ernährungsmedizinisch begleiteten, aber nicht kalorienreduzierten mediterranen Ernährung entweder 150 ml Rot- oder Weißwein oder Mineralwasser zum Abendessen. Als primäre Endpunkte waren zwar nur Surrogatparameter wie das Lipidprofil, glykämische Parameter und der Blutdruck definiert, trotzdem stellt diese Studie aufgrund dreier Besonderheiten einen Meilenstein in der Ernährungsforschung dar: das prospektive, randomisierte und kontrollierte Studiendesign (RTC), die homogene Kohorte, die bis zum Beginn der Studie nicht regelmäßig Alkohol getrunken hatte, sowie die molekulargenetische Erfassung der Varianten der Alkoholdehydrogenase. Die Effekte auf das Lipidprofil reproduzieren im Wesentlichen die vom moderaten Weingenuss bekannten Veränderungen – mit leichten Vorteilen zugunsten des Rotweins. Völlig neu ist allerdings die Stratifizierung nach Genotyp-Varianten der Alkoholdehydrogenase. Hier traten je nach Genotyp signifikante Unterschiede beim Blutdruck einerseits und bei den glykämischen Parametern andererseits auf, die nahelegen, dass es sich bei den Effekten um Ethanol-vermittelte Phänomene handelt. Dagegen wurde weder eine Gewichtszunahme noch eine veränderte Fettverteilung beobachtet [11, 13], obwohl der Wein in der traditionellen Einzelnährstoffbetrachtung als kalorienreich gilt.
Die prospektive MOLI-SANI-Kohortenstudie [4] zeigt bei 1.995 Diabetikern, dass die Mortalität über einen Beobachtungszeitraum von vier Jahren mit steigender Adhärenz zur mediterranen Ernährungsweise abnimmt. MOLI-SANI weist zudem nach, dass moderater Weingenuss im Rahmen einer mediterranen Ernährung das Einzelmerkmal mit dem höchsten erzielbaren Vorteil von allen mediterranen Nahrungsmitteln bei Menschen mit Diabetes darstellt.
Prof. Dr. med. Kristian Rett
Interessenkonflikte: Der Autor ist Präsident der Adipositas Stiftung Deutschland. Er hat den diesem Manuskript zugrunde liegenden Vortrag am 3.12.2016 auf dem 40. Wissenschaftlichen Kongress der Deutschen Hochdruckliga und der Deutschen Gesellschaft für Hypertonie und Prävention in Berlin anlässlich eines von der Adipositas Stiftung Deutschland ausgerichteten Workshops gehalten. Der Vortrag war nicht honoriert.
Der Autor ist außerdem ehrenamtliches Mitglied des Wissenschaftlichen Beirats der Deutschen Weinakademie.
Erschienen in: Der Allgemeinarzt, 2018; 40 (1) Seite 26-28