Die Zöliakie ist eine chronische Erkrankung des Dünndarms und wird durch eine Kombination von äußeren Ursachen (Gluten) und genetischen Faktoren ausgelöst. Grundlage der Therapie ist die glutenfreie Diät, die jedoch nicht bei jedem Patienten gleich gut wirkt und zum Teil auch nicht eingehalten wird. Erfahren Sie, welche alternativen oder unterstützenden Behandlungsmöglichkeiten derzeit erforscht werden.
Die einzig derzeit verfügbare Therapie gegen Zöliakie ist eine glutenfreie Diät mit Ausschluss sämtlicher glutenhaltiger Zerealien, z. B. Weizen, Roggen, Dinkel und anderer Nahrungsbestandteile mit natürlichem oder additivem Glutengehalt. Dennoch kann es auch bei kompletter Einhaltung der diätetischen Maßnahmen zu einem Versagen der glutenfreien Diät kommen.
Die Zöliakie tritt weltweit bei genetisch empfänglichen Menschen in ganz unterschiedlichen Regionen auf, mit einer Prävalenz von 0,5 bis 1 % in Amerika und Europa [1]. Es besteht eine strenge Abhängigkeit von den HLA-Haplotypen DQ2 und DQ8 [2]. Am häufigsten erkranken Menschen im Alter zwischen 1 und 8 Jahren bzw. zwischen 20 und 50 Jahren.
Symptome und Formen
Die klinischen Manifestationen der Zöliakie können stark variieren. So gibt es nahezu asymptomatische Verläufe sowie ein weites Spektrum von intestinalen Symptomen wie Diarrhoe, Steatorrhoe und Malabsorption (klassische Zöliakie). Daneben treten atypische Formen auf (neurologische Erkrankungen mit Depression und Ataxie), Formen mit gynäkologischen oder oralen Manifestationen oder Hauterkrankungen einschließlich der Dermatitis herpetiformes During. Die deutsche S2k-Leitlinie gibt einen Überblick über die klinischen Manifestationsformen einschließlich der alten und neuen Nomenklatur [3].
Die refraktäre Zöliakie basiert auf Veränderungen am T-Zell-Rezeptor intraepithelialer Lymphozyten und wird in zwei Gruppen unterteilt: RCD I und RCD II. Sie zeigen eine Zottenatrophie, unabhängig von diätetischen Maßnahmen über mehr als zwölf Monate [4, 5]. Während RCD I mit einem leichten Anstieg der Mortalität assoziiert ist, stellt RCD II eine deutlich schwerere Erkrankungsform dar, mit einer 5-Jahres-Mortalität von bis zu 15 % nach Diagnosestellung. Patienten mit RCD II haben das höchste Risiko einer Gluten-assoziierten T-Zell-Lymphomerkrankung [6].
Die tägliche Glutenaufnahme liegt im Allgemeinen bei ca. 15 bis 20 g [7]. Für Zöliakiepatienten ist die maximal tolerable Glutenaufnahmegrenze bei 10 bis 50 mg/Tag erreicht. Obwohl mehr als 95 % der Patienten einen unkomplizierten Verlauf aufweisen (unter glutenfreier Diät), ist die Diätadhärenz sehr variabel [8]. Darüber hinaus versagt die Diät im Hinblick auf histologische und klinische Remission bei 7 bis 30 % der Patienten [9], 2 bis 5 % entwickeln eine RCD. Die Lebensqualität verbessert sich nach Diagnosestellung und anschließender Diät [10]. Nach einer aktuellen Studie weisen Zöliakiepatienten jedoch zunehmend Vorbehalte gegenüber einer glutenfreien Diät auf, sodass therapeutische Alternativen notwendig werden [11].
Pathogenese und Umweltfaktoren
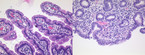
Proteine in diätetisch zugeführtem Getreide, wie Weizen, Roggen oder Dinkel, gehören zu den Umweltfaktoren bzw. Nahrungsbestandteilen, die eine Zöliakie ausbrechen lassen. Der hohe Gehalt an Glutamin und Prolin in Weizen spielt dabei eine Schlüsselrolle. Das Enzym Gewebstransglutaminase 2 (tTG2) bindet kovalent an Glutamine oder deaminiert diese. Die entstehenden Glutenpeptide führen im Dünndarm zur Aktivierung spezieller Lymphozyten – CD4-positiver T-Zellen [12]. Diese produzieren dadurch vermehrt entzündungsauslösende Botenstoffe wie Interleukin 15, sodass die epitheliale Zellapoptose erhöht wird [13]. Sind Zöliakiepatienten dem Gluten ausgesetzt, kommt es zudem zur Produktion von Autoantikörpern gegen tTG2. Anti-tTG2 haften an extrazelluläre Gewebstransglutaminase auf Dünndarmzellen. Sie lösen eine Enterozytenproliferation aus, was zu intestinaler Kryptenhyperplasie und Zottenatrophie führt (Abb. 1) und die epitheliale Barrierefunktion verschlechtert [14].Nicht-diätetische Therapie, neue (noch experimentelle) Ansätze
Neue Therapieformen betreffen entweder die krankheitsauslösenden Prolamine oder induzieren z. B. eine Toleranz gegenüber Gluten. Eine andere Strategie besteht in der Zufuhr von HMW-Polymeren, die Gluten selektiv binden und hierbei seinen Abbau und seine Absorption, insbesondere die Entstehung von immunogenen Peptid-Glutenpeptiden, verhindern [15]. Eine orale Enzymtherapie durch Supplementation von Prolylendopeptidasen stellt einen alternativen Ansatz dar [16, 17].
Larazotidacetat scheint die intestinale Integrität zu verbessern und so die Gluten-induzierte Exazerbation von gastrointestinalen Symptomen sowie die Anti-tTG-Bildung nach Glutenexposition zu vermindern. Larazotidacetat (0,5 mg) konnte die Anzeichen und Symptome bei einer glutenfreien Ernährung besser senken. Die Ergebnisse waren zwar uneinheitlich, dennoch kann diese Forschungsarbeit als erste erfolgreiche Studie zu einem Therapeutikum betrachtet werden, das die interzellulären Kontakte der Enterozyten bei Patienten mit Zöliakie reguliert, die trotz einer glutenfreien Ernährung Symptome aufweisen [18].
Da die Deaminierung von Gluten zwar nicht die entscheidende, aber doch eine wichtige Rolle in der Krankheitspathogenese spielt, ist die Inhibition der tTG ein logischer Therapieansatz. Es wurden tTG2-Inhibitoren entwickelt, die stabil und löslich als Therapeutikum im Gastrointestinaltrakt eingesetzt werden können [19].
Therapie
Basierend auf dem zunehmenden Verständnis der pathogenetischen Zusammenhänge bei Zöliakie wurden zahlreiche therapeutische Versuche zur Unterstützung bzw. zum Ersatz der glutenfreien Diät unternommen. Budesonid, ein topisches Glukokortikoid mit geringer systemischer Bioverfügbarkeit und bereits gut etabliertem Einsatz bei chronisch entzündlichen Darmerkrankungen (CED), wurde in einigen Studien als effektiv in der Behandlung der RCD und Non-RCD eingesetzt [20].
Auch Antikörper gegen den Zelloberflächen-Chemokinrezeptor CCR9 und das Integrinα4β7 können den intestinalen Schaden bei therapierefraktärer Zöliakie verhindern, indem sie die T-Zell-Aktivierung verhindern bzw. reduzieren. Vedolizumab, ein humanisierter α4β7-Integrinantikörper, wurde von der FDA und auch von der EMA 2014 erstmals als Antiadhäsionstherapie für die Behandlung von CED zugelassen.
Phase-2-Studien konnten zeigen, dass Etrolizumab, ein humanisierter monokloner IgG1-Antikörper gegen β7, eine effektive Therapie der Colitis ulcerosa darstellt [21]. Inhibitoren proinflammatorischer Zytokine, wie Interleukin 15, aber auch Tofacitinib, ein oraler Inhibitor der Januskinasen 1, 2 und 3, sind weitere Therapieansätze mit möglichem Einsatz bei RCD und Enteropathie-assoziiertem T-Zell-Lymphom (EATL).
Ebenso spielen potenzielle therapeutische Ansätze im Hinblick auf Interferon-Gamma und Tumornekrosefaktor(TNF)-α eine Rolle. Es ist bekannt, dass die Spiegel von TNF-α bei Patienten mit RCD deutlich erhöht sind [22]. CXCL-10- und CXCR-3-Antikörper gelten als weitere mögliche Therapieansätze, die aus der IBD-Therapie stammen.
- Alle serologischen Tests sollten in akkreditierten Laboren durchgeführt werden.
- Gesamt-IgA- und IgA-Tissue-Transglutaminin-AK sollte man als erste Wahl bestimmen.
- IgA-Endomysium-AK können zudem kontrolliert werden.
- IgG gegen deaminiertes Gliadin oder IgG-TTTG kommen bei bei IgA-Defizienz zum Einsatz.
- HLA-DQ2, -DQ8-Bestimmungen erfolgen nur in Ausnahmefällen.
Zusammenfassung
In den letzten Jahren hat sich das Verständnis der Zöliakie deutlich verbessert. Zahlreiche nicht-diätetische Behandlungsoptionen, zumindest im Sinne einer supportiven Therapie, sind inzwischen denkbar. Bis heute konnten sich jedoch nur wenige experimentelle Therapieformen für die Zöliakie in randomisierten Phase-1- und Phase-2-Studien durchsetzen. Hierzu zählt das Larazotidacteat (AT-1001). Andere Therapieansätze, wie die tTG2-Inhibition oder die Maximierung zur Induktion einer Toleranz gegenüber oral aufgenommenem Gluten, sind noch im experimentellen Stadium.
Interessenkonflikte: Die Autorin hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2016; 38 (18) Seite 24-28