Krebspatienten leiden häufig unter Tumorschmerzen. Diese können ganz unterschiedliche Auslöser haben und sind zum Teil auch durch die onkologische Behandlung selbst bedingt. Neben der Ursache ist für eine individualisierte Therapie auch die Schmerzart zu berücksichtigen. Nach wie vor gilt das WHO-Stufenschema, wobei Stufe 2 auch durchaus übersprungen werden kann.
Während zu Erkrankungsbeginn schon 20 – 50 % der Tumorpatienten über Schmerzen klagen, sind es in fortgeschrittenen Stadien bis zu 90 % [2]. Therapierelevant für die Behandlung von Tumorschmerzen sind deren Ursachen. Hier muss der Arzt tumor- und therapiebedingte sowie tumorassoziierte und tumorunabhängige Auslöser unterscheiden (Tabelle 1). Neben der symptombezogenen körperlichen Untersuchung samt Erhebung des neurologischen Status gilt die ausführliche Anamnese als Voraussetzung für eine adäquate Schmerztherapie. Dabei ist die Erfassung der Schmerzqualität differenzialdiagnostisch sehr bedeutsam. Es gilt, nozizeptive von neuropathischen Schmerzen zu unterscheiden.
Der nozizeptive Schmerz ist gut lokalisierbar und wird von den Patienten in der Regel als scharf, stechend und teilweise als pulsierend oder belastungsabhängig beschrieben. Man grenzt somatische Schmerzen in der Haut, in den Weichteilen und in den Knochen von viszeralen Schmerzen im Darm oder in anderen Hohlorganen ab. Viszerale Schmerzen durch Tumorbefall können aufgrund ihrer Symptomatik (dumpf, diffus, schlecht lokalisierbar, teilweise krampfartig) schwer zu diagnostizieren sein.
Neuropathische Schmerzen haben ihre Ursache in geschädigtem Nervengewebe (z. B. Tumoreinbruch in Nervenstrukturen, Chemotherapeutika, Diabetes mellitus) und sind durch brennende, elektrisierende, plötzlich einschießende Schmerzen gekennzeichnet. Nozizeptive und neuropathische Schmerzen treten bei 65 % der Tumorpatienten gemeinsam als sogenannter "gemischter Schmerz" (mixed pain) auf. Die Schmerzintensität sollte regelmäßig anhand der Numerischen Rating-Skala (NRS) sowohl für den Ruhezustand als auch unter Belastung abgefragt werden (0: kein Schmerz; 10: stärkste vorstellbare oder erlebte Schmerzen).Für eine drastische Exazerbation der Schmerzen können bislang unbekannte Metastasen oder ein Tumorrezidiv verantwortlich sein. Hier ist der behandelnde Onkologe unbedingt zu informieren. Bei der Anamnese chronischer Tumorschmerzen sollten neben körperlichen auch psychische und soziale Faktoren berücksichtigt werden.
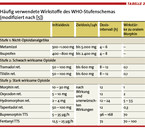
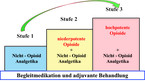
Grundlage der medikamentösen Schmerztherapie bei onkologischen Patienten ist das seit 1986 bekannte Stufenschema der WHO (Abb. 1), womit sich 80 % der Tumorschmerzen zufriedenstellend behandeln lassen. Bei mäßigen Schmerzen (NRS 1 – 3) werden Nicht-Opioidanalgetika eingesetzt (Stufe 1), bei stärkeren (NRS 4 – 6) zusätzlich schwach wirksame Opioide verordnet (Stufe 2) und bei stärksten (NRS 7 – 10) stark wirksame Opioide mit Nicht-Opioidanalgetika kombiniert (Stufe 3). Häufig verwendete Substanzen der drei Stufen und die entsprechenden Dosierungen sind in Tabelle 2 dargestellt.
WHO-Stufe 1
Metamizol und Ibuprofen sind die empfehlenswerten Präparate der WHO-Stufe 1. Da Ibuprofen häufig für gastrointestinale Nebenwirkungen verantwortlich ist, sollte man begleitend Protonenpumpen-Inhibitoren geben und eine Dauertherapie möglichst vermeiden. Entsprechend den Kontraindikationen von COX-2-Inhibitoren wurden auch für Diclofenac Warnhinweise bei Patienten mit kardiovaskulären Risikofaktoren ausgesprochen [1]. Paracetamol sollte man wegen seiner geringen analgetischen Potenz bei Tumorschmerzen nicht mehr verwenden.
WHO-Stufe 2
Die schwach wirksamen Opioide Tramadol und Tilidin in Verbindung mit Naloxon verlieren aufgrund ihres breiten Spektrums an unerwünschten Arzneimittelwirkungen (vor allem Übelkeit) an Bedeutung. Daher kann die WHO-Stufe 2 zugunsten eines niedrig dosierten, stark wirksamen Opioids der WHO-Stufe 3 nach heutiger Expertenmeinung problemlos übersprungen werden. Dies gilt beispielsweise für 5 mg Oxycodon/Naloxon, das bei besserer Verträglichkeit eine analgetisch vergleichbar potente Wirkung zeigt wie 50 mg Tramadol bzw. 50 mg Tilidin/Naloxon.
WHO-Stufe 3
Die Auswahl des passenden Opioids wird von der individuellen Verträglichkeit und möglichen Organdysfunktionen des Patienten bestimmt. Auch die Applikationsform und die Erfahrung des behandelnden Arztes mit der Substanz sind hierbei relevant. Zur oralen Verabreichung sind Morphin, Oxycodon und Hydromorphon verfügbar. Darüber hinaus gibt es den in der EU seit 2010 zugelassenen μ-Agonist und Noradrenalin-Wiederaufnahmehemmer Tapentadol. Als transdermale Systeme werden die Wirkstoffe Buprenorphin und Fentanyl eingesetzt. Methadon und Levomethadon können in bestimmten Fällen für Tumorpatienten hilfreich sein, eignen sich wegen ihrer interindividuell sehr variablen Eigenschaften (u. a. Kumulation) jedoch nicht routinemäßig. Die in vitro nachgewiesenen tumorbeeinflussenden Fähigkeiten von Methadon werden derzeit diskutiert [3].
Retardierte Opioide mit langer Wirkdauer sollte man als Basistherapie nach einem festen Einnahmeschema verwenden (Abb. 2). Zum Erhalt der Selbstständigkeit des Patienten sind nichtinvasive Applikationsformen (oral oder transdermal) zu empfehlen. Für die individuelle Dosis werden Opioide anhand von Wirkung und unerwünschter Wirkung auftitriert. Beim Opioid-naiven Patienten beginnt man mit einer niedrigen bzw. der niedrigsten Dosierung. Mit Ausnahme von Buprenorphin (Ceiling-Effekt) gibt es für die retardierten Opioide der WHO-Stufe 3 beim Erwachsenen keine Maximaldosierungen. Die Dosis des Opioids wird mit der Numerischen Rating-Skala festgelegt, wobei man initial eine NRS von 2 anstrebt. Bei neu eingestellten Patienten sollte der Erfolg der Initialtherapie immer kurzfristig kontrolliert werden. Feineinstellungen finden im weiteren Verlauf statt. In Einzelfällen können Therapiekontrollen auch telefonisch oder per E-Mail erfolgen. Neben der Medikation entscheidet auch ein vertrauensvolles Arzt-Patienten-Verhältnis über den Therapieerfolg.
Obstipationsbeschwerden sind neben Übelkeit und Erbrechen typische und sehr häufig auftretende unerwünschte Arzneimittelwirkungen von Opioiden. Abgesehen von der Verstopfung verschwinden die opioidbedingten Nebenwirkungen meist nach einigen Tagen bis Wochen. Eine dauerhafte begleitende Verordnung von Laxantien (z. B. Natriumpicosulfat oder Macrogol) sowie die vorübergehende Anwendung von Antiemetika in der Einstellungs- oder Umstellungsphase sollen standardmäßig erfolgen. Zur Abdeckung von plötzlichen Schmerzattacken (Durchbruchschmerzen) müssen Patienten mit Tumorschmerzen kurzwirksame Bedarfsmedikamente verfügbar sein. In Ergänzung zur Basistherapie mit Retard-Opioiden gibt es schnell wirksame Opioide zur Behandlung von Tumorspitzenschmerzen.
Vorhersehbare Spitzenschmerzen (z. B. durch Mobilisierung oder Nahrungsaufnahme) kann man mit unretardierten Präparaten behandeln, indem sie entsprechend der Dauer bis zum Wirkeintritt frühzeitig eingenommen werden. Zur Therapie unvorhersehbarer Spitzenschmerzen (z. B. unwillkürliches Husten oder Niesen) eignen sich schnell wirksame Fentanyl-Präparate, die unter bestimmten Voraussetzungen verordnet werden können [4]. Müssen innerhalb von 24 Stunden vermehrt schnell wirksame Präparate eingenommen werden, sollte der Arzt die Basistherapie angemessen erhöhen. Eine Verkürzung der Einnahmeintervalle der Basismedikation ist nicht empfehlenswert.
Neuropathien gelten allgemein als schwer zu behandeln und sind durch Opioide allein nicht immer ausreichend therapierbar. Die Intensität von brennenden neuropathischen Schmerzen lässt sich durch Antidepressiva in einer deutlich niedrigeren Dosierung als zur Behandlung von Depressionen verbessern. Zur Wahl stehen hier Amitriptylin (Initialdosis 10 – 25 mg, nur zur Nacht) oder Duloxetin (Initialdosis 1 x 30 mg) unter Beachtung unerwünschter Arzneimittelwirkungen und Kontraindikationen.
Bei einschießenden, elektrisierenden neuropathischen Schmerzen sind die Antikonvulsiva Pregabalin (Initialdosis 2 x 25 mg) oder Gabapentin (Initialdosis 3 x 100 mg) indiziert. Eine Dosissteigerung kann abhängig von unerwünschten Arzneimittelwirkungen alle zwei Tage bis zu Höchstdosen von 2 x 300 mg Pregabalin bzw. 3 x 800 mg Gabapentin erfolgen. Weitere Koanalgetika wie Kortikosteroide oder Bisphosphonate werden ergänzend zur oben genannten Schmerztherapie bei Tumorpatienten mit Knochenschmerzen verwendet.
Seit März 2017 können medizinische Cannabispräparate für schwerstkranke Patienten einfacher verschrieben werden. Eindeutige Indikationen zur Verordnungsfähigkeit nennt der Gesetzestext aber nicht. Vor der Behandlung sollte die Kostenübernahme der Kasse vorliegen [6]. Nur bei wenigen Patienten zeigen sich jedoch durchgreifende Erfolge. Bei Tumorpatienten mit neuropathischen Schmerzen können Cannabinoide hilfreich sein und in der palliativen Situation appetitsteigernde und stimmungsaufhellende Wirkungen zeigen. Ein breiter Einsatz von Cannabis ist hier nicht zuletzt aufgrund der interindividuell stark variierenden Eigenschaften äußerst kritisch zu sehen.
Eine effektive Schmerztherapie folgt einem multiprofessionellen Ansatz. Ergänzend zu den pharmakologischen Therapien profitieren die Patienten von einer interdisziplinären Zusammenarbeit. Physiotherapeutische und psychosoziale Maßnahmen sind besonders geeignet, um Tumorschmerzen zu reduzieren. In Einzelfällen können auch strahlentherapeutische Optionen beachtliche Effekte für die betroffenen Patienten bewirken.
Dr. med. Marcus J. P. Geist
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2017; 39 (20) Seite 24-28