Krebs im Alter wirft viele Fragen auf: Ist der vielleicht schon hochbetagte Patient überhaupt noch fit genug, um eine Tumortherapie durchzustehen? Spielt seine Lebenserwartung eine Rolle bei der Behandlungswahl? Welche Begleiterkrankungen sind zu berücksichtigen? Kann er noch selbst über seine Therapie entscheiden? Ein hilfreiches Instrument ist hier das geriatrische Assessment.
Viele Tumorerkrankungen zeigen eine zunehmende Prävalenz im höheren Lebensalter oder auch einen Häufigkeitsgipfel jenseits des 65. Lebensjahrs. Dies gilt z. B. für gastrointestinale Tumoren, das Mammakarzinom und das nicht kleinzellige Bronchial-Karzinom [1].
Auch geriatrische Syndrome beeinflussen – zumindest bei den über 80-Jährigen – erheblich die Therapie einer onkologischen Erkrankung. Zu diesen Syndromen zählen eine Reihe von Gesundheitsproblemen, die von Stürzen über Immobilität, kognitive Defizite, Inkontinenz, Malnutrition bis zur Gebrechlichkeit reichen. Unter Gebrechlichkeit versteht man heute eher neue Begriffe wie Sarkopenie und Frailty. Damit wird versucht, die abnehmende muskuläre Kraftreserve mit zunehmendem Alter zu beschreiben. Die hier angeführte Liste an geriatrischen Syndromen ist nicht vollständig und unterliegt weiter Diskussionen und Neudefinitionen. Die genannten Punkte haben sich aber in den letzten Jahrzehnten als stabil erwiesen. Diese Syndrome sind an den Einschränkungen der Funktionalität ausgerichtet. Sie treten mit zunehmendem Lebensalter immer dominanter auf. Ist bei den über 65-Jährigen insgesamt nur maximal ein Drittel von funktionellen Einschränkungen betroffen, liegt dieser Anteil bei den über 80-Jährigen schon bei über 50 Prozent. Das Risiko-Nutzen-Verhältnis ist gerade für riskantere und mit unerwünschten Wirkungen einhergehende Behandlungen, wie sie typisch für die Onkologie sind, bei der Therapieplanung essenziell bedeutsam.
Epidemiologische Studien gelten heute als wichtigste Quelle für Evidenz, insbesondere in kontrollierten Ansätzen. Die überwiegende Mehrzahl dieser Studien aus der Onkologie, aber auch aus anderen Fachbereichen, wird mit jüngeren Patienten durchgeführt und nicht mit einer repräsentativen Gruppe des Gesamtkollektivs. Dies hat methodologische Gründe, führt aber dazu, dass bei Anwendung der Studienergebnisse für die älteren Patienten häufig eine Extrapolation vorgenommen werden muss. Das betrifft vor allem den Anteil der bereits durch Alters-Gebrechlichkeit (Frailty) geprägten älteren Patienten und die Prävalenzraten kognitiver Einbußen. Es handelt sich hier um bedeutsame Aspekte, die in der klinischen Praxis oftmals Entscheidungen sehr stark beeinflussen. Allgemein wird eine gewisse Zögerlichkeit beobachtet, diese Aspekte im klinischen Alltag zu integrieren.
Hier sollten die von Gillick [2] geprägten Kategorien der älteren Menschen beachtet werden. Sie formulierte vier Gruppen: robuste ältere Menschen (fit), ältere Patienten, die durch Gebrechlichkeit (frail) oder durch kognitive Beeinträchtigungen geprägt sind (Demenz), sowie ältere Menschen in ihrer terminalen Lebensphase (sterbend). Für die erste Gruppe können ohne weitere Bedenken die Therapiestrategien angewendet werden, die auch für jüngere Erwachsene gelten. Für die anderen Gruppen ist dies nicht so einfach der Fall.
Potenziale des geriatrischen Assessments
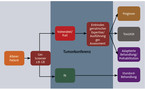
Um diese Gruppen zu unterscheiden und individuelle Aspekte der Funktionalität zu beschreiben, kann das geriatrische Assessment gut genutzt werden. Dieses Instrumentarium wurde entwickelt, um das Vorhandensein und Ausmaß geriatrischer Syndrome und damit auch wichtiger funktioneller Einschränkungen darzustellen und quantifizieren zu können. Es eignet sich sehr gut, um im Vorfeld belastender Therapiestrategien (z. B. Operationen) eine Abschätzung hinsichtlich spezieller geriatrischer Risiken und Risiko-Gruppen vorzunehmen; quasi als Fitness-Check, bevor die Therapieschritte konkret, z. B. in einer Tumorkonferenz, geplant werden. Diese Potenziale werden aktuell zu wenig genutzt, sind aber recht gut in ihrer Wirksamkeit erforscht und werden auch von der spezialisierten Fachgesellschaft (SIOG)[3] zur Risikostratifizierung in der Onkologie empfohlen.
Ein früher Versuch der Risikostratifizierung in der Onkologie ist die noch relativ grobe Einteilung von Balducci und Extermann[4]. Anhand der Einschränkungen der Alltagskompetenz – sie nutzten dafür die gängigen ADL- und IADL-Skalen bzw. -Domänen – beschrieben sie drei Kategorien: fit – vulnerable – frail. Die Entwicklung geht jetzt dahin, kurze und einfache Screening-Instrumente zu entwickeln und zu evaluieren. Sie lassen eine sinnvolle Auswahl zu, welche Patienten einem ausführlicheren Assessment zugeführt werden sollen. Diese Screener sollen die Kategorie "fit" von den anderen unterscheiden. Weiter sollen sie von allen Ärzten oder Pflegern leicht eingesetzt werden, so dass eine schnelle und einfache Vorauswahl erfolgen kann.
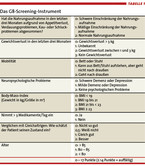
Ein solches abgestuftes Vorgehen ist auch deshalb sinnvoll, weil einige im klassischen geriatrischen Assessment angewendete Verfahren eine einschlägige Expertise erfordern und ein komplettes geriatrisches Assessment relativ zeitaufwendig ist. Abb. 1 stellt dieses abgestufte Verfahren dar. Aktuell wird beim Screening auf geeignete Kandidaten für ein komplettes geriatrisches Assessment das G8-Instrument favorisiert(vgl. Tabelle 1) [5]. Es ist für die Identifizierung geriatrischer Probleme bei onkologischen Patienten validiert und auch von Personen außerhalb des geriatrischen Erfahrungshorizonts leicht anzuwenden.
Vulnerabilität bedeutet im Alter auch ein erhöhtes Risiko für spezielle Risiko-Ereignisse, wie Stürze und Verwirrtheitszustände. Beide sind mit einer erhöhten Morbidität und Mortalität verbunden. Sie zeigen meist auch ein erhöhtes Risiko für ein erneutes Auftreten. Hauptsächlich ist dies für die präoperative Planung bedeutsam, um rechtzeitig Gegenmaßnahmen ergreifen zu können. Hier ist die perioperative Prophylaxe durch das Vermeiden sensorischer Stressoren relevant. Gleiches gilt für eine möglichst frühe Integration rehabilitativer Maßnahmen (Früh-Rehabilitation), um ein relevantes Deconditioning und eine eventuell bleibende, signifikante, zusätzliche lokomotorische Einschränkung zu umgehen.
Neben diesen geriatrischen Risiko-Ereignissen ist auch zu bedenken, dass ältere Patienten eine höhere Bereitschaft für organ- bzw. systembezogene Komplikationen aufweisen, wie Nierenfunktionsstörungen, Hyponatri-ämie oder orthostatische Dysregulation durch erhöhte Vulnerabilität der zugrundeliegenden Homöostase.
Geriatrisches Assessment kann auch helfen, die Prognose bezüglich eines mit Chemotherapie verbundenen Toxizitätsereignisses allgemein besser abzuschätzen. Dies wurde in zwei wichtigen Untersuchungen gezeigt. Auch leitete man entsprechende Instrumente ab, die über Punktwerte eine solche spezielle Risiko-Einschätzung unterstützen. Diese sind noch nicht weit verbreitet, aber besonders der von Hurria entwickelte Ansatz[6] würde sich für die breitere Anwendung eignen. Damit wird zwar nicht das sorgsame Monitoring hinsichtlich eventuell auftretender Unverträglichkeiten ersetzt, aber man kann eine Dosisanpassung, insbesondere bei klassischen Therapie-Strategien, unterstützen. Zu bedenken ist auch, dass mit zunehmendem Alter die Organreserven schwinden. Dies gilt besonders für die Nierenfunktion. Hier sollten immer Schätzformeln eingesetzt werden, um nicht eine gravierend verminderte glomeruläre Filtrationsrate zu übersehen.
Geriatrie und Tumortherapie
Die Behandlungssituation kann sich bei älteren Tumorpatienten verkomplizieren – durch die gegenseitige Verstärkung geriatrischer Syndrome und spezifischer Probleme innerhalb der Tumorbehandlung. So können kognitive Defizite oder vorbestehende depressive Störungen mit Fatique interagieren bzw. die kognitive und psychische Situation des Patienten deutlich verschlechtern. Weiter kann bei einer Tumorerkrankung eine Kachexie auftreten. Diese zeigt häufig die letzte Lebens- und Krankheitsphase an. Bei bereits durch Sarkopenie muskulär beeinträchtigten älteren Patienten werden diese Effekte erheblich verstärkt und führen rasch zum Verlust von Lokomotion und Alltagskompetenz. Schließlich ist das Zusammentreffen von meist multifaktoriell bedingter, geriatrietypischer Mangelernährung mit Appetitlosigkeit in der Tumortherapie ungünstig und eine weitere Kaskade, die letztlich zu Verlust an Alltagskompetenz, aber auch Lebensqualität führt.
Zu wenig bedacht wird häufig, inwiefern sich erkannte Probleme oder Einschränkungen bessern oder zumindest flankierend behandeln lassen, um resultierende Komplikationen zu minimieren. Trat z. B. schon mal ein Verwirrtheitszustand bei einem Patienten auf, sollte darauf geachtet werden, bei ihm zusätzlichen Stress und Belastungen während der Behandlung zu vermeiden. Hier sind die Prinzipien der Delir-Prophylaxe zu berücksichtigen. Viele ambulante und stationäre Settings nehmen aber darauf nur wenig Rücksicht (z. B. das Stören des Tag-Nacht-Rhythmus, eine zu starke Geräuschkulisse oder fehlende Möglichkeiten, Begleitpersonen optimal zu integrieren).
In der lokomotorischen Situation helfen unterstützende therapeutische Maßnahmen zum Erhalt der Balance-Fähigkeit und Kraft, aber auch der vorausschauende Einsatz von Hilfsmitteln. Zudem sind z. B. häufig eine frühzeitige Unterstützung und Sicherung der Eiweißaufnahme und individuelle Ernährungskonzepte hilfreich. Diese sollten auch auf den Erhalt der Lebensqualität fokussieren. Hier sind Potenziale in der Therapie möglich – bis in die letzten, gänzlich von palliativmedizinischen Gesichtspunkten geprägten Krankheitsphasen.
Auch die psycho-onkologische Unterstützung der älteren Tumorpatienten ist wichtig. Depressive Störungen sind im höheren Lebensalter häufig und zeigen oft von jüngeren Patienten abweichende Symptommuster. Häufig sind u. a. dysthyme und eher chronische Formen.
Strukturierte Vorbereitungsprogramme (Prehabilitation) vor belastenden Therapien nutzen zu können – analog zu den in der Rehabilitation verwendeten Programmen –, ist leider noch Zukunftsmusik. Für die nicht kleine Gruppe älterer Patienten, die z. B. nach Balducci und Extermann als vulnerabel eingestuft werden, wäre es eine Option, bei besserbarer oder kompensierbarer Vulnerabilität doch eine Operation oder ein komplexes Therapieverfahren zu ermöglichen oder die zu erwartenden Risiken zu minimieren. Dies erfordert zwar ein gewisses Zeitfenster von wenigen Wochen, könnte aber die Behandlungsqualität erheblich verbessern. Solche Konzepte sind leider aktuell nicht ausreichend unterstützt oder institutionell verankert.
Auch klassische rehabilitative Ansätze sind für ältere Patienten oft schwer zu realisieren, da viele Anbieter konventioneller Tumor-Nachsorge-Programme auf Psycho-Onkologie fokussieren. In der klassischen geriatrischen Rehabilitation sind dagegen die Behandlungsprogramme nicht primär auf die Bedürfnisse des onkologischen Patienten fokussiert (z. B. Fatigue). Hier stehen die Altersgebrechlichkeit, apoplektische Insulte und erlittene Frakturen (besonders Hüftfraktur) quasi als Modell-Krankheitsbilder im Fokus. Dennoch wäre dies eher der Platz für rehabilitative Maßnahmen bei älteren Patienten, besonders dann, wenn schon geriatrische Syndrome vorhanden sind.
Adhärenz-Probleme
Adhärenz-Probleme entstehen bei älteren Patienten in erster Linie durch funktionelle Einschränkungen wie reduzierter Visus, kognitive Schwierigkeiten oder auch Probleme mit Lokomotion und Feinmotorik. Dies kann relativ einfach durch Screening-Maßnahmen – unter Verwendung von Teilen des geriatrischen Assessments – überprüft werden. Besonders geeignet ist hier der sogenannte Geldzähltest nach Nikolaus[7].
Fazit
Die Entwicklungen in der Onkologie zeigen: Durch die zunehmende Vielfalt, besonders der Tumoraspekte, werden die Therapiestrategien immer individueller ausgerichtet. Neben den Besonderheiten der einzelnen Tumorarten, z. B. was die Repräsentanz bestimmter zellulärer Oberflächenmerkmale angeht, sind auch patientenbezogene Aspekte stärker in das therapeutische Kalkül einzubeziehen. Hier können die oben genannten Kriterien einen wichtigen Beitrag leisten, um adäquate, individuelle Lösungen zu finden.
In der Behandlung älterer Patienten ist ein erster wichtiger Schritt, die relevanten, altersmedizinischen Besonderheiten zu identifizieren, wie Altersgebrechlichkeit oder kognitive Einschränkungen. Hier geht es beim Blick auf die – in dieser Altersklasse per se eventuell – reduzierte Lebenserwartung auch stark darum, diese prognostisch abzuschätzen. Viele ältere Menschen werden vermutlich abwägen: mehr Lebenszeit versus bessere Lebensqualität durch Vermeidung belastender Therapie – und die letztgenannte Option dann bevorzugen. Eine ernst gemeinte individualisierte Therapie wird nicht ohne die Würdigung dieser Aspekte auskommen. Und ohne eine solch individualisierte Therapie können therapeutische Potenziale der modernen Tumortherapie nicht optimal realisiert werden.
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2017; 39 (16) Seite 64-70