Die erfolgreiche Behandlung von Schmerzen ist eine anspruchsvolle Aufgabe, die Erfahrung und Wissen erfordert. Glücklicherweise ist ein Großteil tumorbedingter Schmerzen gut zu behandeln. Geeignete Pharmaka müssen die jeweilige Pathophysiologie des Tumorschmerzes und individuelle Patientengegebenheiten berücksichtigen. Daneben dürfen die anderen Therapiemaßnahmen nicht vergessen werden, um ein ganzheitliches Konzept gegen den Tumorschmerz einzusetzen.
Weltweit sterben etwa 5 Millionen Menschen pro Jahr infolge von Tumorerkrankungen, davon alleine 210 000 im Jahr 2009 in Deutschland [1]. Man geht davon aus, dass ca. 500 000 Menschen in unserem Land an „Tumorschmerzen“ leiden, von denen wahrscheinlich über 90 % durch eine effektive und ausgewählte medikamentöse Schmerztherapie zufriedenstellend „schmerzreduziert“ werden könnten. Allerdings stellen Schmerzen nach heutigem Verständnis ein multidimensionales Ereignis dar, das seit über 40 Jahren am besten mit dem „biopsychosozialen Modell“ beschrieben wird [2], wonach Folgen der Krebserkrankung und ihre Auswirkungen auf andere Aspekte des Patientenlebens eine Rolle spielen. Hierzu gehören insbesondere Ängste, soziale Bindungen und Unterstützung durch die Familie und Freunde des Patienten. Eine erfolgreiche Schmerztherapie bezieht daher auch diese Bereiche mit ein (Abb. 1).
Die Ursachen für die oftmals unzureichende Versorgung von Patienten mit Tumorschmerzen können auf folgende Hauptursachen zurückgeführt werden:
- mangelnde Kenntnisse in der Schmerztherapie
- unzureichende Versorgungsstrukturen
- fehlende Erfahrung des Therapeuten
- unzureichende finanzielle Mittel, insbesondere Angst vor Regressen durch die KVen
- Ängste vor Opioiden
- schlichte Vernachlässigung des "Schmerz-Problems" im Kontext einer malignen Erkrankung
- Konzentration auf „biologische“ Faktoren und Vernachlässigung anderer „psychosozialer“ Faktoren, die das Schmerzerleben modulieren können
Ursachen von Tumorschmerzen
„Tumorschmerzen“ können auf verschiedene Ursachen zurückgeführt werden. Neben dem Tumor selbst (60 – 90 %), der durch Knochen- und Weichteilinfiltration Schmerzen auslösen kann, können Nerven und Blutgefäße durch den Tumor komprimiert werden und so Schmerzen auslösen. Zusätzlich sind in 5 – 20 % paraneoplastische Syndrome, Zosterneuralgien oder Infektionen verantwortlich für Schmerzen. Darüber hinaus können therapiebedingt durch Operationen, Bestrahlung oder Chemotherapie sowohl Nervendestruktionen, Ödeme, Mukositiden oder Läsionen an sich gesunder Gewebe ausgelöst werden, die sich auf die durch den Tumor ausgelösten Schmerzen „aufpfropfen“. Vergessen wird oftmals, dass die Patienten auch vor ihrer Tumorerkrankung schmerzbedingte Therapien benötigten, die eine Weiterbehandlung auch während des Tumorleidens verlangen.
In den vergangenen 25 Jahren erfolgte die Schmerztherapie des Tumorpatienten nach den Empfehlungen der WHO (Abb. 2). Auch wenn die Hauptempfehlungen bis heute gültig sind, so zeigt das WHO-Schema einige Schwachpunkte. So führt die ausschließliche Orientierung an der Schmerzstärke des Patienten oftmals nicht zur geeigneten Medikamentenauswahl und dem gewünschten Ergebnis der Schmerzlinderung.
Differenzierung von Schmerzen
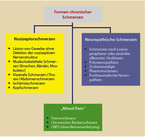
Unter dem Stichwort „mechanismen-orientierte Therapie“ wird aktuell ein anderer Blickwinkel auf den Tumorschmerz eingenommen, von dem man sich eine weitere Verbesserung der Therapie erhofft [3]. Biologische Mechanismen im Zusammenhang mit dem Tumorgeschehen führen zu spezifischen Symptomen, die mit einer spezifischen Therapie zu behandeln sind. Bei der Einschätzung der Schmerzen muss der Arzt zunächst eine Charakterisierung vornehmen [4] (Abb. 3). Dies wird im Einzelfall viel früher Co-Analgetika aus dem WHO-Stufenplan zum Einsatz kommen lassen, als dies in der Vergangenheit bei der konsekutiven „Abarbeitung“ des WHO-Stufenschemas der Fall war. Einen Überblick über die Möglichkeiten der Co-Analgetika gibt Tabelle 4. Bei der Differenzierung und Zuordnung des Schmerzbildes werden folgende Schmerzen unterschieden (vgl. Tabellen 1 und 2):
- Nozizeptorschmerzen vom muskuloskelettalen Typ
- Nozizeptorschmerzen vom viszeralen Typ
- Neuropathische Schmerzen
- "Mixed Pain"
Insbesondere die Detektion neuropathischer Schmerzen kann für den in der Schmerztherapie unerfahrenen Arzt schwierig sein. Hierbei können Screening-Instrumente wie der painDetect®-Bogen des Deutschen Forschungsverbundes Neuropathischer Schmerz eine Unterstützung darstellen ( http://www.pain-detect.de ).
Dauer- oder Durchbruchschmerz?
Für eine adäquate Behandlung ist zusätzlich die genaue Unterscheidung wichtig, ob es sich um „Dauerschmerzen“ oder „Durchbruchschmerzen“ handelt.
Durchbruchschmerzen werden nochmals unterteilt in Schmerzen, die unvorhergesehen (ohne Ankündigung) als „breakthrough pain“ auftreten, und Schmerzen, die durch Aktivitäten wie Bewegung, Nahrungsaufnahme, Defäkation etc. getriggert werden – „incident pain“. Während Dauerschmerzen durch die seit 15 Jahren existierenden Opioid-Retardpräparate vergleichsweise gut behandelt werden können, stellt die Behandlung von echtem „breakthrough pain“ ein großes Problem dar. Bei ca. 60 % der Tumorschmerzpatienten treten diese auf und gelten als oftmals vernachlässigtes Problem. Bei 75 % dieser Patienten dauern diese akuten Schmerzspitzen ≤ 30 Minuten, nur bei 7 % länger als 60 – 90 Minuten [5].
Daneben spielt auch die Stärke von Schmerzen eine wichtige Rolle. Sie werden am besten subjektiv durch den Patienten angegeben. Hierbei kommen vor allem die Numerische Rating-Skala (NRS), die Verbale Rating-Skala (VRS) und die Visuelle Analog-Skala (VAS) zum Einsatz.
- NRS und VAS: 0 = kein Schmerz, 10 = stärkster vorstellbarer Schmerz
- VRS: kein Schmerz, erträglicher Schmerz, nicht-erträglicher Schmerz, Bestimmung jeweils in Ruhe und bei Belastung
Anforderungen an eine orale Schmerztherapie
Oberste Therapiemaxime ist eine ausreichende Wirksamkeit bei akzeptabler Verträglichkeit, die jedoch häufig schwer zu erreichen ist. Dabei scheint die gute Verträglichkeit von Medikamenten besonders wichtig zu sein, da bis zu 25 % der Patienten in Studien die Medikamenteneinnahme wegen der Nebenwirkungen abbrechen, während nur 12 % diese wegen ungenügender Wirksamkeit beenden [6]. Appetitverlust, Übelkeit und Erbrechen, Schwindel und Konzentrationsschwierigkeiten gehören dabei zu den Hauptnebenwirkungen.
Die Konsequenz aus den vorliegenden Untersuchungen ist deshalb eine strikte, prophylaktische Behandlung bekannter, häufig auftretender Nebenwirkungen. Dazu gehören die mit der ersten Opioidgabe zu startende antiemetische Prophylaxe und Substanzen gegen die opioidinduzierte Obstipation. Die Vielzahl der an der Nausea und Emesis beteiligten nervalen Strukturen macht die Behandlung komplex und erfordert ein sinnvolles Stufensystem. Eine Möglichkeit für ein solches Stufenkonzept zur Behandlung der Übelkeit ist in Abb. 4 dargestellt (angelehnt an [7]).
Vor dem Hintergrund der gängigen Polypharmazie von geriatrischen Patienten spielt auch ein günstiges pharmakologisches Profil der Analgetika eine entscheidende Rolle, die z. B. nur eine geringe Interaktion mit anderen Pharmaka eingehen sollten. Im Kontext der Gesamtsituation des Patienten muss der Blick des Therapeuten auch auf den Krankheitsstatus gerichtet sein. Das Erreichen eines „Ceiling-Effects“, wie zum Beispiel bei den Stufe-II-Opioiden Tramadol (600 – 800 mg) und Tilidin/Naloxon (600 mg), erfordert unter Umständen in der Endphase der Erkrankung die oftmals komplexe Umstellung eines Stufe-II-Opioids auf eines der WHO-Stufe III. Dabei können bei der individuellen Umrechnung zwischen einzelnen Opioidanalgetika sowohl Überdosierungen mit Müdigkeit und Adynamie wie auch Unterdosierungen mit den Nebenwirkungen zunehmender Schmerzen oder Entzugserscheinungen auftreten. Erfahrene Schmerztherapeuten wählen daher oftmals bei beginnenden Schmerzen bereits Opioide der Stufe III, um eine Umstellung in der Finalphase einer Tumorerkrankung zu vermeiden. Zuletzt spielen bei der Verschreibung von Opioiden allerdings auch Betrachtungen des Preises eine Rolle, da ggf. mit Regressen durch die Krankenkassen zu rechnen ist.
Gibt es Leitlinien, die bei der Behandlung von Tumorschmerzen helfen?
Die derzeit aktuellste, internationale evidenzbasierte Leitlinie zum Thema Tumorschmerz wurde im vergangenen Jahr 2012 von der European Association for Palliative Care (EAPC) herausgegeben [8]. Bei der Erarbeitung der neuen Empfehlungen wurden verschiedene bereits bestehende Arbeiten herangezogen. Die Ergebnisse sind größtenteils wenig überraschend und untermauern vielmehr die gängige Praxis. Insgesamt umfassen die Empfehlungen 16 Themen, darunter Themen wie Opioidrotation, Einschätzung von Stufe-II- und Stufe-III-Opioiden, Durchbruchschmerzen u. a.
Nicht alle ursprünglich benannten Themen wurden in der fertigen Leitlinie berücksichtigt. Hintergründe hierfür waren eine mangelnde Evidenzbasis (Opioide bei Leberversagen, Verwendung von Opioid-Kombinationen), eine Überlappung mit anderen Arbeiten (Cochrane Review zu opioidinduzierter Obstipation) und fehlende Ressourcen (Rolle von Ketamin).
Leider kommen auch dringend erwartete pharmakoökonomische Betrachtungen aufgrund zu geringer EBM-Untersuchungen in diesem Bereich in diesen Empfehlungen nicht vor, obwohl diese für die Argumentation bei der Verwendung "neuerer und teurerer" Medikamente gegenüber den Kostenträgern äußerst hilfreich wären.
Aus Deutschland kommt die frisch aufgelegte PraxisLeitlinie der Deutschen Gesellschaft für Schmerztherapie (DGS) e.V. zum Tumorschmerz und zum Durchbruchschmerz, in der "auf der Grundlage umfassender Recherchen und Analysen der verfügbaren wissenschaftlichen Daten sowie umfangreicher Erfahrungen praktisch schmerz- und palliativmedizinisch tätiger Ärzte ein fundierter Überblick über den gegenwärtigen Stand der medizinisch-wissenschaftlichen Forschung auf allen Gebieten der Schmerzmedizin gegeben wird". Diese kann von Ärzten auf der Internetseite der DGS unter http://dgs-praxisleitlinien.de/heruntergeladenwerden.
Die Mehrzahl von Tumorschmerzpatienten wird in Deutschland von Allgemeinmedizinern und hausärztlich tätigen Internisten versorgt. Darüber hinaus gibt es Algesiologen aller Fachrichtungen, die durch den Erwerb der „Speziellen Schmerztherapie“ oder der „Palliativmedizin“ über eine zusätzliche Fachexpertise verfügen. Für einige Tumorschmerzpatienten ist eine vorübergehende intensivierte Therapie stationär nötig, die in Kliniken mit einer stationären Schmerztherapie oder Palliativstation geleistet werden kann. Einen Überblick über spezialisierte Ansprechpartner liefert die Internetseite des „Palliativ-Portals“ ( http://www.palliativ-portal.de ).
Fallbeispiele aus der Praxis
Fall 1: Eine 83-jährige Patientin leidet seit fünf Jahren an einem Plasmozytom mit multiplen Knochenschmerzen durch Wirbelkörpereinbrüche. An Vorerkrankungen sind eine Hypertonie, Herzinsuffizienz und eine kompensierte NI III bekannt, sie nimmt insgesamt 7 Präparate mit ca. 15 Tabletten pro Tag ein. Vom Hausarzt war vor drei Jahren ein Fentanyl-Pflaster verordnet worden, das bei guter Wirksamkeit im Laufe der Jahre bis 100 µg/h gesteigert wurde. Jetzt gab sie drückende, stechende Ruheschmerzen (VAS 6-7) an, insbesondere bei Belastung entstanden unerträgliche Schmerzen (VAS 8-9). Die Patientin beklagte zunehmende Immobilität. Bei typischen nozizeptiven muskuloskelettalen Schmerzen wurde beschlossen, eine Opioidrotation auf ein retardiertes Hydromorphon (keine Wechselwirkung mit anderen Pharmaka, keine Metaboliten-Kumulation bei Niereninsuffizienz) mit OROS®-Galenik (Orales Osmotisches System) durchzuführen. Die Patientin erhielt Hydromorphon-OROS® 24 mg morgens, ab Tag 2 dann 36 mg nach Weglassen des Fentanyl-Pflasters und gab innerhalb von zwei bis drei Tagen eine signifikante Besserung der Ruheschmerzen auf VAS 3-4 (Bewegungsschmerz 5-6) an. Am Tag 5 klagte sie über stärkste Schmerzen in der Frühe nach dem Aufwachen (VAS 8-9). Als Ursache wurde eine nicht über 24 Stunden reichende Galenik angenommen, die Patientin erhielt Hydromorphon-OROS® jetzt abends. Nach 20 Stunden nahmen die Schmerzen zu, sie konnte aber jetzt ab 15:00 Uhr zusätzlich unretardiertes Hydromorphon einnehmen, da sie wach war und nicht schlief.
Kommentar: Pharmaka zeigen interindividuelle Unterschiede, die von den Wirkzeiten der Fachinformation abweichen können. Eine simple Umstellung der Einnahmezeiten führte hier zu einer signifikanten Verbesserung der Symptomatik. Lange Einnahmezeiten von Opioiden und höhere Dosierungen können zu einer Wirkabschwächung führen. In solchen Fällen kann ein Wechsel auf ein anderes Opioid sinnvoll sein (Tabelle 3).
Fall 2: Ein 58-jähriger Patient wird aus dem Krankenhaus nach einer Leberteilresektion von vier Kolonkarzinommetastasen in der rechten Leber entlassen. Bereits bei der Entlassung gibt er stechende, ziehende und brennende Dauerschmerzen der Stärke VAS 7-8, einseitig unterhalb des linken Schulterblattes, an. Bei der Untersuchung in der Klinik zeigen sich unauffällige muskuläre Befunde und ein intaktes Integument. Unter der Verdachtsdiagnose muskuloskelettaler Ursachen wird Diclofenac 2 x 75 mg p.o. verordnet, das nach fünf Tagen keinerlei Verbesserung erbringt. Ergänzend wird Metamizol 4 x 40 gtt und 3 x 50 mg Tramadol vom Hausarzt rezeptiert, welches eine leichte Verbesserung der Schmerzsymptomatik auf VAS 6 ergibt. Im weiteren Verlaufe persistieren die Schmerzen in Stärke, Lokalisation und Charakter. Eine Erhöhung der Tramadoldosis auf 3 x 150 mg führt zu Schwindel und Übelkeit, zeigt aber keine Veränderung der Schmerzen. Nach 14 Tagen wird ein Schmerztherapeut hinzugezogen, der als Ursache eine Post-Zoster-Neuralgie (Herpes zoster sine herpete) annimmt und Diclofenac und Tramadol absetzt. Unter der einschleichenden Dosis von Amitriptylin 25 mg noctu und Pregabalin 2 x 75, dann 2 x 150 mg nehmen die Schmerzen auf VAS 3-4 ab. Da der Patient noch unter einer starken Allodynie leidet und eine weitere Steigerung beider Substanzen nicht ohne Nebenwirkung verträgt, wird zwei Wochen später ein kutanes Capsaicin-Pflaster 8 % für 45 Minuten aufgetragen, das nach 36 Stunden zur vollständigen Schmerzfreiheit für vier Monate führt. Im weiteren Verlauf können das Antikonvulsivum und das trizyklische Antidepressivum abgesetzt werden.
Kommentar: Eine genaue Schmerzanamnese und die Analyse der möglichen Pathophysiologie (Immunsuppression bei Tumor!) führen oftmals schon zur Diagnose der tumorassoziierten Zoster-Neuralgie. Eine entsprechende Verordnung von Co-Analgetika anstelle „herkömmlicher Analgetika“ steht hier an erster Stelle und führt erst zum gewünschten Erfolg. Die unnötige Einnahme von Basisanalgetika kann vermieden werden (Tabelle 4).
Fall 3: Eine 42-jährige Patientin kommt mit einem in Lunge, Knochen und Hirn metastasierten Mammakarzinom in die Hausarztpraxis. Sie erhält bereits Morphin ret. 3 x 40 mg, zusätzlich alle drei Wochen eine ambulante Bisphosphonat-Therapie i.v. Nun berichtet sie über seit zehn Tagen bestehende, stärkste, drückende und intermittierend stechende, einschießende Dauerkopfschmerzen (VAS 9). Ihr Gynäkologe habe deshalb die Morphindosis um 50 % erhöht (3 x 60 mg) und zusätzlich 4 x 1 g Paracetamol verordnet, was allerdings zu keiner signifikanten Reduktion der Kopfschmerzen geführt habe. Sie halte das nicht aus und könne so nicht weiterleben. In der Untersuchung zeigt sich ein unauffälliger neurologischer Befund, insbesondere ohne Auffälligkeit der Hirnnerven und Pupillen. Unter der Annahme eines erhöhten Hirndruckes verordnet der Hausarzt Dexamethason 8-8-8 mg für zwei Tage und reduziert dieses in den folgenden Tagen auf 4-0-4 mg. Die Medikation wird um 4 x 40 gtt Metamizol ergänzt, gleichzeitig Paracetamol abgesetzt. Darunter verbessert sich zunächst der Dauerkopfschmerz sehr deutlich (VAS 3-4), die einschießenden Schmerzen jedoch bleiben und werden als subjektiv weiterhin bedrohlich erlebt.
Nach Reduktion der Morphindosis auf die Ausgangswerte wird Pregabalin 2 x 75 mg ergänzt, woraufhin die Attacken sistieren. Nach fünf Tagen stellen sich allerdings Doppelbilder ein, die differenzialdiagnostisch entweder auf eine Zunahme des Hirnbefundes oder Nebenwirkungen von Pregabalin zurückgeführt werden. Es erfolgt der Austausch von Pregabalin auf 3 x 400 mg Gabapentin, worauf weiterhin keine Attacken auftreten, die Doppelbilder der Patientin dafür verschwinden. Gleichzeitig veranlasst der Hausarzt die Vorstellung beim Strahlentherapeuten, der die Indikation für eine Bestrahlung der Hirnmetastasen stellt.
Kommentar: Initial gut eingestellte Patientin, die sich mit neuer Schmerzproblematik vorstellt. Federführend für die Verordnung ist hier die Neuro-Pathophysiologie, die mit dem angesetzten Kortikoid zu einer Ödemreduktion und Verbesserung der Symptomatik führt. Anzunehmen ist eine zusätzliche neuropathische Komponente, die „ex juvantibus“ mit einem Antikonvulsivum gut zu behandeln ist. Die schnelle Aufsättigung und Notwendigkeit einer nur zweimaligen Gabe von Pregabalin pro Tag wird manchmal durch das Nebenwirkungsprofil beeinträchtigt. Gabapentin ist oftmals besser verträglich und kann problemlos gegen Pregabalin ausgetauscht werden (et vice versa).
Fall 4: Ein 62-jähriger Patient mit in das gesamte Skelett metastasiertem Prostatakarzinom klagt über 4- bis 5-mal pro Tag plötzlich einsetzende Schmerzen im Bereich des Rückens, die ca. 10 – 30 min anhalten. Die Ruheschmerzen sind unter der Gabe von 3 x 40 mg Morphin ret. gut eingestellt (VAS 2-3). Die von der Klinik verschriebenen unretardierten Morphin-Tabletten à 20 mg wirken gut auf den Bewegungsschmerz, nicht aber auf den „Durchbruchschmerz“, weshalb er täglich zunehmend panisch reagieren würde. Der Hausarzt verordnet Fentanyl-Buccaltabletten und titriert mit dem Patienten auf 400 µg Einzeldosis. Hierunter können die Durchbruchschmerzen innerhalb von 5 – 8 min kupiert werden.
Kommentar: Echte "Durchbruchschmerzen" lassen sich mit herkömmlicher Galenik oral kaum suffizient therapieren. Um die teuren Kosten pro Einzelapplikation im Rahmen zu halten, hilft es, „incident pain“ mit „günstigen“, unretardierten Opioiden zu behandeln. Echter „Durchbruchschmerz“ verlangt dagegen häufig den Einsatz teurer buccaler, sublingualer oder nasaler Applikationsformen von Fentanyl.
Diesen Artikel finden Sie auch auf unserem CME-Portal – einfach hier klicken!
Co-Autorin: Susanne Hopf
Interessenkonflikte: M. Pawlik erhielt Studiengelder der Fa Janssen und Mundipharma. Er erhielt Vortragshonorare von Janssen, Mundipharma und BBraun sowie Kongresskostenerstattungen von den Firmen Janssen, Mundipharma, Pfizer, Grünenthal.
Erschienen in: Der Allgemeinarzt, 2013; 35 (18) Seite 22-27