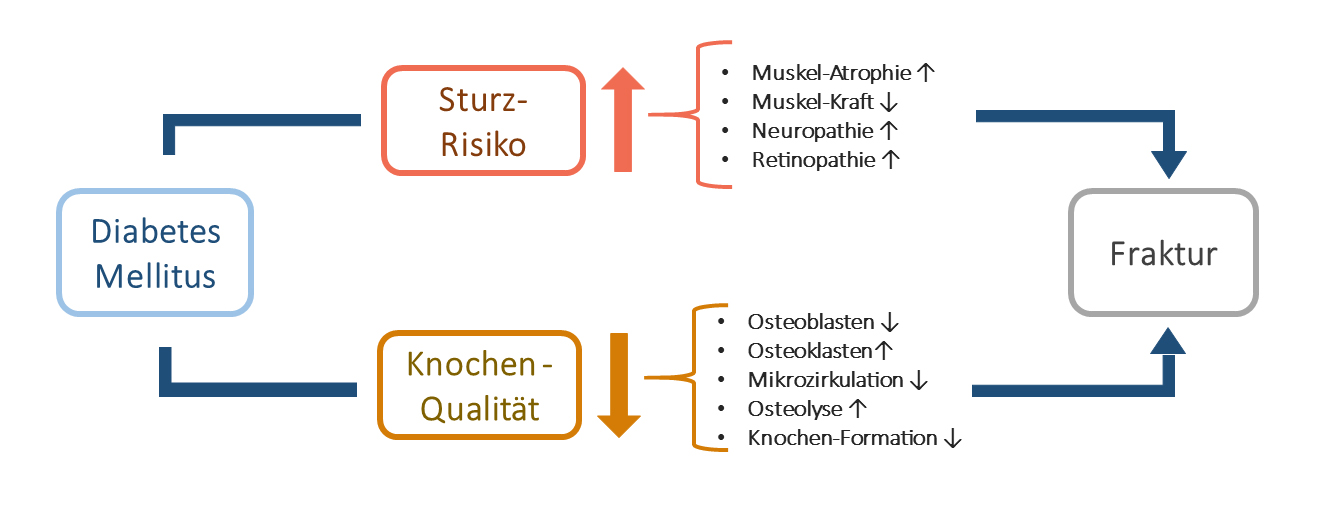
Diabetespatienten haben ein erhöhtes Frakturrisiko. Bei Typ-1-Diabetes ist dieses Risiko für Knochenbrüche noch deutlich stärker ausgeprägt als bei Typ 2. Diabetesbedingte Folgeerkrankungen, die u. a. Nieren und Nerven betreffen, sind weitere Faktoren, die den Knochenstoffwechsel negativ beeinflussen. Das erhöhte Sturzrisiko von Diabetikern hängt vor allem mit auftretenden Hypoglykämien zusammen. Eine stabile Glukoseeinstellung ohne Entgleisungen und eine frühzeitige osteologische Basisdiagnostik beziehungsweise Therapie spielen in der Frakturprävention deshalb eine entscheidende Rolle.
Das erhöhte Knochenbruchrisiko bei Osteoporose ist durch eine verminderte Kochenmasse und eine Störung der Mikrostruktur bedingt, die sich auf die Knochenqualität auswirkt. Neuere Auswertungen von Versicherungsdaten zeigen, dass 6,3 Mio. Menschen in Deutschland von einer Osteoporose betroffen sind – mit deutlich steigender Inzidenz in zunehmendem Alter. 14 % der über 50-Jährigen leiden unter Knochenschwund [1].
Ähnliche Zahlen findet man beim Diabetes mellitus. Laut dem Gesundheitsbericht Diabetes 2018 gibt es in Deutschland mehr als 6 Mio. Diabetiker, und es werden jährlich mehr. Von der chronischen Erkrankung sind vor allem ältere Patienten betroffen, genauer 5,7 % der über 50-Jährigen. Dieser Wert steigt mit jeder Lebensdekade (13,8 % der über 60-Jährigen, 21,9 % der über 70-Jährigen) [2]. Beide Erkrankungen zeigen mit Blick auf die älter werdende Bevölkerung kontinuierlich steigende Inzidenzzahlen.
Neben der häufigen Koinzidenz von Osteoporose und Diabetes mellitus gibt es eine enge pathophysiologische Verknüpfung zwischen beiden chronischen Erkrankungen. Wie der Knochen den Glukosestoffwechsel beeinflusst, wird derzeit im Bereich der Grundlagenforschung intensiv untersucht. Zur Bedeutung der Osteoporose gibt es seit Längerem sehr robuste klinische Daten, die man bei der Behandlung beachten sollte.
Diabetes als Risikofaktor
Heute weiß man: Sowohl die krankheitsbedingten pathophysiologischen Veränderungen als auch die spezifische Diabetesmedikation haben einen Einfluss auf den Knochenstoffwechsel. Die diabetesbedingten Beeinträchtigungen zahlreicher weiterer Organsysteme, allen voran der Niere (diabetische Nephropathie), schädigen den Knochen zusätzlich und führen zu Einschränkungen. Beim Typ-1- (DMT1), als auch beim Typ-2-Diabetes (DMT2) gibt es ein erhöhtes Risiko für osteoporotische Frakturen. Diesen gehen unterschiedliche Pathomechanismen voraus [3, 4].
Typ-1-Diabetes und Frakturrisiko
Beim DMT1 ist das Frakturrisiko stark erhöht (vgl. Kasten). Dies betrifft geschlechtsunabhängig alle Altersstufen – aufgrund des häufig frühen Auftretens dieser chronischen Erkrankung vor allem auch deutlich jüngere Patienten, bei denen man sonst noch nicht an eine Osteoporose und ein erhöhtes Frakturrisiko denken würde. In den aktuellen Leitlinien des Dachverbands Osteologie (DVO) zur Therapie der Osteoporose ist der DMT1 deshalb als sehr starker Risikofaktor berücksichtigt [4, 5]. Nach aktuellen Studien ist die Inzidenz für Hüftfrakturen bei Typ-1-Patienten um das Drei- bis Sechsfache im Vergleich zur restlichen Bevölkerung erhöht. Auch gibt es ein zwei- bis dreifach höheres Risiko für Wirbelkörperfrakturen [4]. Das erhöhte Hüftfrakturrisiko steigt jenseits des 40. Lebensjahrs noch einmal stark an. Nach aktuellen Literaturangaben gibt es hier jedoch erhebliche Unterschiede, u.a. in Abhängigkeit von Alter, Therapie und Krankheitsdauer. Dies spricht für eine individuelle Modifizierbarkeit des Risikos [6 – 8]. Es scheint zudem bestimmte Zusammenhänge zwischen diabetesspezifischen Komplikationen wie Retinopathie, Neuropathie, vaskulären Schädigungen und diabetischer Nephropathie zu geben [9, 10].
Typ-2-Diabetes und Frakturrisiko
Bei Typ-2-Diabetikern liegt ein rund anderthalbfach höheres Hüftfrakturrisiko vor, das sich bei insulinpflichtigen Patienten mit schlechter glykämischer Kontrolle und einem steigenden HbA1c weiter erhöht [11 – 13].
- Typ-1- und Typ-2- Diabetes sind mit einem erhöhten Risiko für osteoporotische Frakturen assoziiert
- Der Typ 1 ist durch eine gestörte Knochenformation und eine erniedrigte Knochendichte charakterisiert
- Der Typ 2 zeigt sich durch eine verminderte Knochenqualität trotz messtechnisch vergleichsweise guter Knochendichtewerte
Ätiologie
Erhöhtes Sturzrisiko
Diabetespatienten haben auch ein höheres Sturzrisiko. Einerseits ist es durch die instabile glykämische Kontrolle mit rezidivierenden hypoglykämischen Episoden bedingt [14], andererseits durch die beeinträchtigte körperliche Leistungsfähigkeit aufgrund reduzierter Balance, Koordination und Muskelstärke – meist als Folge einer langen Diabetesdauer. Das Risiko für Stürze steigt im Rahmen der diabetischen Neuropathie und mit Einschränkungen der Propriozeption. Dieses Risiko scheint besonders akzentuiert im Zusammenhang mit einer erforderlichen Insulintherapie anzusteigen. Ob dies konkret mit der meist fortgeschrittenen Krankheitsdauer und -schwere zusammenhängt oder ein eigenständiger Pathomechanismus zugrundeliegt, ist nicht abschließend geklärt. Die Akkumulation von Komorbiditäten beim Diabetes hat aber einen erheblich negativen Einfluss auf das Sturzrisiko (12, 15, 16).
Knochenstruktur
Vielfach gut belegt ist, dass Typ-1-Diabetiker eine deutlich reduzierte Knochendichte aufweisen (22 – 37 %) [17]. Ein wesentlicher Grund scheint die krankheitsbedingte Verminderung der osteoanabolen Effekte von Insulin, IGF-1
und möglichen weiteren Botenstoffen sowie eine Markraumverfettung zu sein. Schon bei Kindern und jungen Erwachsenen mit Typ 1 finden sich entsprechend niedrige Knochendichtewerte [18].
Beim Typ 2 wiederum scheint es eine andere Konstellation zu geben. Die Knochendichte zeigt hier häufig sogar vergleichsweise gute Werte, die über das tatsächlich erhöhte Frakturrisiko hinwegtäuschen können. Dies kann man ursächlich teils mit einem begleitenden Übergewicht und dem somit sekundären Effekt auf das Skelett (erhöhte Gewichtsbelastung) erklären [19, 20]. Bei schlechter Einstellung kommt es aber u. a. auch durch AGEs (advanced glycation end products) zu einer nicht enzymatischen Quervernetzung von Kollagenfasern, die dann mineralisieren. Auch dies bedingt eine messtechnisch vergleichsweise hohe Knochendichte, die letztlich aber keinem mechanisch gut belastbaren Knochen entspricht. Beim Typ 2 ist demnach – und trotz der manchmal guten Knochendichte – die Knochenqualität deutlich beeinträchtigt (Abb. 1) [21, 22]. Auch die gesteigerte Produktion von Sauerstoffradikalen und entzündliche Vorgänge bei unzureichender glykämischer Kontrolle haben jenseits der Knochendichte einen negativen Einfluss auf die Knochenqualität bei Diabetes [8].
Diabetestherapie und Auswirkungen auf den Knochenstoffwechsel
Beobachtungsstudien haben gezeigt, dass gerade Patienten mit schlechten Blutzuckerwerten ein deutlich erhöhtes Frakturrisiko haben [13, 23]. Eine gute Einstellung und ein gesunder Lebensstil (Ernährung, körperliche Aktivität) sind deshalb erste wertvolle Schritte zur Frakturvermeidung.
Die Notwendigkeit einer Insulintherapie bei Typ 1 und Typ 2 wird durch die Erkrankung selbst vorgegeben und erlaubt wenig Entscheidungsspielraum [16]. Beim Typ 2 mit Insulin ist es besonders wichtig, Hypoglykämien mit entsprechender Sturzgefahr zu vermeiden, vor allem bei älteren Patienten. Das bedeutet: Mit zunehmendem Alter sollte eine gute, aber nicht zu restriktive Einstellung erfolgen.
Eine Typ-2-Therapie mit Metformin scheint nach heutiger Datenlage neutrale beziehungsweise sogar eher positive Auswirkungen auf den Knochenstoffwechsel zu haben [24]. Aktuelle Arbeiten aus der Grundlagenforschung legen einen positiven Effekt auf die osteoblastären Zellen nahe. Mehrere klinische Untersuchungen bestätigen neutrale oder teilweise sogar günstige Auswirkungen von Metformin – sowohl auf die Knochendichte als auch auf das Frakturrisiko. Sulfonylharnstoffe scheinen grundsätzlich einen neutralen Effekt zu haben. Hinsichtlich des Knochenumbaus gibt es sogar Hinweise auf einen Anstieg der Formationsmarker und einen Rückgang des Knochenabbaus. Belastbare Erkenntnisse zur Knochendichte fehlen hier jedoch und die Daten zum Frakturrisiko sind uneinheitlich, unterm Strich quasi neutral. Besonders unter dieser Therapie sind allerdings vermehrt Hypoglykämien beschrieben, weshalb man Sulfonylharnstoffe zur Sturzprophylaxe bei älteren Patienten eher vorsichtig einsetzen sollte [25].
Thiazolidinedione (Glitazone) oder sogenannte Insulin-Sensitizer sind ein gutes Beispiel für die Wechselwirkung von Glukose- und Knochenstoffwechsel – nicht zuletzt aufgrund des deutlich erhöhten Frakturrisikos unter diesen Präparaten. In mehreren Studien, speziell bei Frauen, wurden die Substanzen zunächst als wesentlicher Risikofaktor in die Osteoporose-Leitlinie aufgenommen. Inzwischen sind sie weitgehend vom Markt verschwunden [26].
Die Datenlage bei den Inkretin-Mimetika (GLP-1-Analoga und DPP-4-Inhibitoren) ist überschaubar, teils heterogen. Daten aus der Grundlagenforschung lassen vor allem für die GLP-1-Analoga einen positiven Effekt auf den Knochenumbau erhoffen. Neue Metaanalysen zeigen heterogene Ergebnisse zum Frakturrisiko, auch mit Unterschieden zwischen den Präparaten aus dieser Gruppe – und mit vermindertem Risiko für Liraglutid und höherem Risiko für Exenatid. Da die berücksichtigten Studien aber nicht konkret auf Fragestellungen zu Osteologie, Knochendichte und Frakturen eingehen, muss man mit Schlussfolgerungen sehr vorsichtig sein [27]. Ähnliches gilt auch für die GLP-1-Inhibitoren. Bei diesen Medikamenten lässt sich bislang zumindest keine substanzielle Erhöhung des Frakturrisikos ableiten.SGLT2-Inhibitoren zeigen in Studien ebenfalls uneinheitliche Ergebnisse für Knochenstoffwechsel und -dichte. Je nach Wirkstoff finden sich hier eher neutrale Daten, vor allem für Dapagliflozin und speziell für Empagliflozin. Bei der Therapie mit anderen Präparaten wie Canagliflozin liegt aber der Verdacht auf einen relevanten Verlust an Knochenmasse nahe – mit Hinweisen auf ein gesteigertes Hüftfrakturrisiko. Vor allem für die neueren Substanzen sind weitere Untersuchungen notwendig [28, 29].
Inwieweit der Vitamin-D-Status einen direkten Einfluss auf die Diabetes-Prävalenz und die glykämische Kontrolle hat, wird derzeit kontrovers diskutiert. Bei Diabetikern liegt häufig ein Vitamin-D-Mangel vor, und damit ein weiteres Risiko für den Knochenstoffwechsel. Eine Supplementation mit Augenmaß (1.000 IE/d), auch individuell angepasst an den Vitamin-D-Spiegel, scheint bei Risikopersonen sinnvoll [30].
Erfreulich ist, dass alle verfügbaren Therapien, die das Frakturrisiko bei Osteoporose senken, auch bei Diabetes als uneingeschränkt wirksam erscheinen und keine negativen Auswirkungen auf die Glukoseeinstellung haben [31].
Diskussion
Diabetes geht, wie erwähnt, mit einem erhöhten Risiko für Frakturen einher, wobei der Typ 1 hier ein größerer Risikofaktor ist als der Typ 2. Neben den Auswirkungen auf den Knochenstoffwechsel durch die diabetische Stoffwechselsituation sind auch Komorbiditäten (diabetische Nephropathie u. a.), vor allem aber das erhöhte Sturzrisiko entscheidend. Bedeutsam im Umgang mit diesem Risiko ist ein gut eingestellter Blutzucker ohne Entgleisungen, also die Vermeidung von Hyper- und Hypoglykämien, die notwendige Beratung des Patienten zur Modifikation sogenannter Lifestyle-Faktoren (z. B. Sport, Diät, Rauchen), aber auch die Wahl des richtigen Therapeutikums.
Der Hausarzt als Lotse zwischen den Fachdisziplinen, hier zwischen Diabetologie und Osteologie, spielt eine wichtige Rolle. Ein hohes Maß an Aufmerksamkeit durch den Arzt ist wesentlich, um bei einem Diabetespatienten möglichst schon vor dem ersten Knochenbruch (oder spätestens dann) an die assoziierte Problematik des Knochenstoffwechsels zu denken und eine entsprechende Abklärung zu veranlassen.
Gerade Typ-1-Patienten sollten frühzeitig einer osteologischen Evaluation zugeführt werden, da sich beim Typ 1 auch schon im jungen Erwachsenenalter osteologische Komplikationen, wie rezidivierende Insuffizienzfrakturen, ergeben können.
Auch bei Typ-2-Diabetikern sollte eine solche Basisevaluation vorgenommen werden, vor allem bei Patienten mit zusätzlichen Risikofaktoren (postmenopausale Situation, Nikotin, Alkohol, Glukokortikoide, familiäres Risiko etc.), einer langen Krankheitsdauer und Frakturen in der Anamnese. Die Therapie der Osteoporose ist auch bei Diabetes wirksam und hat keinen unmittelbaren Einfluss auf den Glukosestoffwechsel.
In der täglichen Routine sind die engmaschige Kontrolle und die stabile Einstellung des Blutzuckers besonders bei Menschen mit Diabetes wichtig. Entsprechend bestehenden Indikationen und Kontraindikationen sollte das geeignete Medikament für den einzelnen Patienten gewählt werden. Eine frühzeitige Interaktion zwischen Osteologe und Diabetologe ist hier entscheidend, vor allem bei Patienten mit komplexen Konstellationen und Begleiterkrankungen.
Interessenkonflikte: Der Autor hat keine deklariert
- Verdacht auf Osteoporose: Wann Diagnostik ausweiten, wann behandeln?
- Ernährung, Tabletten, Insulin: Diabetestherapie im Alter
- Diabetische Neuropathie: Früh erkennen, rechtzeitig gegensteuern!
- Knochenschwund: Achtung bei Osteoporosetherapie
- Osteoporose unter Kortisontherapie: Welche Alternativen gibt es?
Erschienen in: Der Allgemeinarzt, 2018; 40 (17) Seite 34-38