Blasen auf Haut oder Schleimhäuten können unterschiedliche Ursachen haben, eine davon sind die sogenannten bullösen Autoimmundermatosen (BAID). Wenn der Körper Antikörper gegen die Strukturen der Haut bildet, löst sie sich ab und bildet Blasen. Unter die Gruppe dieser blasenbildenden Autoimmunerkrankungen fallen gleich mehrere Hautleiden, die in jedem Lebensalter auftreten können. Am häufigsten ist das bullöse Pemphigoid (BP), von dem vor allem ältere Patienten betroffen sind.
Pemphigus vulgaris
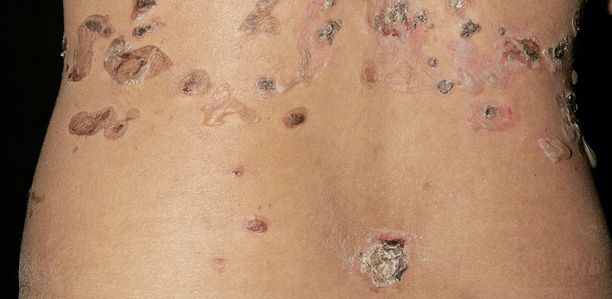
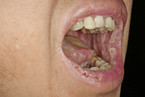
Der Pemphigus vulgaris kommt in Deutschland mit einer Inzidenz zwischen 0,5 und einem Fall pro 1 Million vor [1]. Die Krankheit manifestiert sich am häufigsten in der vierten bis sechsten Lebensdekade. Der Adhäsionsverlust, der von Autoantikörpern ausgelöst wird, verläuft in-traepidermal (suprabasal). Die Blasen sind deshalb meist schlaff. Sie platzen schnell und führen zu schmerzhaften Erosionen (Abb. 1). Die Blasenbildung erfolgt nicht nur an der Haut, auch Schleimhäute sind betroffen [5]. In der Regel tritt der Pemphigus vulgaris zuerst an der oralen Schleimhaut auf (Abb. 2).
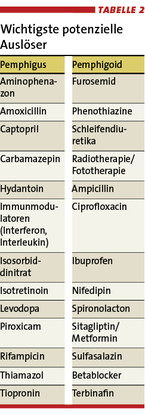
Weitere Prädilektionsstellen sind die Kopfhaut und der Stamm. Die intakte Epidermis lässt sich mit dem Finger abschieben (Nikolski-I-Zeichen). Manche Medikamente können in seltenen Fällen einen Pemphigus auslösen, sogar nach Jahren guter Verträglichkeit (Tabelle 2) [11]. Eine paraneoplastische Form ist zudem bekannt.
Bullöses Pemphigoid (BP)
Das BP ist der häufigste Vertreter der BAID (Tabelle 1). Die Krankheitshäufigkeit liegt zwischen 2,5 und 42,8 Fällen pro 1 Million [1]. Der Inzidenzgipfel wird zwischen dem 70. und 80. Lebensjahr erreicht [1].
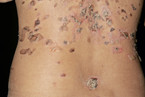
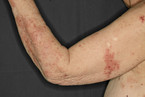
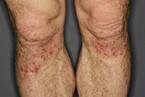
Die Blasenbildung läuft subepidermal ab. Die Manifestationen an der Haut können sehr polymorph sein. Bei der körperlichen Untersuchung sind meist symmetrisch verteilte, juckende, pralle Blasen auf geröteter oder gesund scheinender Haut zu sehen (Abb. 3) [7, 14]. Prädilektionsstellen sind die Beugeseiten der Extremitäten. Sekundär entstehen verkrustete Erosionen. Manchmal zeigen sich prurigo- oder ekzemartige Hautveränderungen ohne Blasenbildung (Abb. 4) [7, 14]. Die Schleimhäute sind in 10 – 30 % der Fälle mitbetroffen. Der Verlauf des BP ist meist selbstlimitierend. Selten wird diese blasenbildende Erkrankung durch Tumoren oder Medikamente ausgelöst (Tabelle 2).
Assoziierte Erkrankungen
Zwischen dem BP und einigen neurologischen und psychiatrischen Erkrankungen wie Morbus Parkinson, Multiple Sklerose, Apoplex und Demenz, konnte zwar ein Zusammenhang festgestellt werden [2, 3, 16], eine therapeutische Konsequenz entsteht dadurch aber nicht.
Weitere BAID
Das Schleimhautpemphigoid (MMP) befällt vor allem die Schleimhäute. Häufig tritt eine Vernarbung auf, die irreversible und quälende Komplikationen verursachen kann (z. B. Larynxstenose) [7]. Der Verlauf des MMP ist hochchronisch und oft ungünstig [6].
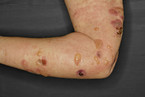
Die Dermatitis herpetiformis Duhring (DHD) ist die kutane Manifestation einer Zöliakie. Diese chronische Erkrankung des Dünndarms ist meist mild oder asymptomatisch. Sie tritt bei ein bis fünf Fällen pro 1 Million auf [7]. Der Inzidenzgipfel liegt in Europa zwischen dem 25. und 55. Lebensjahr. Die prallen, herpetiform angeordneten Bläschen erscheinen über Hautarealen, die Druck oder Spannung ausgesetzt sind, wie Ellbogen, Knie oder Gesäß (sakrogluteal). Häufig fehlen die Bläschen, stattdessen finden sich verkrustete Erosionen, Papeln oder durch heftigen Juckreiz ausgelöste Exkoriationen (Abb. 5) [12]. Die DHD geht oft mit anderen Autoimmunkrankheiten einher (z. B. Autoimmunthyreoiditiden, Diabetes mellitus, perniziöse Anämie) [7].
Diagnostik
Schon bei Verdacht auf eine BAID ist ein Routinelabor hilfreich. Blutbildveränderungen wie Eosinophilie können auf ein BP hinweisen. Zeichen für eine dabei auftretende Verdauungsschwäche (Malabsorption), z. B. eine makrozytäre oder Eisenmangelanämie sowie ein Vitamin-D-Mangel, sind typisch für eine DHD. Der Arzt sollte hier nach der Einnahme möglicherweise auslösender Arzneimittel fragen (Tabelle 2) [6, 11]. Die endgültige Diagnose stellt der Hautarzt. Neben Anamnese und körperlicher Untersuchung basiert sie auf der Beurteilung von Hautproben, also auf Dermatohistologie (direkter Immunfluoreszenz, kurz: IF) und Autoimmunserologie (indirekter IF, BP180 und BP230 ELISA) [13, 9, 14, 5].
Differenzialdiagnose
Für die Differenzialdiagnose müssen vor allem allergische, bläschenbildende Hautreaktionen (bullöse Arzneimittelexantheme wie Erythema multiforme, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse) ausgeschlossen werden. Erst kürzlich verordnete Medikamente (Zeitraum: ein bis acht Wochen) lassen eine akute Arzneimittelreaktion besonders vermuten.
Infektionen, die von Staphylokokken verursacht werden, können auch mit einer Blasenbildung einhergehen [15]. Akut auftretende, meist an den gegenüberliegenden Hautflächen sichtbare Blasen und – bei jüngeren Patienten – gelblich verkrustete Erosionen weisen auf eine bullöse Impetigo contagiosa hin. Für Virusinfektionen sind statt Blasen kleinere Bläschen typisch. Bei Herpes zoster sind zum Beispiel gruppierte Vesikel typisch, die sich auf die Dermatomen begrenzen.
Treten Schleimhauterosionen ohne weitere Hautbeteiligung auf, sollte man Aphthen, Kandidose, erosive Lichen oder schlecht sitzende Prothesen ausschließen. Erfrierungen oder Verbrennungen der Haut können auch zu Blasen führen. An selbst zugefügte Hautverletzungen (Artefakte), mechanische Blasen oder Reaktionen auf Insektenstiche sollte auch gedacht werden [12]. Einzelne Blasen an den Schienbeinen können in Zusammenhang mit Diabetes mellitus (Bullosis diabeticorum) erscheinen oder weisen auf eine unzureichende diuretische Therapie (Spannungsblasen) hin. Bei älteren Patienten, bei denen zum Beispiel ein Ekzem, eine Prurigo oder die Krätze (Skabies) vermutet wird, muss der Arzt ein nichtbullöses BP ausschließen [7]. Er muss auch beachten, dass kindliche Haut bei unterschiedlichen Dermatosen besonders mit Blasenbildung reagiert [12].
Therapie
Die Therapie der Wahl ist – mit Ausnahme der DHD – eine systemische Immunsuppression. Bei mildem BP ist ausnahmsweise eine topische Monotherapie mit Clobetasolpropionat empfohlen [13]. So lassen sich systemische Nebenwirkungen vermeiden. Ein Nachteil ist jedoch der pflegerische Mehraufwand. Eine
Langzeitanwendung kann zudem zu einer schweren Hautatrophie führen [6].
- Juckende, ekzematiforme oder bullös-erosive Dermatose ab dem 70. Lebensjahr => V. a. BP.
- Ähnliche Dermatose bei jüngeren Patienten und über den großen Gelenken => V. a. DHD.
- Schmerzhafte, orale Erosionen mit oder ohne Blasen an der Haut zwischen dem 40. und 60. Lebensjahr => V. a. Pemphigus vulgaris oder MMP.
Die Einleitung und das Ausschleichen einer systemischen Immunsuppression sowie einen Therapiewechsel sollte ein erfahrener Dermatologe vornehmen. Bei BP oder Pemphigus besteht die systemische Therapie aus Prednisolon oder Methylprednisolon [4, 8, 9]. Bei hohen Dosen sollte das Glukokortikoid mit einem weiteren steroidsparenden Immunsuppressivum kombiniert werden, um die Nebenwirkungen zu begrenzen [4, 8, 9]. Eine Dosisverringerung der Glukokortikoide sollte ausschleichend (durch "logarithmische Reduktion") erfolgen [4, 8, 9]. Für die DHD ist Dapson die Therapie der Wahl, ergänzt durch eine glutenfreie Diät [8].
Steroidsparende Immunsuppressiva
- Methotrexat: Anfangs ist eine Laborkon-trolle pro Monat notwendig, später reichen zwei- bis dreimonatliche Tests. Bei schwereren Begleiterkrankungen sollten diese gegebenenfalls auch häufiger gemacht werden. CAVE: Eine tägliche (statt wöchentliche) Einnahme von Methotrexat kann letale Folgen haben. Vorsicht bei Demenz!
- Azathioprin: Wegen der sehr häufigen Lebertoxizität im Alter werden zweiwöchentliche Kontrollen in den ersten zwei Monaten (danach alle zwei bis drei Monate) empfohlen.
- Mycophenolat: Die Dosis muss bei Asiaten bzw. Afrikanern deutlich reduziert beziehungsweise erhöht werden. Faustregel: ein Gramm bei Asiaten, zwei Gramm bei Kaukasiern, drei Gramm bei Afrikanern (täglich).
- Dapson: Obligate Konsequenzen der Therapie sind Hämolyse und Methämoglobinbildung, die – bedingt durch weitere Faktoren – zu ischämischen Komplikationen führen können. Laborkontrollen sollten in den ersten drei Monaten wöchentlich, später alle zwei bis drei Monate erfolgen.
Systemische Medikamente und Wechselwirkungen
Ernste Komplikationen können die Elimination der Immunsuppressiva hemmende Arzneimittel verursachen. Der häufigste Fehler mag die gleichzeitige Gabe von Methotrexat mit Protonenpumpenhemmern sein. Die Myelo-, Hepato- und Nephrotoxizität von Methotrexat potenziert sich dadurch. Dies lässt sich durch H2-Antihistaminika (z. B. Ranitidin 300 mg/d) statt Protonpumpeninhibitoren vermeiden. Eine weitere, potenziell lebensgefährliche Kombination ist Azathioprin mit Allopurinol oder Aminosalicylsäurederivaten wie Mesalazin beziehungsweise Sulfasalazin. Der Arzt sollte zudem die gleichzeitige Gabe von Azathioprin und ACE-Hemmern – wegen ihrer erhöhten Myelotoxizität – vermeiden. Gleiches gilt für die Kombinationen Mycophenolat und Aciclovir sowie Methotrexat und NSAIDs über einen längeren Zeitraum – hier drohen sonst starke Knochenmarksuppression, aplastische Anämie und gastrointestinale Toxizität. [6].
Geriatrische Aspekte
Bei älteren Patienten sind die Begleiterkrankungen wie eine eingeschränkte Leber- und Nierenfunktion das größte Problem. Bei Demenz gestaltet sich die Medikamenteneinnahme und Compliance schwierig. Eine eingeschränkte Selbstpflege begünstigt Superinfektionen. Ältere Menschen sind auch oft immobil und haben ein reduziertes Durstgefühl. Bei Erosionen ist der transepidermale Wasserverlust größer, was zu einer deutlichen Austrocknung führen kann [6]. Hier sind eine adäquate Schmerzlinderung, Wasser- und Elektrolytgabe sowie Infektionsprophylaxe wichtig. Bestimmte Auslöser, wie verdächtige Medikamente [13], UV-Strahlung und Neoplasien, sind möglichst zu beseitigen. Im Rahmen der Infektionsprophylaxe sollte der Arzt den Impfstatus prüfen und die fehlenden Impfungen nachholen [10]. Screeninguntersuchungen (Röntgen-Thorax, Oberbauchsonographie, Hämoccult, Serum PSA) in Richtung Neoplasien bzw. chronischer Infektionen wie Tuberkulose sind zu empfehlen. Während einer systemischen Behandlung müssen Laborparameter und Blutdruckwerte regelmäßig kontrolliert werden. Wegen der Osteoporosegefahr unter Steroidtherapie empfiehlt sich prophylaktisch eine Substitution von Vitamin D und Calcium [17].
- Bei Blasen- oder Erosionsbildung unklarer Genese ist ein zeitnahes dermatologisches Konsil erforderlich.
- Bei allen chronisch juckenden, entzündlichen Dermatosen im Alter ist ein BP auszuschließen.
- Bei den meisten, gut behandelten BAID ist die Prognose günstig.
Interessenkonflikte: Die Autorin hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2017; 39 (18) Seite 50-54