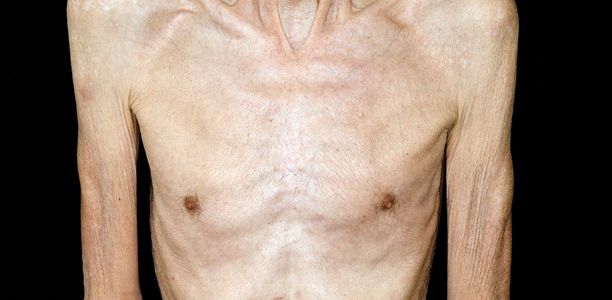
Kachexie (altgriechisch: schlechter Zustand) bedeutet eine krankhafte, sehr starke Abmagerung und ist eine häufige Endphasensituation bei zahlreichen chronischen Erkrankungen. Besonders häufig ist sie bei malignen Tumorerkrankungen im fortgeschrittenen Stadium zu beobachten. Im folgenden Beitrag sollen etablierte und künftige Therapieoptionen vorgestellt werden.
Über Jahre wurde weltweit in zahlreichen Arbeitsgruppen versucht, eine einheitliche Definition für Kachexie zu etablieren; der derzeit letzte und von allen Gruppen akzeptierte Kompromiss wurde kürzlich publiziert (vgl. Übersicht 1 [1]). Davon zu unterscheiden ist die Mangelernährung, d. h. Mangel an Mikro- und Makronährstoffen mit Gewichtsverlust, reduzierter Nahrungsaufnahme z. B. durch Appetitlosigkeit (Anorexie). Sowohl die Mangelernährung als auch die Kachexie beeinflussen die Lebensqualität des Patienten, führen zu mehr Komplikationen, wie z. B. Infektionen, Verschiebung von geplanten Therapien und zu längeren Krankenhausaufenthalten. Der Unterschied zwischen Kachexie und Mangelernährung ist die Inflammation, am besten messbar mit dem C-reaktiven Protein (Übersicht 1). Die Kachexie wird unterteilt in Präkachexie, Kachexie und chronische Kachexie (Übersicht 2).
Die Therapie der Kachexie beinhaltet ein multimodales Therapiekonzept, das sowohl vom Facharzt (z. B. Onkologen) als auch vom Allgemeinarzt gemeinsam genutzt werden sollte. Dabei ist die wichtigste Therapiemaßnahme die Behandlung der Grundkrankheit. Ohne Reduktion der Tumorlast ist die Kachexie kaum zu beeinflussen. Additiv oder wenn die Grundkrankheit nicht beeinflussbar ist werden zahlreiche Therapieansätze verfolgt.
Etablierte Medikamente
Symptomorientierte Medikamente sollten als Basistherapie eingesetzt werden: z. B. Antiemetika, psychoaktive Medikamente, Schmerzmittel oder auch Magen-Darm-Therapeutika (Prokinetika, motilitätsmodulierende Substanzen: Protonenpumpeninhibitoren, Parasympathomimetika).
Kortikosteroide: 20 mg Prednisolon oder 4 mg Dexamethason/Tag stimulieren den Appetit, wirken antiemetisch und verbessern rasch das Wohlbefinden. Leider verblassen diese Effekte nach vier Wochen. Hauptprobleme sind die zahlreichen Nebenwirkungen wie Myopathie, Osteoporose, Thrombosen, Ödeme, Immunsuppression, Insulinresistenz und die Entwicklung eines Steroiddiabetes. Kortikosteroide empfehlen sich daher nicht als Dauermedikation.
Progesterone: Megestrolacetat (160 – 1.600 mg/Tag) und Medroxyprogesteronacetat (30 – 1.200 mg/Tag) stimulieren den Appetit, führen zur Zunahme des Körpergewichtes, aber nicht der Lean Body Mass, und verbessern die Lebensqualität. Die Nebenwirkungen sind ausgeprägt: Thromboembolien (5 %), Impotenz beim Mann, vaginale Blutung/Hautveränderungen, Bluthochdruck, Hyperglykämien, Ödeme und NNR-Insuffizienz. Cave: Die gemessene Gewichtszunahme kann auch nur durch die Wassereinlagerung bedingt sein.
Cannabinoide: Marihuana-Extrakte und Delta-9-Tetrahydrocannabinol = THC/Dronabinol (Marinol®), 5 –20 mg/ Tag, stimulieren den Appetit und haben positive Effekte auf Stimmung, Übelkeit und Schmerzen (AIDS-Therapie). Nebenwirkungen/Besonderheiten sind Übelkeit und undeutliche Sprache. Zudem erfordern Cannabinoide ein BTM-Rezept. Tipp: langsame Steigerung der Dronabinol-Dosis bis max. 20 mg/Tag für maximal zwei bis drei Wochen, bei ausbleibendem Erfolg nicht fortsetzen.
Ghrelin und seine Analoga: Ein Peptid-Hormon der Magenmukosa (nur parenteral verfügbar) führt bei i.v.-Gabe zu erhöhtem Appetit und geringerem Gewichtsverlust im Vergleich zu Plazebo. Ein orales Ghrelin-Analogon, Anamorelin, wird derzeit noch in Studien getestet und führt zur Zunahme von Gewicht und Handgriff-Stärke [2]. Diese orale Applikationsform könnte eine wirksame Therapieoption werden.
Weitere wirksame Substanzen
Eine Reihe weiterer Substanzen mit zum Teil sehr positiven Ansätzen befinden sich derzeit noch in der Phase der Prüfung in pharmazeutischen Studien.
Folgende Substanzen wurden/werden bzgl. Therapie der Mangelernährung/Kachexie untersucht: Insulin/Insulin-Sensitivitäts-Modulatoren, Wachstumshormone, IGF-1, anabole androgene Steroide, SARMS, Proteasomen-Inhibitoren, ß-Rezeptoren-Modulatoren, ß-Hydroxy-ß-Methylbutyrate, Hydrazinesulfate, Adenosintriphosphat (ATP). Die interessantesten Substanzen sind:
Wachstumshormon (Growth Hormone (GH)): Vermindert Fett und erhöht Muskelmasse und Knochendichte, verbessert Immun- und Sexualfunktion. Allerdings könnte es sein, dass Wachstumsfaktoren auch das Tumorwachstum beeinflussen. Bei Intensivpatienten erhöhen sie sogar die Mortalität.
Insulin-like Growth Factor (IGF-1): Stimuliert das Tumorwachstum.
Beide Substanzen können nicht empfohlen werden, da nicht ausgeschlossen werden kann, dass Tumorzellen stimuliert werden.
Anabole Androgene Steroide (AAS)/Selektive Androgen Response Modifier (SARM): AAS wie Nandrolon, Fluoxymesteron oder Oxandrolon wurden in zum Teil großen randomisierten Studien (RCT) getestet und führten nach vier bis zwölf Wochen zur Gewichts-, Lean-Body-Mass- und Appetitzunahme. Sie sind aber weniger effektiv als Kortikosteroide oder Progesteron. Auch die Nebenwirkungen – Depression, Thromboembolien oder Bluthochdruck – sind nicht zu vernachlässigen. Der Einsatz von AAS kann daher nicht empfohlen werden.
Enobosarm ist der erste SARM, der in Studien getestet wird, die zeigen, dass die Lean Body Mass und die Kraft zunehmen [3]. Wenn Medikamente dieser Substanzklasse auf den Markt kommen, stellen sie eine Therapieoption dar.
Antiinflammatorische Substanzen: Für folgende weitere Substanzen liegen Untersuchungen vor: Nicht steroidale Antirheumatika (Ibuprofen, ASS, Indomethacin, Diclofenac, Cox-2-Hemmer), Omega-3-Fettsäuren, Anti-Zytokine (IL-6-Antikörper), Melatonin, Antioxidantien, JAK 1/2 Inhibitoren (Ruxolitinib).
NSAR: Alle oben genannten Substanzen wurden positiv in Studien getestet, bei einigen kam es zu Verbesserung des Gewichtes und der Lebensqualität. Ein systematischer Review wertete 13 Studien aus, sechs davon randomisiert. Die meisten waren klein, nicht randomisiert mit suboptimalem Design. 11 von 13 zeigten Stabilisation oder Verbesserung des Gewichtes oder der Lean Body Mass. Fazit: NSAR können zu einer Verbesserung des Gewichtes führen, aber die Evidenz ist zu schwach, um sie zu empfehlen. Auch die Nebenwirkungen sind zu beachten.
Omega-3 Fettsäuren (EPA): In den zahlreichen vorliegenden Studien wurden 2,2 –2,5 g/Tag EPA, zum Teil in Kombination, randomisiert eingesetzt. 2007 wurden sie vom Cochrane-Institut nicht empfohlen. In einer neueren Untersuchung bei Lungenkarzinompatienten kam es zu Gewichts- und Muskelmassezuwachs. Im Vergleich zu Plazebo kam es auch zu einem besseren Tumoransprechen ohne Nebenwirkungen. Hauptproblem ist die Patientencompliance wegen des Geschmacks und des unangenehmen Aufstoßens. Fazit: Einen Versuch ist EPA wert.
Substanzen ohne Effekte
Substanzen, für die keine klaren Vorteile vorliegen, sind verzweigtkettige Aminosäuren. In wenigen kleinen randomisierten Studien führten diese zu Gewichtszunahme und Verbesserung der Lebensqualität. Die Datenlage ist aber unklar.
Für folgende andere inflammatorische Substanzen gibt es jeweils wenige Studien ohne überzeugende Daten: Infliximab, Etanercept, Pentoxifyllin (keine positiven Ergebnisse), Thalidomid (Appetit- und Gewichtszunahme), Clarithromycin (Gewichtszunahme), Melatonin (weniger Gewichtsverlust, Review: Überleben verbessert), Antioxidantien (keine verwertbaren Studien ohne Bias), Proteasome-Inhibitoren (ohne Effekt), Betablocker (Reduktion des Ruhe-Energiebedarfs), HMB = ß-Hydroxy-ß-Methyl-butyrate + GLN + ARG (keine positiven Ergebnisse), Hydrazinsulfate (Gewichtszunahme), ATP (weniger Gewichtsverlust, Zunahme Muskel). Die genannten Substanzen können daher nicht zur Einnahme empfohlen werden.
Neue Substanzen
Interleukin-6-Antikörper: Interleukin 6 (IL-6) führt zu Muskelverlust und ist bei verschiedenen Tumorerkrankungen, z. B. Lungenkarzinom im kachektischen Zustand, deutlich erhöht. Patienten mit IL-6-Erhöhung haben ein verkürztes Überleben. In Fallbeispielen wurde der IL-6-Antikörper Tocilizumab (RoActemra®) eingesetzt und die Kachexie besserte sich durch deutliche Gewichtszunahme [4, 5].
IL-6 aktiviert auch den JAK/STAT-3-Pathway, ein Zellweg mit ausgeprägter Inflammation. Nach Entwicklung eines JAK-2-Inhibitors für die hämatologische Erkrankung Myelofibrose fand sich in Studien eine deutliche Gewichtszunahme im Verumarm [6]. In einer randomisierten Studie bei Pankreaskarzinom-Patienten nahmen die Teilnehmer mit additiver Ruxolitinib-Gabe im Vergleich zu Plazebo signifikant mehr an Gewicht zu [7].
Myostatin reguliert den Skelettmuskel, seine Blockade führt zur Zunahme von Skelettmuskelmasse und -stärke. Es werden derzeit Studien mit einem humanisierten Antikörper bei Tumorpatienten mit Muskelverlust durchgeführt.
Fazit: Die neuen Substanzen zeigen deutliche positive Effekte (IL-6-AK und JAK-Inhibitor) und sind nebenwirkungsarm. Sie sollten in Zukunft Beachtung finden nach weiteren prospektiven Untersuchungen.
Körperliche Aktivität
Ein wesentlicher Bestandteil der Kachexietherapie ist die körperliche Aktivität, die bei Tumorpatienten deutlich vermindert ist. Diese sollte unter und nach der Tumortherapie durchgeführt werden und sowohl Ausdauer-, Kraft- und Gleichgewichtstraining beinhalten. Zahlreiche Untersuchungen zeigen, dass Ausdauertraining die Inflammation reduziert und damit dem Muskelkatabolismus entgegenwirkt. Es erhöht zudem die Proteinsynthese, reduziert die Proteindegradation, verbessert die Muskelstärke, die physische Leistungsfähigkeit und die Lebensqualität der Tumorpatienten [8].
Individuelle Strategien gefragt
Die Mangelernährung/Kachexie des Tumorpatienten sollte frühzeitig erkannt und frühzeitig behandelt werden, da eine chronische Kachexie nicht mehr beeinflussbar ist. Die Behandlungsstrategie sollte individuell sein, multimodal und in enger Absprache zwischen dem Hausarzt und dem Facharzt erfolgen (Übersicht 3).
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2016; 38 (2) Seite 36-41