Als therapieresistent gilt eine Hypertonie, die sich trotz der Einnahme einer antihypertensiven Dreifachtherapie inklusive eines Diuretikums nicht beherrschen lässt. Ausgewählte Patienten könnten in dieser Situation von einer minimalinvasiven Bluthochdrucktherapie profitieren. Für wen die interventionelle renale Sympathikusdenervation (RDN) infrage kommt und welche Ergebnisse zu erwarten sind, soll im folgenden Beitrag dargestellt werden.
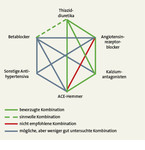
Die arterielle Hypertonie gehört zu den häufigsten chronischen Erkrankungen weltweit und ist ein Hauptrisikofaktor für kardiovaskuläre Morbidität und Mortalität [1]. Etwa 5 – 15 % aller Patienten mit Bluthochdruck weisen eine therapieresistente arterielle Hypertonie auf, welche mit einem deutlich erhöhten kardiovaskulären Risiko assoziiert ist [2, 3]. Die therapieresistente arterielle Hypertonie ist definiert als eine nicht leitliniengerechte Blutdruckeinstellung (> 140/90 mmHg allgemein) trotz der kontinuierlichen Einnahme einer antihypertensiven Dreifachtherapie unter Einbeziehung eines Diuretikums in geeigneter Kombination (Abb. 1) [2].
In der Pathophysiologie der Erkrankung kommt der Überaktivität des vegetativen Nervensystems mit einer Dysbalance aus sympathischer und parasympathischer Aktivität eine besondere Bedeutung zu [4]. Eine Zunahme der efferenten sympathischen Aktivität in der Niere führt zu einer vermehrten Renin-Ausschüttung, vermehrter Natriumretention (proximaler Tubulus) und verminderter renaler Perfusion [4].
Unterschieden werden muss zwischen einer „echten“ Therapieresistenz und einer Pseudoresistenz (24-h-Mittelwert < 130/80 mmHg), beispielsweise durch eine mangelnde Medikamentenadhärenz oder situativ erhöhte Blutdruckwerte im Sinne einer Weißkittelhypertonie [2].
Ursachen sekundärer Hypertonie
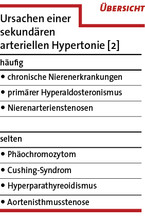
In bis zu 20 % der Fälle liegen bei Patienten mit therapieresistenter Hypertonie sekundäre Ursachen des Bluthochdrucks zugrunde (Übersicht) [2]. Potenziell reversible Ursachen beinhalten auch eine suboptimale antihypertensive Therapie sowie blutdrucksteigernde Nebenwirkungen anderer Medikamente (z. B. nichtsteroidale Antirheumatika, Kortison). Neben einer ausführlichen Anamnese, körperlicher Untersuchung und einer ambulanten 24-h-Blutdruckmessung sollten folglich bei Patienten mit therapieresistenter arterieller Hypertonie die Bestimmung von Serumelektrolyten, Glukose und renalen Retentionsparametern sowie eine Urindiagnostik mit Proteinbestimmung und Natriumurinausscheidung fester Bestandteil der Behandlung sein [5]. Ein Screening auf einen primären Hyperaldosteronismus erfolgt durch Bestimmung der Aldosteron-Renin-Ratio. Hierbei ist unbedingt auf mögliche Interaktionen mit antihypertensiven Substanzen zu achten. Sollte sich ein Hinweis für einen primären Hyperaldosteronismus ergeben (Aldosteron-Renin-Ratio > 50), sind weiterführende bildgebende Verfahren sowie eine seitengetrennte Nebennierenvenenblutentnahme zu empfehlen. Patienten mit episodischen, krisenhaften Blutdruckanstiegen sollten mittels 24-h-Sammelurin oder Plasma-Katecholaminmessung auf das Vorliegen eines Phäochromozytoms untersucht werden. Außerdem ist eine Doppler-/Duplex-Sonographie der Nierenarterien zum Ausschluss einer atherosklerotischen Nierenarterienstenose bzw. fibromuskulären Dysplasie anzuraten. Des Weiteren sollte bei entsprechender Anamnese (Schnarchen, Tagesmüdigkeit, Halsumfang > 48 cm) auf das Vorliegen eines obstruktiven Schlafapnoesyndroms getestet werden.
Technik der renalen Denervation
Bereits in den 1950er Jahren galt die operative Splanchniektomie als Reserveverfahren zur Behandlung des schweren Bluthochdrucks [6]. Durch die radikale Durchtrennung der sympathischen Nervenfasern konnten Blutdruckreduktionen von bis zu 70 mmHg erzielt werden. Der Eingriff führte jedoch sehr häufig zu schwerwiegenden Komplikationen wie massivem Schwindel, Synkopen, Inkontinenz und erektiler Dysfunktion [6]. Neuerdings ist es möglich, die renalen Sympathikusfasern durch ein minimal-invasives katheterbasiertes Verfahren gezielt zu veröden. Dazu wird über einen femoralen oder radialen Zugang, unter Röntgendurchleuchtung, ein Ablationskatheter in die Nierenarterien eingebracht, über welchen nachfolgend Ablationsenergie (z. B. Hochfrequenzstrom oder Ultraschall) abgegeben werden kann. Dies führt zur Verödung der sich in der Adventitia befindlichen sympathischen Nervenfasern [7]. Die Prozedur dauert je nach Device etwa 30 bis 45 Minuten und wird an beiden Nieren durchgeführt. Da die Sympathikusfasern von C-Schmerzfasern begleitet werden, treten während der Energieabgabe kurzzeitig und nur für die Dauer der Energieabgabe (30 bis 120 Sekunden) Schmerzen auf, so dass für diesen Moment eine Analgosedierung notwendig ist [5]. Im Anschluss an den Eingriff ist eine kontinuierliche Nachuntersuchung der Patienten, in der Regel alle drei bis sechs Monate im ersten Jahr nach dem Eingriff, später einmal jährlich, zu empfehlen [5]. Der Eingriff ist als risikoarm anzusehen und die Risiken sind vergleichbar mit denen einer Herzkatheteruntersuchung. Im Global Symplicity Registry (NCT01534299) gab es unter 1 000 Interventionen fünf eingriffsbedingte Gefäßkomplikationen, viermal an der Einstichstelle und eine Dissektion der Nierenarterie [8]. Das gute Sicherheitsprofil des Eingriffs zeigte auch die kürzlich veröffentlichte Symplicity-HTN-3-Studie [9].
Effekte auf den Blutdruck
In der multizentrischen, offenen Proof-of-Concept-Studie Symplicity HTN-1 [10] wiesen die Patienten (n=45) vor der RDN unter Therapie mit durchschnittlich 4,7 antihypertensiven Substanzen einen Praxisblutdruck von 177/101 mmHg auf. Bereits nach einem Monat konnte in der Behandlungsgruppe eine signifikante Blutdrucksenkung um 14/10 mmHg (p=0,026) dokumentiert werden. Dieser Effekt nahm über den Nachbeobachtungszeitraum kontinuierlich zu und lag nach zwölf Monaten bei -27/-17 mmHg (p=0,026) bei unveränderter antihypertensiver Medikation. Ein erneuter Anstieg des Blutdruckes wurde während des Studienzeitraums von 36 Monaten auch in der 2013 veröffentlichten finalen Nachbeobachtung nicht dokumentiert [11]. Dies macht eine funktionelle Regeneration der Nervenfasern unwahrscheinlich, sodass von einem längerfristigen Effekt ausgegangen werden kann.
In der randomisierten kontrollierten Symplicity-HTN-2-Studie [12] (n=106) kam es sechs Monate nach der RDN zu einer signifikanten Reduktion des Blutdrucks um 32/12 mmHg (p<0,0001), wohingegen der Blutdruck in der Kontrollgruppe unverändert blieb. Durch die Blutdrucksenkung konnte bei 20 % der Patienten eine Reduktion der Anzahl der eingenommenen Medikamente beziehungsweise ihrer Dosis erzielt werden.
In der Symplicity HTN-3 [13] bei 535 Patienten mit schwerer resistenter arterieller Hypertonie (>160 mmHg) erhielt eine Gruppe eine "Scheinprozedur", bei der die Patienten ebenfalls analgosediert, angiographiert und im Schnitt für 56 Minuten mit Kopfhörern und Sonnenbrillen im Herzkatheterlabor verblieben. Insgesamt 364 Patienten wurden einer renalen Denervierung unterzogen. Es zeigte sich nach sechs Monaten eine Reduktion des systolischen Praxisblutdrucks von 14,13 mmHg in der RDN-Gruppe und eine Abnahme von 11,74 mmHg in der Scheinprozedurgruppe. Die Blutdruckunterschiede im Vergleich zum Ausgangsblutdruck waren jeweils signifikant, die Unterschiede zwischen den Gruppen nicht. Trotz des gut konzipierten Studiendesigns gibt es eine Reihe von Diskussionspunkten [14]. So wurden beispielsweise die 364 Patienten der RDN-Gruppe von 111 Untersuchern behandelt, die nur wenig bis keine Erfahrung mit der Prozedur hatten [9]. Insofern ist die Frage der technischen Qualität der Interventionen offen. Des Weiteren wurden trotz der Empfehlung im Studienprotokoll, die antihypertensive Medikation in den ersten sechs Monaten konstant zu halten, bei 38 % der RDN-Gruppe und 40 % in der Sham-Gruppe Änderungen vorgenommen.
In den bisher durchgeführten klinischen Studien lag die Non-Response-Rate zwischen 8 und 42 % [16]. Prädiktoren für ein fehlendes Ansprechen auf die Behandlung konnten bislang nicht identifiziert werden [17]. Kürzlich publizierte Daten konnten außerdem zeigen, dass die Blutdruckreduktion auch unter körperlicher Belastung anhält, wodurch sich die Belastbarkeit der Patienten im Rahmen einer Fahrradergometrie verbesserte [18]. In diesem Jahr konnten auch erstmals Daten zu Patienten mit milderen Formen von therapieresistentem Bluthochdruck (n=54) mit einem systolischen Blutdruck zwischen 140 und 160 mmHg veröffentlicht werden [19]. In dieser Gruppe reduzierte die RDN den Praxisblutdruck um 13/7 mmHg (p<0,001) nach sechs Monaten.
Kontraindikationen
Die aktuellen Kontraindikationen für eine RDN sind eine Hypertonie sekundärer Genese (mit Ausnahme eines obstruktiven Schlafapnoesyndroms), eine ungeeignete Anatomie der Nierenarterien (Durchmesser < 4 mm, Länge < 20 mm; fibromuskuläre Dysplasie; signifikante Nierenarterienstenose) sowie eine GFR < 45 ml/min pro 1,73 m² [5].
Pleiotrope Effekte
Im Rahmen einer Echokardiographie-Studie konnte gezeigt werden, dass eine RDN zu einer Reduktion der linksventrikulären Masse (insbesondere bei linksventrikulärer Hypertrophie) und zu einer Verbesserung der diastolischen Funktion führen kann [20]. Jene Ergebnisse wurden im letzten Jahr mittels Magnetresonanztomographie bestätigt [21]. Des Weiteren konnten auch erste positive Effekte bei Patienten mit chronischer Herzinsuffizienz [22], bei tachykarden Rhythmusstörungen [23] sowie eine Verbesserung einer vorbestehenden Albuminurie [24] gezeigt werden.
Meinung der Fachgesellschaften
Sowohl die Deutsche Gesellschaft für Kardiologie [15] als auch die European Society of Hypertension [27] haben in ihren Stellungnahmen zur aktuellen Datenlage klargemacht, dass das Verfahren trotz des neutralen Studienausgangs der Symplicity HTN-3 aufgrund der methodischen Kritikpunkte sowie der positiven Ergebnisse vorheriger Studien eine Therapieoption für Patienten mit therapieresistenter Hypertonie unter optimierter medikamentöser Therapie darstellt. Die Voruntersuchungen und die Eingriffe sollten an erfahrenen Zentren durchgeführt werden. Um Zuweisern, Kostenträgern und Patienten bei der Auswahl geeigneter Kliniken zu helfen, haben die Deutsche Gesellschaft für Kardiologie, Deutsche Gesellschaft für Nephrologie und Deutsche Hochdruckliga die Zertifizierung von "Renalen Denervations-Zentren" initiiert [26]. Alle behandelten Patienten sollten konsequent nachverfolgt und wissenschaftlichen Untersuchungen zugänglich gemacht werden.
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2014; 36 (20) Seite 52-56