Die Entwicklung in der Diabetestechnologie ist in den vergangenen Jahrzehnten rasant vorangegangen. Im Bereich der Insulinapplikation und der Überwachung des Stoffwechsels wurden diverse neue Technologien entwickelt. Ziele dieser Hilfsmittel sind das Erreichen einer guten Stoffwechsellage ohne starke Blutzuckerschwankungen, Hypoglykämien und lange Episoden von erhöhten Blutzuckerwerten, hohe Zuverlässigkeit und Genauigkeit sowie Alltagstauglichkeit und Bedienerfreundlichkeit.
Der Diabetestechnologie kommt im Alltag von Diabetespatienten eine große Bedeutung zu. Erst durch den Einsatz dieser Technologien wurde ein Teil der in der Diabetestherapie eingesetzten Behandlungsformen, wie z. B. die Intensivierte Insulintherapie (ICT), ermöglicht. Der Erfolg der Therapie und auch die Compliance der Patienten kann u. a. von der Zuverlässigkeit und Bedienerfreundlichkeit der eingesetzten Geräte abhängen. Die Schulung der Patienten ist eine wesentliche Voraussetzung für die erfolgreiche Nutzung von vielen Diabetestechnologien.
Insulinspritzen, Insulinpens, Insulinpumpen, Blutzuckermessgeräte und andere am Menschen angewandte Technologien zählen zu den Medizinprodukten und fallen unter die Regelungen des Medizinproduktegesetzes. Diese werden nicht wie Arzneimittel von der Europäischen Zulassungsbehörde EMA (European Medicines Agency) zugelassen, sondern vom Hersteller nach einem sogenannten Konformitätsbewertungsverfahren mit einem CE-Zeichen versehen. Damit ist der Vertrieb des Gerätes in Europa erlaubt. Die Erstattung durch die Krankenkassen hängt von der Aufnahme in das Hilfsmittelverzeichnis ab.
Insulinspritzen
Die wiederverwendeten Glasspritzen mit schmerzhaften Nadeln wurden durch die heute gebräuchlichen Einwegspritzen ersetzt. Moderne Einwegspritzen haben durch eine eingeschweißte, schmerzarme Nadel wenig Totraum und eine hohe Dosiergenauigkeit. Diese sind auch zur Mischung von Insulinen (z. B. Verzögerungs- und kurzwirkendes Insulin) geeignet. Mittlerweile wird vorwiegend U100 (100 IE Insulin pro ml)-Insulin und nur noch selten das früher gebräuchliche U40-Insulin benutzt (Abb. 1).
Insulinpen
Der Insulinpen ist mittlerweile die bevorzugte Applikationsmethode für Insulin (Abb. 2). Es gibt Fertigpens und wiederverwendbare Pens, bei denen die Insulinkartusche ausgetauscht wird. Es werden heute nur Insulinkartuschen mit Insulinformulierungen der Konzentration U100 verwendet, die in den Dosierschritten 0,5 IE, 1 IE und 2 IE abgegeben werden können. Einzelne Pen-Modelle bieten sogar die Möglichkeit, die letzte abgegebene Dosis zu speichern.
Nadeln
Moderne Pen-Einwegnadeln verfügen über einen speziellen Schliff und eine Oberflächenbehandlung, um eine schmerzarme Injektion zu erreichen. In den letzten Jahren sind Pen-Nadeln mit einer Länge von nur 4 bis 6 mm auf den Markt gekommen, die die Haut (Hautdicke < 3 mm) sicher durchdringen und für die subkutane Insulininjektion bei Erwachsenen ausreichen. Mit steigender Nadellänge steigt das Risiko einer versehentlichen intramuskulären Injektion [15].
Erwärmung der Spritzstelle
Die Erwärmung der Spritzstelle kann die Resorption des applizierten Insulins beschleunigen [23]. In den letzten Jahren wurde ein Gerät (InsuPad®) entwickelt, das die Haut im Bereich der Insulin-Injektionsstelle erwärmt. Durch den Einsatz dieses mittlerweile CE-gekennzeichneten Gerätes konnte bei Patienten mit hohem Insulinbedarf die benötigte Insulindosis reduziert werden [29, 13].
Intensivierte Insulintherapie (ICT)
Ein Beispiel für den Einsatz der oben beschriebenen Technologien ist die Intensivierte Insulintherapie (ICT). Sie wird als Behandlungsstandard bei Typ-1-Diabetes empfohlen [6]. Bei dieser Therapieform werden langwirkendes Basalinsulin und kurzwirkendes Mahlzeiteninsulin injiziert. Die Dosis des vor den Mahlzeiten mehrfach täglich applizierten kurzwirkenden Insulins wird an die jeweilige Mahlzeit und an den gemessenen Blutzuckerwert angepasst.
Insulinpumpentherapie (CSII)
Für die Behandlung von Patienten mit Typ-1-Diabetes ist die Insulinpumpentherapie (Continuous Subcutaneous Insulin Infusion – CSII), bei der eine kontinuierliche subkutane Insulininfusion der sogenannten Basalrate erfolgt, eine seit Jahren etablierte Therapieform [12]. Ziel der CSII ist es, die physiologische Insulinsekretion möglichst nachzuahmen. Die CSII ist eine spezielle Form der Intensivierten Insulintherapie (ICT). Bei der CSII werden allerdings ausschließlich kurzwirkende Insuline, in der Regel kurzwirkende Insulinanaloga, verwendet. Hierbei kann die Basalrate an die Tagesrhythmik und den individuellen Bedarf angepasst werden. Außerdem kann bei Bedarf jederzeit ohne einen zusätzlichen Stich eine Insulindosis, der sogenannte Bolus, abgegeben werden.
Insulinpumpen
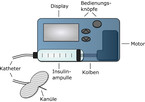
Eine herkömmliche Insulinpumpe besteht aus einem kleinen Motor, der einen Kolben antreibt, einer Ampulle mit Insulinreservoir, einem Katheter mit Infusionsset und diversen Bedienungsknöpfen bzw. einem Display (Abb. 4). Die Pumpe wird außen am Körper, z. B. am Gürtel oder in der Hosentasche, getragen und über einen Kunststoffkatheter wird das Insulin durch eine Teflon- oder Metallkanüle in das Unterhautfettgewebe infundiert. Nach ca. drei Tagen sollte das Infusionsset gewechselt werden, um Probleme wie Entzündungen der Einstichstelle, Katheterverschlüsse oder Effekte auf die Insulinwirkung zu vermeiden [37]. Aktuell erhältliche Insulinpumpen (z. B. MiniMed™ 640G, ParadigmVEO™, Accu-Chek® Spirit Combo, Accu-Chek® Insight, Animas®
Vibe™, DANA Diabecare R) sind klein, leicht zu bedienen und zuverlässig in der Dosierung des Insulins.
Moderne Pumpen bieten die Möglichkeit, mehrere Basalraten und unterschiedliche Bolusformen, die mit verschiedenen Abgabeverzögerungen arbeiten, auszuwählen. In der Regel ist ein Boluskalkulator in das Pumpensystem integriert und einige Pumpen sind direkt oder per Funk mit einem Blutzuckermessgerät oder einem kontinuierlichen Glukosesensor gekoppelt.
Patch-Pumpen
Eine neue Entwicklung stellen die sogenannten Patch-Pumpen (z. B. mylife OmniPodTM) dar. Diese werden direkt auf der Haut angebracht und benötigen keinen Katheter. Die Steuerung sowie die automatische Insertion erfolgen über ein Handgerät. Patch-Pumpen sind wasserdicht und können so beim Duschen am Körper verbleiben [34], eine Unterbrechung der Insulinzufuhr, z. B. beim Sport, ist auch möglich. Eine weitere Patch-Pumpe (Cellnovo System), die noch nicht in Deutschland verfügbar ist, übermittelt alle Daten regelmäßig an einen Webserver, auf den man über einen Internetzugang zugreifen kann.
Insulinpumpe für Typ-2-Diabetes
Eine CE-gekennzeichnete Insulinpumpe (PaQ®) speziell für Typ-2-Diabetiker wurde bereits erfolgreich getestet. Es handelt sich ebenfalls um eine Patch-Pumpe mit Basalratenabgabe und einem Bolusknopf, über den direkt zwei Insulineinheiten abgegeben werden können. Der Nutzen einer CSII für Patienten mit Typ-2-Diabetes wird von einer aktuellen Studie belegt [35].
Evidenz + Schulung
Für die CSII bei Typ-1-Diabetes konnte eine HbA1c-Senkung und eine Hypoglykämiereduktion im Vergleich zur ICT gezeigt werden [31, 18, 25]. Wenn die Möglichkeiten der ICT ausgeschöpft sind, bei Hypoglykämien und bei geplanter Schwangerschaft wird eine CSII empfohlen [6].
Stoffwechselkontrolle
Die Blutzuckerselbstmessung, deren Anfänge inzwischen über 40 Jahre zurückliegen, hat mittlerweile die Harnzuckerselbstmessung weitgehend ersetzt. Im letzten Jahrzehnt kam die kontinuierliche Glukosemessung im Unterhautfettgewebe als weitere Methode zur Glukosemessung hinzu.
Blutzuckerselbstkontrolle
Für Diabetespatienten, die mit einer ICT behandelt werden, ist die Blutzuckerselbstkontrolle (BZSK) unerlässlich, da sie die flexible Anpassung der Insulindosis an die aktuelle Stoffwechselsituation erlaubt. Die BZSK wird auch für Patienten empfohlen, die eine konventionelle Insulintherapie durchführen [28, 40]. In den letzten Jahren wurde intensiv diskutiert, inwieweit die BZSK auch für Patienten, die mit Diät oder oralen Antidiabetika behandelt werden, eingesetzt werden sollte [26, 7]. Auch für diese Patientengruppe konnte in Studien, die strukturierte Blutzuckerselbstmessungen mit regelmäßigen 7-Punkte-Profilen einsetzten, ein positiver Effekt auf die Stoffwechselkontrolle gezeigt werden [33, 21].
Stechhilfen
Mittlerweile gibt es Stechhilfen mit Stechtiefeneinstellung, bei denen eine speziell geschliffene kleine Einweg-Lanzette in einem Gehäuse mit einem Federmechanismus gespannt wird. Nach Auslösung wird die Lanzette mit der Feder bis zur eingestellten Tiefe in die Haut eingeführt und umgehend zurückgezogen. Schliff, Beschichtung und vibrationsarme, präzise Führung der Lanzette bewirken einen schmerzarmen Einstich [22, 41].
Es sind Stechhilfen verfügbar, die Trommeln mit bis zu sechs Lanzetten enthalten. Diese haben den psychologischen Vorteil, dass die Lanzetten für den Patienten nicht sichtbar sind, und erleichtern den regelmäßigen Wechsel der Lanzetten [24]. Lanzetten sind nur für den einmaligen Gebrauch vorgesehen und sollten regelmäßig gewechselt werden, um einen möglichst schmerzarmen Stich zu gewährleisten und um Komplikationen zu vermeiden [38, 27].
Blutzuckermesssysteme
Blutzuckermesssysteme bestehen aus dem Messgerät und den zugehörigen Teststreifen mit den Enzymen Glukoseoxidase oder Glukosedehydrogenase, die die im Blut enthaltene Glukose umsetzen und daraus einen Farbumschlag oder Stromfluss erzeugen. Aus diesem wird der aktuelle Blutzuckerwert berechnet. Aktuelle Blutzuckermessgeräte benötigen häufig nur noch ein Blutvolumen zwischen 0,3 und 1 µl und zeigen den Messwert schon nach wenigen Sekunden an. Gemessen wird im Kapillarblut, das mittels einer Stechhilfe bevorzugt aus der Fingerbeere gewonnen wird. Alternative Körperstellen zum Messen sind z. B. Handballen, Unterarm oder Bauch. Diese Stellen sollten nur nach ausführlicher Schulung verwendet werden, da es vor allem bei raschen Blutzuckeränderungen zu abweichenden Ergebnissen kommen kann [19].
Moderne Blutzuckermessgeräte bieten oft Speicher und Auslesemöglichkeiten der Blutzuckerwerte und teilweise sogar eine elektronische Tagebuchführung. Mittlerweile sind auch Blutzuckermessgeräte mit einem integrierten Boluskalkulator für die Insulindosis erhältlich. Insbesondere zur Nutzung der Daten, z. B. zur Kalkulation eines HbA1c-Schätzwertes oder zur Datenübertragung z. B. an Apps, gibt es aktuelle Weiterentwicklungen.
Einflüsse auf die Messgenauigkeit
In der internationalen Norm ISO 15197:2003 werden Anforderungen an die Messgenauigkeit von Blutzuckermesssystemen definiert. Erlaubt sind Abweichungen der Messergebnisse zur Herstellerreferenz von bis zu 15 mg/dl bei Werten unter 75 mg/dl und bis zu 20 % bei Werten darüber. Im Jahre 2013 wurde eine überarbeitete Version der Norm (ISO 15197:2013) publiziert, für die bis 2016 eine Übergangsfrist besteht. In dieser sind nur noch Abweichungen von bis zu 15 mg/dl bei Werten unter 100 mg/dl und von bis zu 15 % bei Werten über 100 mg/dl zulässig. Auch wenn alle Blutzuckermessgeräte, die in Europa auf dem Markt sind, ein CE-Zeichen tragen und die Vorgaben der ISO 15197:2003 erfüllen sollten, kann es doch deutliche Unterschiede in der Messgenauigkeit geben [8, 9].
Kontrolllösung
Die Messung mit Kontrolllösung, welche spezifisch auf ein Blutzuckermesssystem abgestimmt ist, ist die einzige Möglichkeit für die Anwender, ein Blutzuckermesssystem zu überprüfen. Idealerweise sollte man bei jedem Wechsel der Teststreifendose eine Messung mit Kontrolllösung bei Raumtemperatur durchführen.
Handhabung
Die Handhabung der Blutzuckermessgeräte und Teststreifen inkl. Lagerung sowie die korrekte Durchführung der Messung sind von entscheidender Bedeutung für genaue Messergebnisse (Übersicht 1) [36]. Mit Nahrungsresten verunreinigte Finger können zu deutlichen Abweichungen führen, daher sollte die Messung mit gewaschenen und trockenen Händen durchgeführt werden. Falls dies nicht möglich ist, sollte der erste Tropfen abgewischt werden [16, 14].
- Die Teststreifen sachgerecht lagern
- Teststreifendose nach Entnahme sofort schließen (Luftfeuchtigkeit)
- Code abgleichen, wenn erforderlich
- Das System regelmäßig mit Kontrolllösung testen (z. B. jede neue Teststreifendose)
- Umgebungsbedingungen (Temperatur, Höhe, Luftfeuchtigkeit) berücksichtigen
- Vorbereiten der Messung: Bereitlegung des Materials (Blutzuckermessgerät, Teststreifen, Stechhilfe, Tupfer, Tagebuch, Kugelschreiber)
- Lanzette wechseln
- Die Messung mit gewaschenen und gut abgetrockneten Händen durchführen
- Bei ungewaschenen Händen ersten Blutstropfen abwischen
- Einen ausreichend großen Blutstropfen zügig auf den Teststreifen auftragen, das Messfeld muss vollständig befüllt sein
Kontinuierliches Glukosemonitoring (CGM)
Systeme für das kontinuierliche Glukosemonitoring ("Continuous Glucose Monitoring" – CGM) sind seit 15 Jahren auf dem Markt. Nadelsensoren messen die Glukosekonzentration enzymatisch im subkutanen Gewebe und übertragen die Daten alle ein bis fünf Minuten an ein Anzeigegerät. Derzeit verfügbare CGM-Systeme (Dexcom G5TM, FreeStyle Navigator II, Guardian® REAL-Time) müssen regelmäßig durch Blutzuckermessungen mit Kapillarblut kalibriert werden und können für fünf bis sieben Tage getragen werden.
CGM-Systeme können wertvolle Zusatzinformationen zu den punktuellen Blutzuckermessungen liefern [2]. Es können z. B. unbemerkte, vor allem nächtliche Hypoglykämien identifiziert und durch einen Alarm deutlich gemacht werden sowie der Glukosetrend angezeigt werden. Ein Zusatznutzen von CGM im Vergleich zur alleinigen konventionellen BZSK wurde durch eine Verbesserung der HbA1c-Werte sowie durch eine geringere Zeit im hypoglykämischen Bereich gezeigt [30]. Allerdings ist eine regelmäßige Nutzung der Sensoren und der aufgezeichneten Werte hierfür vorauszusetzen [20].
Alle derzeit verfügbaren CGM-Systeme messen die Glukosekonzentration im Zwischenzellraum (Interstitium). Es kann daher physiologisch bedingte Unterschiede im Vergleich zu Ergebnissen der BZSK geben, welche vor allem während rascher glykämischer Schwankungen auftreten. Dies trägt dazu bei, dass CGM-Systeme im Vergleich zu blutzuckerbasierten Referenzmessungen zeitweise deutliche Unterschiede aufweisen [10, 32].
Das "Flash Glucose Monitoring System"
Seit dem Herbst 2014 steht mit dem "Flash Glucose Monitoring (FGM) System" eine weitere Option für das Glukosemonito
ring zur Verfügung. Das FGM-System besteht aus einem werkskalibrierten Sensor, der in das Unterhautfettgewebe am Oberarm angebracht wird. Es kann bis zu 14 Tage getragen werden und misst, wie die CGM-Systeme, die Glukosekonzentration im Interstitium. Mit einem Lesegerät können der aktuelle Glukosewert sowie der Glukosetrend und die Werte der letzten acht Stunden angezeigt werden [17]. Es gibt bisher eine erste Studie zur Genauigkeit der Glukosemessung mit dem FGM-System [5], jedoch sind Publikationen zum Ersatz von Blutzuckermessungen durch FGM derzeit noch nicht verfügbar [4].
Kosten der Therapie
In Deutschland müssen Technologien in der Regel in das Hilfsmittelverzeichnis aufgenommen werden, um eine Erstattungsfähigkeit zu erreichen. Insulinpumpen werden bei Indikation auf Antrag erstattet, CGM-Geräte müssen i. d. R. selbst finanziert werden.
Blutzuckerteststreifen gelten hierbei als Arzneimittel und gehen damit in die Berechnung der Arzneimittelausgaben und der Richtgrößen ein, die Erstattung wird dann jeweils landesspezifisch geregelt.
Was bringt die Zukunft?
Neben den in den vorherigen Ausführungen schon beschriebenen technologischen Entwicklungen spielt das Datenmanagement in den letzten Jahren eine immer größere Rolle. Telemedizinische Ansätze, die die Informationen aus den Diabetestechnologien zum Arzt übertragen, werden in verschiedenen Projekten (wie z. B. Esysta) untersucht. Auch Hilfen für den Patienten wie Boluskalkulatoren sind bereits verfügbar und werden weiterentwickelt.
Das nicht-invasive Glukosemonitoring ohne Stechen wäre für Patienten mit Diabetes eine große Entlastung [11]. Trotz intensiver Forschungsbemühungen ist bisher kein Produkt auf dem Markt verfügbar, welches dem Patienten ein alltagstaugliches und zuverlässiges nicht-invasives Glukosemonitoring erlaubt [39].
Die CSII wurde in einigen verfügbaren Pumpen (Animas Vibe®, Paradigm VEO®, MiniMed 640G®) bereits mit der Sensortechnologie gekoppelt. So ist z. B. die zeitweise automatische Abschaltung der Insulinbasalrate bei niedrigen Werten, auch vorausschauend, bereits möglich. Somit sind wir auf dem Weg zum künstlichen Pankreas, das in verschiedenen Forschungsprojekten weltweit untersucht wird. Allerdings sind, bevor ein vollautomatisches System zur Verfügung steht, noch einige Produktgenerationen mit Teilfunktionen, die wiederum einen geschulten Anwender brauchen, zu erwarten.
Interessenkonflikte: GF ist Ärztlicher Leiter und Geschäftsführer des IDT (In-stitut für Diabetes-Technologie, Forschungs- und Entwicklungsgesellschaft mbH an der Universität Ulm), welches Studien zu Medizinprodukten für die Diabetestherapie für verschiedene Firmen durchführt. GF erhielt bzw. erhält Vortrags-/Beratungshonorare von Abbott, Bayer, Berlin-Chemie, Becton-Dickinson, Dexcom, Menarini Diagnostics, Novo Nordisk, Roche Diagnostics, Sanofi und Ypsomed.
Auf unserem CME-Portal www.med-etraining.de können Sie ab dem 23.2.2016 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Der Allgemeinarzt, 2016; 38 (3) Seite 58-63