Zoster ist keine lebensbedrohliche Erkrankung, aber circa 30 % der Patienten leiden an zum Teil langandauernden Komplikationen mit einer erheblichen Einschränkung der Lebensqualität. Durch die Impfung mit einer Lebendvakzine lassen sich Häufigkeit und Schwere der Zostererkrankung und insbesondere auch der postzosterischen Neuralgie reduzieren.
Zoster (Gürtelrose) ist eine Infektion zentraler und peripherer Nerven und der Haut mit dem Varizella-Zoster-Virus. Dieses Virus gehört zu den Herpesviren, was zu dem Namen „Herpes Zoster“ geführt hat. Das kann zu Verwechselungen mit Herpes-Erkrankungen durch Herpes-Simplex-Viren mit sehr viel leichteren Verläufen und weniger Komplikationen führen. Im Folgenden wird daher nur noch von Zoster gesprochen. Zoster ist das Rezidiv einer Varizella-Zoster-Virus-Primärinfektion (Varizellen), die nach endogener Reaktivierung des Virus auftritt. Eine Varizellen-Erkrankung ist daher eine Voraussetzung für Zoster, auch wenn diese nicht erinnerlich ist.
Bei Patienten mit gestörter zellvermittelter Immunität ist die Zosterinzidenz stark erhöht. Man findet ein solche Störung bei malignen Lymphomen, immunsuppressiver Therapie und Infektionen mit dem humanen Immundefizienz-Virus. Auch im Alter nimmt die zellvermittelte Immunität kontinuierlich ab, was die zunehmende Zosterinzidenz mit ansteigendem Alter belegt [2]. Insbesondere der komplizierte Zoster ist eine schwere Krankheit älterer Menschen.
Wer das 85. Lebensjahr erreicht, erkrankt mit circa 50%iger Wahrscheinlichkeit einmal in seinem Leben an Zoster [10].
Symptome
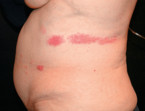
Der Zoster beginnt in der Regel mit unspezifischen Symptomen. Schmerzen, Dysästhesien, intermittierende oder permanente, brennende Missempfindungen und zum Teil heftige Berührungsschmerzen können den Hautveränderungen vorausgehen. Diese beginnen mit einem unilateralen Erythem, welches in der Regel auf ein bis drei Dermatome begrenzt ist. Danach entwickeln sich makulo-papulöse Hautveränderungen und später die typischen gruppiert stehenden Bläschen. In diesem Stadium ist eine Diagnose durch das typische klinische Bild (Abb. 1) oder einen Virusnachweis aus den Bläschen möglich.
Komplikationen
Ab dem 50. Lebensjahr steigt nicht nur die Zosterinzidenz an, sondern auch die Gefährdung der Patienten durch Komplikationen, insbesondere durch die postzosterische Neuralgie. Zusätzlich führen Zoster-Erkrankungen im Bereich der Trigeminusäste zu häufigen akuten Komplikationen, seltener zu chronischen [21].
Zoster im Kopfbereich
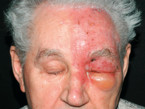
Patienten mit Zoster ophthalmicus entwickeln in 50 % Komplikationen. Neben einem Ödem der Augenlider (Abb. 2) kommen vor allem Konjunktivitis, Ptosis des Augenlides, Keratitis, Skleritis, Iridozyklitis, Uveitis, Chorioretinitis mit Lidrandulzerationen und Verlust der Wimpern vor.
Der Zoster oticus ist charakterisiert durch den Befall des 2. und/oder 3. Trigeminusastes. Die klinische Manifestation umfasst neben den typischen Bläschen im äußeren Gehörgang eine Fazialisparese, Hörminderung, Schwindel, Tinnitus, Taubheit und Schmerzen. Zoster oticus führt auch zu Läsionen im Bereich der Mundschleimhaut mit schmerzhaften Aphthen, Erosionen, Ulzerationen und Gingivitis.
Zosterassoziierte Schmerzen
Zu unterscheiden ist zwischen den akuten und den chronischen Zosterschmerzen. Die akuten Zosterschmerzen sind ein typisches Frühsymptom des Zosters. Sie treten bei über 90 % der betroffenen Patienten auf und können bis zur Abheilung der Hautveränderungen andauern. Sie werden meist als brennender und pochender Dauerschmerz wahrgenommen, weniger häufig sind intermittierende einschießende Schmerzen und seltener Schmerzauslösung durch normalerweise unbedeutende Stimuli (Allodynie).
Im Gegensatz dazu treten die chronischen Schmerzen, die auch als postherpetische (PHN), besser postzosterische Neuralgien (PZN) bezeichnet werden, nicht bei allen Patienten auf. Sie sind als neuropathische Schmerzen zu deuten [3] und gekennzeichnet durch Brennen, einschießende Schmerzen und Allodynie. Der Übergang vom Akutschmerz zur chronischen postzosterischen Neuralgie ist fließend und kann durch unterschiedliche Schmerzempfindungen im Verlauf der Erkrankung wahrgenommen werden [22].
Einmal aufgetreten sind postzosterische Neuralgien schwer zu therapieren und bewirken eine signifikante Minderung der Lebensqualität. Sie verursachen zusätzlich hohe Kosten für die betroffenen Menschen und die Gesellschaft [12].
Therapie
Ziel der Therapie eines akuten Zosters ist zum einen, die Hauterscheinungen möglichst rasch abheilen zu lassen und die Akutschmerzen zu lindern. Zum anderen sollte Komplikationen, insbesondere der postzosterischen Neuralgie, vorgebeugt werden. Dies gelingt teilweise durch den möglichst frühen Einsatz von Virostatika wie Aciclovir i. v., Brivudin oral, Famciclovir oral und Valaciclovir (Tabelle 1).
In den internationalen und nationalen Leitlinien zur Zostertherapie [5, 9] wird empfohlen, die Virostatikatherapie mit einer energischen Schmerztherapie zu kombinieren (Tabelle 2).
Da es sich bei den akuten Zosterschmerzen oft um eine Kombination nozizeptiver und neuropathischer Schmerzen handelt [3], sollte dies bei der Auswahl der Analgetika berücksichtigt werden. Analgetika, die gegen nozizeptive Schmerzen wirksam sind (z. B. Metamizol), haben im Gegensatz zu Opioiden keine Wirkung gegen neuropathische Schmerzen. Sie wirken nur bei den Patienten, bei denen noch keine neuropathischen Schmerzen aufgetreten sind (Tabelle 2).
Die Kombination der in Tabelle 2 genannten Analgetika sollte bei starken Schmerzen im Sinne einer Stufentherapie mit sogenannten Koanalgetika erfolgen, die gegen neuropathische Schmerzen wirksam sind, z. B. trizyklische Antidepressiva und/oder Antikonvulsiva (Tabelle 3).
Der Nachweis neuropathischer Schmerzen bei älteren Patienten mit initialem Zoster lässt nach Meinung des Autors den initialen Einsatz von Opioiden bei Patienten mit starken Schmerzen sinnvoll erscheinen ohne vorherigen Einsatz antiphlogistischer oder antipyretischer Analgetika.
Prävention durch Impfung
Alle Studien belegen, dass selbst eine frühzeitige Behandlung mit wirksamen Virostatika die Entwicklung chronischer Schmerzen nicht ganz verhindern kann. 20 % der über 50-jährigen Patienten hatten in einer Studie sechs Monate nach Auftreten des Zosters noch Schmerzen, obwohl sie adäquat behandelt wurden [10]. Auch die Kombination von Virostatika, Analgetika und Koanalgetika kann postzosterische Neuralgien nicht vollständig verhindern.
Die suboptimale Wirksamkeit der heute verfügbaren Zostertherapie ist damit zu erklären, dass Virostatika zu spät eingesetzt werden. Während der frühen Virusreplikation über circa drei bis sieben Tage machen uncharakteristische Prodromalsymptome und Hautveränderungen die Diagnose unmöglich. Die spezifische Therapie kann daher erst relativ spät beginnen.
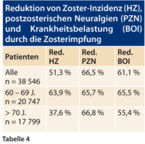
Eine weitere Möglichkeit, dem Zoster und seinen Komplikationen vorzubeugen, ist eine Stimulation und Stärkung spezifischer zellulärer Immunabwehrmechanismen [2]. Dies ist in einer großen klinischen Studie (Shingles Prevention Study) in den USA untersucht worden [16]. Bei 38 546 immunkompetenten Menschen, die älter als 60 Jahre waren, wurde eine Zostervakzine randomisiert und doppelblind gegen Plazebo getestet. Es kam zu 642 gesicherten Zostererkrankungen in der Plazebo- und 315 in der Impfstoffgruppe, was einer Reduktion der Zosterinzidenz um 51 % entspricht und hochsignifikant (p < 0,001) ist. Die Krankheitsbelastung, d. h. Schwere und Dauer der zosterassoziierten Schmerzen und anderer Beschwerden, wurde durch die Impfung signifikant um 61,1 % reduziert (P < 0,001). Ein weiterer Endpunkt war die Häufigkeit der postzosterischen Neuralgien. Diese entwickelten sich bei 80 Patienten, die Plazebo erhielten und 27 Patienten, die Impfstoff erhielten. Dies entspricht einer Risikoreduktion um 66,5 % (p < 0,001).
Bei der Untersuchung der Impfstoffwirksamkeit in der Untergruppe der 60- bis 69-Jährigen wurde die Zosterhäufigkeit sehr viel deutlicher vermindert (63,9 %), während sie bei den über 70-Jährigen nur um circa 37,6 % abnahm. Krankheitsbelastung und Risiko einer postzosterischen Neuralgie wurden über alle Altersgruppen vergleichbar reduziert (Tabelle 4).
Die Verträglichkeit des Impfstoffes unterschied sich nicht von der des Plazebos. Nur lokale Reaktionen traten häufiger auf (48 % versus 17 %).
Die Nachbeobachtung einer Untergruppe der Shingle Prevention Study (n = 14 270) ergab einen anhaltenden Impfschutz von bis zu sieben Jahren [18]. Weitere Nachbeobachtungen über mindestens zehn Jahre nach Impfung sind noch nicht abgeschlossen.
Die Zostervakzine wurde 2006 von der FDA für den Gebrauch in den USA für den Einsatz bei immunkompetenten Personen, die 60 Jahre oder älter sind, zugelassen. Da es sich um einen Lebendimpfstoff handelt, darf er bei immunsupprimierten Personen keine Anwendung finden. Eine exakte Definition dieser Personengruppe steht noch aus. Die oben genannten Virostatika sollten 24 h vor und 14 Tage nach der Impfung nicht eingenommen werden. Eine simultane Gabe mit inaktivierter Vakzine, zum Beispiel Influenzavakzine, ist möglich [14, 18] Auch für Europa wird in einer Stellungnahme der Vakzinearbeitsgruppe der Europäischen Union zur Zosterimpfung geraten [15].
Neue Studien belegen, dass die Immunogenität und Sicherheit des Impfstoffes bei Erwachsenen, die 50 - 59 Jahre alt sind, und solchen, die über 59 Jahre alt sind, identisch sind [19]. Der in den USA verfügbare Impfstoff ist tiefgefroren, was seine Lagerung erschwert. Eine Studie belegt mittlerweile, dass ein Impfstoff, der im Kühlschrank aufbewahrt werden kann, über die gleiche Immunogenität verfügt [8]. Um eine akzeptable Lagerzeit im Kühlschrank zu gewährleisten, muss dieser Impfstoff höhere Viruskonzentrationen enthalten. In einer Multicenterstudie wurden daher die Sicherheit und Verträglichkeit eines Zosterimpfstoffes, der ca. 58 000 PFU VZV enthielt, mit einem Impfstoff der ca. 207 000 PFU enthielt, verglichen. Geimpft wurden Patienten, die zwischen 50 und 90 Jahre alt waren. Beide Impfstoffe wurden generell gut vertragen,wobei lokale Reaktionen bei dem hochpotenten Impfstoff häufiger auftraten. Diese lokalen Reaktionen wurden als klinisch akzeptabel eingestuft [20].
Unter dem Warenzeichen Zostavax® wurde dieser Impfstoff von der europäischen Zulassungsbehörde (EMEA) für Personen ab dem 50. Lebensjahr zur Prävention von Zoster und postzosterischer Neuralgie zugelassen [6]. Nach seiner Markteinführung in Deutschland wird die Ständige Impfkommission (STIKO) über eine öffentliche Impfempfehlung entscheiden.

Erschienen in: Der Allgemeinarzt, 2010; 32 (1) Seite 18-21