Helicobacter pylori ist mit verschiedenen Magenerkrankungen wie chronischer Gastritis, Ulcus ventriculi und duodeni, Magenkarzinom sowie mit dem MALT-Lymphom des Magens assoziiert. Die H.-pylori-Prävalenz hat auch in Deutschland kontinuierlich abgenommen und beträgt aktuell etwa 20 % bei den nach 1980 Geborenen. Aufgrund der verminderten H.-pylori-Prävalenz werden in der deutschen S3-Leitlinie zwei Testverfahren für eine sichere Diagnose gefordert. Für die Wahl des Therapieregimes ist die Kenntnis der lokalen Antibiotikaresistenzen entscheidend, wobei die Clarithromycinempfindlichkeit eine Schlüsselrolle spielt. Gegenwärtig ist die Clarithromycin-Tripeltherapie noch Standard, zusätzlich stellt die Bismut-Quadrupeltherapie eine wichtige neue Therapieoption dar.
Helicobacter pylori ist ein gramnegatives Stäbchenbakterium, mit dem fast die Hälfte der Weltbevölkerung infiziert ist und das mit gastroduodenalen Erkrankungen wie peptischen Ulzera, Magenkarzinom und MALT-Lymphom kausal assoziiert ist [1].
Verbreitung
Weltweit haben epidemiologische Studien einen kontinuierlichen Abfall der Prävalenz der Infektion mit H. pylori gezeigt. Auch in Deutschland hat die H.-pylori-Prävalenz seit 1980 kontinuierlich abgenommen. In einer aktuellen Studie aus Sachsen-Anhalt beträgt die Seroprävalenz von H. pylori 44 %. Es zeigte sich eine signifikante Abnahme bei nach 1980 geborenen Personen mit einer Prävalenz von etwa 20 % [2]. In einer Querschnittstudie aus dem Saarland wurde bei gesunden Personen zwischen dem 50. und 74. Lebensjahr eine Prävalenz von 50,8 % gefunden [3]. In einer aktuellen prospektiven Kohortenstudie aus Amerika (NHANES III) wurde der Einfluss von H. pylori auf die Mortalität untersucht. Hierbei zeigte sich zwar ein 41-fach erhöhtes Mortalitätsrisiko für ein Magenkarzinom, aber H. pylori hatte keinen Einfluss auf die Gesamtmortalität [4].
Leitlinien
Für die tägliche Praxis stehen zum Thema H. pylori zwei evidenzbasierte Leitlinien zur Verfügung:
- die deutsche S3-Leitlinie von 2009 unter Federführung der Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten (DGVS). Es ist geplant, diese 2014 zu aktualisieren.
- die Europäische Leitlinie (Maastricht IV) von 2012 unter Federführung der European Helicobacter Study Group [5].
Diagnostik
Für die Diagnose einer H.-pylori-Infektion sind invasive Verfahren, die eine Endoskopie erfordern (kulturelle Anzüchtung, Histologie, Urease-Schnelltest), und nicht invasive Verfahren (Stuhlantigentest, Harnstoff-Atemtest) von praktischer Bedeutung. In der Regel wird im Rahmen einer Endoskopie die Kombination aus Urease-Schnelltest und Histologie mit Versilberungstechnik (Warthin Starry) zur sicheren Diagnose eingesetzt. Die in der europäischen Leitlinie empfohlene Test-and-Treat-Strategie (Einsatz eines nicht invasiven Tests bei dyspeptischen Beschwerden ohne Endoskopie und probatorische Behandlung bei positivem Testergebnis) wird in der deutschen Leitlinie abgelehnt. Die Kultur mit Antibiogramm spielt eine besondere Rolle bei Therapieversagen und bei Kindern. Für eine exakte Diagnostik ist es wichtig, dass PPIs möglichst zwei Wochen und Antibiotika vier Wochen vor der Endoskopie abgesetzt werden. Eine Erfolgskontrolle sollte ebenfalls frühestens vier Wochen nach beendeter Eradikationstherapie erfolgen.
Therapie
Tabelle 1 gibt eine Übersicht über die Empfehlungsgrade für eine H.-pylori-Eradikationstherapie bei verschiedenen Indikationen, basierend auf der deutschen und der europäischen S3-Leitlinie. Alle H.-pylori-positiven gastroduodenalen Ulzera (DU/GU) sollen behandelt werden, ebenso jedes MALT-Lymphom. Für die funktionelle Dyspepsie wird ebenfalls ein hoher Empfehlungsgrad angegeben, hier beträgt die Number Needed to Treat (NNT) 15. Weitere Indikationen sind Magenkrebsprophylaxe bei Risikopersonen, die idiopathische thrombozytopenische Purpura (ITP), Eisenmangelanämie nach vorheriger vollständiger endoskopischer Abklärung, Vitamin-B12-Mangel und die seltenen Krankheiten M. Ménétrier und lymphozytäre Gastritis.
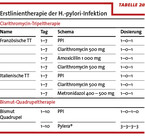
Entscheidend für die Wahl des Therapieregimes ist die Kenntnis der Resistenzverhältnisse für die wichtigsten Antibiotika (Clarithromycin, Metronidazol, Levofloxacin). Für Deutschland werden diese Daten vom Nationalen Referenzzentrum für H. pylori an der Uniklinik Freiburg erhoben und zur Verfügung gestellt [6]. Aktuell zeigt sich eine primäre Resistenz für Clarithromycin von 12 %, für Metronidazol von 37 % und für Levofloxacin von 12 %. Bis zu einer Resistenzschwelle von 15 % kann eine Clarithromycin-basierte Tripeltherapie als kalkulierte Erstlinientherapie eingesetzt werden (Tabelle 2a). Als neue Therapieoption steht seit Januar 2013 die Bismut-basierte Quadrupeltherapie in Deutschland zur Verfügung [7], welche in der europäischen Zulassungsstudie der Clarithromycin-Tripeltherapie überlegen war.
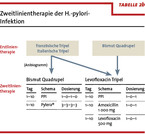
Wenn eine Erstlinientherapie versagt und aus klinischen Gründen keine Verlaufsgastroskopie indiziert ist, kann eine kalkulierte Zweitlinientherapie durchgeführt werden (Tabelle 2b). Falls eine Gastroskopie durchgeführt wird, sollte eine H.-pylori-Kultur mit Antibiogramm erfolgen. Als Zweitlinientherapie ist nach erfolgloser Clarithromycin-basierter Tripeltherapie eine Bismut-Quadrupeltherapie oder eine Levofloxacin-Tripeltherapie möglich. Bei erfolgloser Bismut-Quadrupel-Ersttherapie steht die Levofloxacin-Tripeltherapie als Zweitlinien-Therapie zur Verfügung. Spätestens nach erfolgloser Zweitlinientherapie ist die Durchführung einer Endoskopie mit kultureller Anzüchtung und Antibiogramm zwingend erforderlich. Die Drittlinientherapie sollte dann Antibiogramm-gesteuert erfolgen. Gegen Amoxicillin gibt es praktisch keine Resistenzentwicklungen, so dass dieses Antibiotikum in allen Therapielinien eingesetzt werden kann. Rifabutin steht als Reserve-Antibiotikum zur Verfügung, da die primäre Antibiotikaresistenz gegen H. pylori unter 1 % liegt. Auch eine zweiwöchige duale Hochdosistherapie mit Amoxicillin und PPI ist als Rescue-Therapie möglich.
Nachkontrolle
Die Überprüfung des Erfolges einer Eradikationstherapie sollte erst vier Wochen nach Therapieende erfolgen. Wenn aus klinischen Gründen keine Endoskopie-Indikation besteht, können auch nicht-invasive Tests (Atemtest, Stuhltest) verwendet werden.
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2014; 36 (18) Seite 18-20