Bei Lungenerkrankungen ergibt es keinen Sinn, zwischen kausaler und rein symptomatischer Therapie eine zeitlich determinierte Grenze zu ziehen. Vielmehr werden kausale Therapiemöglichkeiten in der Regel sukzessive durch rein symptomorientierte Behandlungen ergänzt. Erst nach Jahren einer kombinierten Behandlung verzichtet man am Ende des Lebens auf die kausalen Therapien. Am Beispiel der COPD wird im Folgenden erläutert, wie die Kombination verschiedener Maßnahmen im Verlauf aussehen kann.
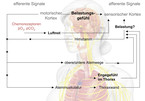
Atemnot ist eines der wichtigsten und nicht selten für die Betroffenen eines der beunruhigendsten Symptome in der Medizin und in aller Regel mit erheblichen Angstgefühlen verbunden [1]. Abb. 1 zeigt die Komplexität der involvierten Afferenzen und Efferenzen und macht die unterschiedlichen Dyspnoeursachen verständlich.
Ein akut ruhedyspnoischer Patient ist eine absolute Notfallsituation und meistens auch für das behandelnde Team belastend; die chronische Dyspnoe hingegen ist im ersten Moment etwas weniger dramatisch, für den Patienten aber trotzdem quälend und beunruhigend, und sie schränkt die Lebensqualität erheblich ein.
In der medizinischen Begrifflichkeit ist Atemnot respektive Dyspnoe ein relativ klar definiertes Symptom, in Diskrepanz dazu haben viele Patientinnen und Patienten Mühe, die Dyspnoe adäquat zu beschreiben. Oft sprechen sie von "schwerer Brust", was dem anglosächsischen Begriff "chest tightness" entsprechen dürfte, oder von "angestrengtem oder schnellem Atmen" usw. In mehreren Arbeiten [2, 3] wurde versucht, die subjektive Dyspnoeempfindung den einzelnen Dyspnoeursachen zuzuordnen, was aber nur partiell gelingt und eine rein anamnestische Diagnose unmöglich macht.
Ein wesentliches Charakteristikum der Dyspnoediagnostik ist die notwendige Korrelation der subjektiven Empfindung zur körperlichen Belastung: Eine Ruhedyspnoe ist in jedem Fall ein medizinischer Notfall, während eine gleichartige Intensität von Atemnot bei einem hochaktiven Sportler absolut dem Normalzustand entspricht. Daher ist eine vertiefte Befragung nach der Intensität der Dyspnoe selbst sowie der Intensität der Belastung notwendig; auch auslösende emotionale Stressoren dürfen nicht vergessen werden und können manchmal wegweisend sein.
Ist Dyspnoe messbar?
Dyspnoe ist ein rein subjektives Symptom und kann letzten Endes nicht im klassischen Sinne gemessen werden. Trotzdem haben sich verschiedene Messinstrumente bewährt, die die subjektive Intensität der Dyspnoeempfindung zum Beispiel aufgrund einer analogen visuellen Skala oder anderer anamnestischer Messinstrumente ermitteln (verschiedene Typen von Borg-Skala [4], mMRC-Skala [5] usw.). Oft sind entsprechende Fragen auch in die routinemäßig eingesetzten validierten Fragen zur respiratorischen Lebensqualität integriert (z. B. CRQ: chronic respiratory questionnaire [6]).
Nur zum Teil korreliert das subjektive Dyspnoeempfinden mit lungenfunktionellen Veränderungen [7]. Der Grad der Belastung bei der Atemnot ist im Weiteren entscheidend für die Einstufung einer Organerkrankung (z. B. NYHA [8] bei Herzinsuffizienz oder mMRC [3] bei Lungenerkrankungen).
Für den Alltag noch wesentlich hilfreicher, verbindlicher und für die individuelle weitere Verlaufsbeurteilung nutzbarer ist die präzise Schilderung der Dyspnoeschwelle (z. B. Dyspnoe nach acht Treppenstufen usw.).
Differenzialdiagnose der chronischen Dyspnoe
Aus der Auflistung in Tabelle 1 folgt, dass differenzialdiagnostisch nach dem Ausschluss einer Anämie oder Lungenembolie in erster Linie nach Pneumopathien, Kardiopathien und Erkrankungen der pulmonal-arteriellen Strombahn gefahndet werden sollte, neuromuskuläre Dyspnoeursachen sind selten, dürfen aber nicht vergessen werden. Speziell zu erwähnen ist die manchmal nicht einfach zu diagnostizierende psychogene Dyspnoe, die oft, aber nicht immer mit Hyperventilation vergesellschaftet ist.
Die verfügbaren diagnostischen Tests bei chronischer Dyspnoe sind zahlreich. Es geht in erster Linie darum, aufgrund einer guten klinischen Beurteilung und unter Berücksichtigung der "Vortest-Wahrscheinlichkeit" die verfügbaren Tests gezielt einzusetzen und so auch den Aufklärungsaufwand zu begrenzen. Die wichtigsten diagnostischen Untersuchungen im klinischen Alltag dürften die Spirometrie/Plethysmografie, die unspezifische Bronchoprovokationstestung und das Belastungs-EKG sowie die transthorakale Echokardiografie sein. Bei Verdacht auf rezidivierende Lungenembolien steht bei einem positiven D-Dimer-Test die Bildgebung in erster Linie mit Computertomografie oder in speziellen Fällen mit Lungenszintigrafie im Vordergrund. Vor allem bei unklaren Dyspnoesituationen ist die oft weiterführende Untersuchung die Spiroergometrie [9], die es nicht nur erlaubt, die Dyspnoe zu quantifizieren, sondern auch eine gute Abschätzung der Prognose ermöglicht und den pathophysiologischen Mechanismus der Dyspnoe häufig aufdeckt (ventilatorische Einschränkung, Gasaustauschstörung, Störungen der Atempumpe, kardiale und pulmonal vaskuläre Einschränkungen, Dekonditionierung, psychogene Hyperventilation).
Im Gesamtkontext darf nicht außer Acht gelassen werden, dass gerade ältere und polymorbide Patienten nicht selten mehrere Erkrankungen und damit mehrere Dyspnoeursachen haben und die Behandlung nur bei Therapie aller Ursachen zum Ziel führen kann.
Therapeutische Grundsätze
Auch bei fortgeschrittener Erkrankung ist prinzipiell die zugrunde liegende Störung das Ziel der Behandlung, was in der Regel zur Abnahme der Dyspnoe führen wird. Trotzdem dürfen wir nicht vergessen, das für die Patienten quälende Zielsymptom Atemnot parallel zum pathophysiologisch orientierten Ansatz adäquat symptomatisch zu behandeln und neben der korrekten Behandlung der Grundkrankheit auch eine rechtzeitige und situationsangemessene Dyspnoetherapie einzuleiten.
In der Vergangenheit wurden bei wissenschaftlichen Arbeiten, zum Beispiel bei COPD, vorwiegend lungenfunktionelle Werte als Endpunkte gewählt. In den letzten Jahren ist es zum Standard geworden, dass zum Beispiel die respiratorische Lebensqualität und die Symptome des Patienten und damit insbesondere die Dyspnoe ein wesentlicher Endpunkt bei der Evaluation neuer therapeutischer Ansätze sein müssen.
Behandlungsoptionen am Beispiel der COPD
Es gibt viele Therapieansätze, um die Dyspnoe von COPD-Patienten zu senken und parallel dazu die Anstrengungstoleranz zu erhöhen [10, 11]. Sowohl die kurzwirksamen als auch die langwirksamen Bronchodilatatoren, seien es Betamimetika oder Anticholinergika, sind in der Lage, dies zu erreichen. Diese klinischen Effekte stehen auf den ersten Blick im Kontrast zur Tatsache, dass bei einem Broncholysetest häufig kein Anstieg des FEV1 gesehen werden kann. Dass der Patient trotzdem eine Verbesserung der Dyspnoe verspürt, ist durch den Rückgang der pulmonalen Überblähung und im Speziellen auch der dynamischen Überblähung bei Anstrengung zu erklären. Ein völlig anderer Therapieansatz ist zum Beispiel die Sauerstoffheimtherapie [12] bei chronischer Hypoxämie, mit entsprechender Erhöhung der Dosis unter körperlicher Anstrengung. Meistens wird aber trotz Normalisierung der Sauerstoffspannung die Dyspnoe nur partiell besser, da die anderen pathophysiologischen Mechanismen (muskuläre Überdehnung, Überblähung usw.) trotzdem noch vorhanden sind. Diese Tatsache ist für Patienten oft schwer verständlich, weil sie nicht selten Atemnot und Sauerstoffmangel gleichsetzen.
In den letzten 10 bis 15 Jahren hat sich auch die Methode der Volumenreduktion [13] als Standardmethode etabliert, die klassischerweise chirurgisch-thorakoskopisch durchgeführt wird, seit einigen Jahren aber auch mit bronchologischen Interventionen erreichbar ist. In beiden Fällen kommt es zu einer Verkleinerung der statischen Lungenvolumina infolge Rückgangs der Überblähung, zu einem Anstieg des Einsekundenvolumens, zu einem Rückgang der pulmonalen Überblähung und zu einer Relaxation des übermäßig kontrahierten, flachen Zwerchfells; die zentralen Effekte sind aber die Verbesserung der Atemnot und die Zunahme der Belastbarkeit.
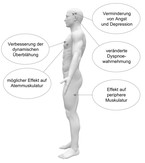
Eine besondere Bedeutung im Behandlungskonzept der COPD hat die pulmonale Rehabilitation [14, 15], die per se an der Funktionsstörung der Lunge nichts ändert, durch ihren Effekt auf die periphere und im geringeren Maße die Atemmuskulatur aber zu einer deutlichen Abnahme der Dyspnoe und zu einer Steigerung der Leistungsfähigkeit führt. Die dabei eingesetzte multimodale medizinische Trainingstherapie [16] im Gesamtkontext eines umfassenden Therapieansatzes mit Patientenschulung, Erlernen der Relaxationstechnik, Optimierung der Ernährung, Verbesserung der Krankheitsbewältigung usw. führt in der Regel zu einer Verbesserung der Anstrengungstoleranz und der Dyspnoe, welche oft die medikamentösen Interventionen im Effekt übersteigt (Abb. 2).
Symptomatische Behandlung
Sedierende Substanzen, Anxiolytika und Opiate haben das Potenzial, neben den psychotropen Effekten die Ventilation und damit die Atemarbeit zu senken, und können theoretisch gefährliche Hypoventilationen mit bedrohlichen Hyperkapnien verursachen. Diese Tatsache ist den Medizinern seit dem Studium bestens bekannt und führt nicht selten dazu, dass aus Angst vor unerwünschten schwerwiegenden Nebenwirkungen auf den Einsatz dieser Substanzen bei Lungenpatienten zu lange verzichtet wird. Immer dann, wenn mit den oben erwähnten Methoden die Dyspnoe der Lungenpatienten nicht befriedigend behandelt werden kann, dürfen und sollen sie gezielt zum Einsatz kommen, und es ist dann durchaus adäquat, hier einen gewissen Anstieg der pCO2-Spannung in Kauf zu nehmen (permissive Hyperkapnie) und so die Atemarbeit und den Stress für den Patienten zu mindern.
Eine COPD läuft nicht selten über mehrere Jahre, und es ist das klare Ziel, neben den kausal orientierten Behandlungen auch diese rein symptomorientierten Therapieansätze adäquat anzuwenden [17]. Die Dosen sollen an die klinische Symptomatik angepasst und keinesfalls schematisch festgelegt werden, da die Dosis-Wirkungs-Kurve individuell sehr unterschiedlich sein kann.
Wichtig ist bei häufigen Dyspnoephasen ein zeitgerechter Wechsel auf Langzeitpräparate unter Belassung von Reservedosen von rasch wirksamen Opiaten sowie das frühzeitige Angehen einer als Nebenwirkung der Opiate auftretenden Obstipation. Ziel ist es in jedem Fall, ähnlich wie beim Schmerzmanagement, Dyspnoephasen zu verhindern. Speziell bei zusätzlichen Angstgefühlen kann die anxiolytische Therapie eine gute Alternative oder Ergänzung sein.
Stellenwert des palliativen Ansatzes
Im Verlauf wird es in der Regel so sein, dass die kausalen Therapiemöglichkeiten sukzessive durch rein symptomorientierte Behandlungen ergänzt werden und erst nach Jahren einer kombinierten Behandlung in einer Schlussphase auf die kausalen Therapien verzichtet wird. Unter diesem Aspekt ist es zum Beispiel auch sinnvoll, eine anders nicht beherrschbare schwere und limitierende Anstrengungsatemnot parallel zu den Therapien mit Opiaten zu behandeln (Abb. 3).
Nicht-medikamentöse Maßnahmen
Bei obstruktiven Lungenerkrankungen kann der Patient durch ein "pursed lips breathing" die Dyspnoe lindern, indem der Kollaps der Atemwege in der Exspiration behindert wird. Viele Patienten beherrschen diese Technik durch frühere Atemtherapien [18]. Bei einigen Patienten kann eine relevante Verbesserung durch eine nicht-invasive Ventilation erreicht werden, wenn sie zum Beispiel wegen anhaltender schwerer Globalinsuffizienz bereits früher adaptiert wurden [19, 20].
In der Terminalphase werden häufig zum Teil laute Rasselgeräusche festgestellt, die durch liegendes Sekret in den oberen Luftwegen bedingt sind. Dieser Befund wird von der Umgebung oft als Atemnot fehlinterpretiert. Nicht selten wird dann vom Pflegepersonal abgesaugt, was hinterfragt werden soll: Auch beim gut sedierten Patienten kann dies zu einer Weck- und Stressreaktion führen. Wichtig ist hier die Information der Angehörigen über diese Zusammenhänge.
Sonderfall Sauerstoff
Die Sauerstofflangzeittherapie hat einerseits das Potenzial, die Prognose zum Beispiel von hypoxämischen COPD-Patienten relevant zu verbessern, andererseits ist sie aber in vielen Fällen eine hervorragende symptomatische Behandlung. Sie wird klassischerweise aufgrund klarer Indikationskriterien eingesetzt [11] und setzt eine chronifizierte, länger dauernde und anders nicht behebbare Hypoxämie voraus. Dank der modernen tragbaren Sauerstoffspender ist es auch möglich, den Patienten bei körperlicher Belastung die adäquate Sauerstoffdosis zuzuführen.
Nachdem bei dieser Indikation der Stellenwert unbestritten ist, stellt sich die Frage, ob Patienten, vor allem in der palliativen Phase ihrer Lungenkrankheit, auch bei fehlendem Nachweis einer Hypoxämie Sauerstoff erhalten sollen. Dies entspricht eigentlich einem klassischen Reflex des palliativen Ansatzes, der aber hinterfragt werden sollte. Aufgrund der Datenlage scheint es in der palliativen Phase nicht sinnvoll zu sein, Sauerstoff ohne bestehende Hypoxämie von Belang zu applizieren, umso mehr, als zum Beispiel die rasche Einleitung in der heimischen Umgebung eventuell schwer zu organisieren ist [21, 22].
Zeitpunkt des palliativen Ansatzes
Aus oben genannten Gründen fällt es dem oft eher akut medizinisch-rehabilitativ orientierten Behandlungsteam nicht immer leicht, vom kurativen Therapieansatz zu einem palliativen zu wechseln. Wie bereits erwähnt, ist gerade bei Lungenpatienten aber die Kombination der verschiedenen Ansätze sinnvoll. Es ist wichtig, dies im Verlauf der Behandlung rechtzeitig sowohl im Team als auch im Gespräch mit den Patientinnen, Patienten und ihren Angehörigen zu thematisieren [17].
Dyspnoe und Sterbephase
Aus meiner Erfahrung wird das Thema der Endphase von Lungenpatienten nicht selten tabuisiert und die implizite Angst vor dem Ersticken wird nicht spezifisch angesprochen. Es kann sinnvoll sein, dieses Thema proaktiv anzusprechen, um dem Patienten aufzuzeigen, dass dank der oben genannten palliativen Möglichkeiten ein Sterben in Würde ohne quälende Erstickungs- und Angstgefühle möglich ist. Das Wissen der Patienten, dass sie in ihrer terminalen Phase mit einem verständnisvollen und kompetenten palliativen Management durch ihr behandelndes Team rechnen dürfen, kann ihnen helfen, ihre schwere und oft letztlich tödlich verlaufende Krankheit über Jahre besser zu tragen.
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2016; 38 (18) Seite 42-49