Leishmaniose gehört zu den Tropenerkrankungen, sie ist jedoch auch im Mittelmeerraum endemisch. Infizierte Reiserückkehrer, Migranten und Geflüchtete stellen in Deutschland hohe Herausforderungen an den klinisch tätigen Arzt. Da sich Patienten meist zunächst beim niedergelassenen Hausarzt vorstellen, sollte dieser die typischen Symptome und Verläufe kennen.
Leishmaniose wird von der Weltgesundheitsorganisation (WHO) zu den 20 vernachlässigten Tropenerkrankungen gezählt [1], deren Bekämpfung im Nachhaltigen Entwicklungsziel 3.3 festgehalten ist [2].
Welche Formen gibt es und wie wird Leishmaniose übertragen?
Leishmanien sind Protozoen, die verschiedene Erkrankungen auslösen:- Kutane Leishmaniose (CL) durch Leishmania (L.) tropica, L. major, L. aethiopica, L. infantum ("Alte Welt": Europa, arabischer Raum, Afrika) sowie durch L. mexicana, L. brasiliensis, L. panamensis ("Neue Welt": Mittel-/Südamerika)
- Mukokutane Leishmaniose (MCL) durch L. brasiliensis, L. panamensis, L. guyanensis
- Viszerale Leishmaniose (VL) oder "Kala-Azar" durch L. donovani (Ostafrika, Indien), L. infantum/chagasii (Lateinamerika, Mittelmeerraum) [3].
Die Übertragung erfolgt durch den Biss nachtaktiver weiblicher Sandmücken (Phlebotomen). Reservoir sind Nager, Hunde und der Mensch. Der durch die Blutmahlzeit aufgenommene Parasit reift im Vektor zur infektiösen Form, die bei der nächsten Mahlzeit abgegeben wird. Konnatale Infektionen und Infektionen durch Transfusionen sind selten [3, 4].
Wo kommt Leishmaniose vor?
Leishmaniose ist sehr häufig: Man geht von weltweit jährlich 700.000 – 1.200.000 Fällen CL und 200.000 – 400.000 Fällen VL, davon 20.000 – 40.000 Todesfällen aus [5]. Traditionell gilt Leishmaniose als "tropische" Erkrankung, da sie besonders in Afrika, Lateinamerika, Vorder- und Süd-Asien vorkommt [5]. In der Hälfte aller europäischen Länder, besonders im Mittelmeerraum, sind jedoch L. infantum und L. tropica ebenfalls endemisch [6, 7]. Zwei Spezies der Sandmücke wurden auch in Deutschland nachgewiesen; zusammen mit Klimaveränderungen und der Einfuhr von Hunden aus Südeuropa bietet dies die Möglichkeit der autochthonen Übertragung, welche bisher nur durch wenige Einzelfallberichte unterstützt scheint [8 – 11]. Das Risiko, an Leishmaniose zu erkranken, ist bei HIV-Infektion mindestens 100-fach gesteigert [7]. Auch Reaktivierungen treten unter Immunsuppression auf.
Die Surveillance Importierter Infektionen in Deutschland (SIPMID) dokumentierte zwischen 2001 und 2004 23 Fälle von CL, drei von MCL und 16 von VL, meist aus der Mittelmeerregion importiert [12]. Durch das Tropeninstitut der Charité Berlin wurden für Deutschland 2017 zehn Fälle von CL und zwei Fälle von VL erfasst, ebenso sämtlich importiert [13]. Die Erkrankung ist jedoch nicht meldepflichtig, die WHO geht von dramatischen Unterschätzungen aus [7].
Welche Symptome sind typisch?
Die Inkubationszeit beträgt Wochen bis mehrere Monate, im Extremfall Jahre [3, 4].
Kutane & mukokutane Leishmaniose
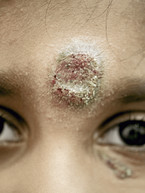
Die CL beginnt mit einer kleinen blauroten Papel, meist an der unbedeckten Haut, die sich ausbreitet und nach drei bis vier Monaten in ein mehrere Zentimeter messendes, schmerzloses Ulkus mit Randwall übergeht, das krustig bedeckt sein kann und nach bis zu zwei Jahren unter Narbenbildung und Pigmentstörungen abheilt (Abbildung). Multilokale Infektionen sind möglich. Bei Superinfektionen kommt es zu Schmerzen und Eiterbildung [3, 4].
In 2 – 5% der Fälle entwickelt sich eine MCL mit ulzerösem Schleimhautbefall besonders des Nasenrachenraums und ausgedehnter Destruktion sowie nachfolgender Unterernährung und Sekundärinfektionen. Die MCL kann bis zu zehn Jahre nach Primärinfektion auftreten [14].
Merke: Bei "schlecht heilendem Stich" nach Reisen an kutane Leishmaniose denken!
Viszerale Leishmaniose
Das klinische Bild besteht aus plötzlich oder schleichend beginnendem Fieber, Hepatosplenomegalie, Lymphadenopathie, später Gewichtsabnahme und schwärzlich-brauner Haut ("Kala-Azar"). Laborchemisch fallen Anämie, Leukozytopenie und Thrombozytopenie, ggf. Panzytopenie auf. Damit steigt das Risiko für Blutungen, bakterielle Diarrhö und Pneumonie [3,4]. Bei Kindern sind besonders Kleinkinder betroffen. Die Letalität beträgt unbehandelt 95%; asymptomatische Träger sind in Endemiegebieten jedoch häufig [3]. Bei Teilimmunität kann das Bild subakut, bei HIV atypisch verlaufen.
Merke: Bei unklarem Fieber, Hepatosplenomegalie und Panzytopenie an viszerale Leishmaniose denken!
Wie wird Leishmaniose diagnostiziert?
Lange Latenz und geringe Erregerzahlen erschweren die Diagnostik. Anzustreben ist immer der Nachweis von Leishmanien-DNS sowie die Differenzierung der Spezies [14,15].
Kutane & mukokutane Leishmaniose
Bei zurückliegender Reise in ein Endemiegebiet (Monate bis Jahre) mit nach vier Wochen nicht-heilender Haut-/Schleimhautläsion Basisdiagnostik durchführen:- Gewebeentnahme per Biopsie: Stanze vom Läsionsrand für parasitologische und der-matohistologische Untersuchungen
- Weitere Methoden: "Skin scaping", "Slit skin smear" und Aspirat
Methoden zum Erregernachweis sind Mikroskopie, Polymerase-Kettenreaktion (PCR) mit Sequenzierung und Kultur. Die PCR ist aktueller Goldstandard. Am besten sind mehrere Methoden von verschiedenen Proben zu kombinieren. Bei bestätigter Infektion, besonders bei systemischen Krankheitszeichen, sollte eine viszerale Disseminierung ausgeschlossen werden [14].
Serologische Untersuchungen sind bei einer einzelnen Läsion der "Alten Welt" nicht sinnvoll, bei langem Verlauf einer Infektion der "Neuen Welt" zu erwägen. Gelingt der Erregernach-weis nicht, sollte bei Verdacht an eine tropenmedizinische Ambulanz überwiesen werden.
Viszerale Leishmaniose
Bei zurückliegender Reise in ein Endemiegebiet (Monate bis Jahre) und Fieber mit Hepatosplenomegalie, neuer Hyperpigmentierung, Zytopenie, unklarer Ferritinerhöhung, Hyper-gammaglobulinämie oder unklarem Hämophagozytose-Syndrom sowie bei HIV-Patienten mit unklarem Krankheitsbild Basisdiagnostik durchführen:- PCR aus peripherem Blut, Knochenmark, Lymphknoten, Leber oder Milz
- Mikroskopie aus Knochenmark, Lymphknoten, Leber oder Milz
- Serologie nur ergänzend, Kultur ist verzichtbar [15]
- Sonographie Abdomen
- Röntgen-Thorax (Abklärung Tuberkulose)
- HIV-Test, Basis-Labor inklusive BSG (beschleunigt) [3].
Merke: Immer Speziesdifferenzierung anstreben, PCR ist Goldstandard!
Die Differenzialdiagnosen der CL und VL sind in Tabelle 1 zusammengefasst.
Wie wird Leishmaniose therapiert?
Kutane & mukokutane Leishmaniose
Die Behandlung basiert auf der Speziesdifferenzierung, dem Endemiegebiet und individuellen Risikofaktoren. Die Speziesdifferenzierung sollte abgewartet werden.
Es wird nach "einfachen" und "komplexen" Läsionen unterschieden: Als "komplex" gelten >3 Läsionen, Größe >4cm, Lokalisation an Gesicht, Händen, Gelenken oder Schleimhautgrenze, Lymphangitis/-adenitis oder Satellitenläsionen, therapierefraktäre Läsionen und solche bei Immunsuppression [3,14]. Komplexe Läsionen, Rezidive und MCL sind systemisch zu behandeln. Bakterielle Infektionen sollten zuerst behandelt werden.
Therapieoptionen für einfache Läsionen [14]:- Abwarten (L. major, L. mexicana)
- Lokal pentavalentes Antimonat (Natriumstibogluconat, Meglumin-Antimonat), ggf. + Kryotherapie (L. major, L. tropica, L. infantum, L. mexicana)
- Lokal Paromomycin 15%/Methylbenzethoniumchlorid 12% (L. major, L. mexicana)
- Lokal Thermotherapie (L. major, L. tropica, L. mexicana)
Therapieoptionen für komplexe Läsionen sind je nach Erreger Miltefosin, Fluconazol, Ketoconazol bzw. Itraconazol p.o. oder Antimonat i.v./i.m., evtl. in Kombination mit Pentoxifyllin bzw. Allopurinol oder Pentamidin-Diisethionat i.v./i.m. Dabei sind jeweils mögliche Nebenwirkungen zu beachten (vgl. Tabelle 2) [14].
Läsionen durch L. infantum und L. aethiopica sollte man zum Ausschluss einer Disseminierung, zur Abklärung einer Immunsuppression bzw. wegen fehlender Therapiestandards immer an eine tropenmedizinische Einrichtung überweisen. Nach Therapiebeginn sollte keine chirurgische Manipulation stattfinden (Gefahr der Reaktivierung). Die Patienten sind über Reaktivierung, Rezidive, mukokutane Ausbreitung, Möglichkeit der systemischen Therapie und Verlaufskontrollen aufzuklären. Schwangere und Kinder sollten möglichst lokal behandelt werden und Immunsupprimierte primär systemisch [14].
Für die MCL gelten liposomales Amphotericin B i.v. und Antimonat i.v. + Pentoxifyllin p.o. als gleichwertig. Oft ist eine chirurgische Intervention notwendig.
Merke: Die Therapie der CL richtet sich nach der speziesabhängigen Selbstheilungsrate, Rezidivhäufigkeit und der Gefahr eines mukokutanen Verlaufs. Bei Lokaltherapie ist auf eine ausreichende Tiefe bzw. periläsionale Infiltration zu achten.
Viszerale Leishmaniose
Erste Wahl ist liposomales Amphotericin B i.v. (auch in der Schwangerschaft), Miltefosin p.o. gilt als zweite Wahl. Liposomales Amphotericin B macht die stationäre Behandlung notwendig, Miltefosin sollte stationär begonnen und kann ambulant vervollständigt werden. Weitere Therapeutika (Tabelle 2) kommen in Deutschland besonders zur Rezidivprophylaxe bei Immunsuppression zum Einsatz. Für Dosierungen und Abbruchkriterien wird auf die Leitlinie der AWMF verwiesen [15].
Supportiv sind ausreichende Hydrierung, Ernährung, die Behandlung zusätzlicher Infektionen sowie ggf. die Komplettierung des Impfstatus wichtig. Eine Nachsorge ist für bis zu zwei Jahre notwendig [3].
Wie kann vorgebeugt werden?
Nach durchgemachter Erkrankung besteht lebenslange Immunität. Bisher befinden sich Kandidaten für eine Impfung jedoch noch in Entwicklung. Zur Prävention ist der Expositionsschutz (Repellentien, lange Kleidung) entscheidend.
Im globalen Kontext sind Vektorkontrolle, Insektizid-behandelte Bettnetze sowie die Kontrolle des Tierreservoirs vonnöten, um die Übertragung zu durchbrechen. Leider ist der Zugang zu Medikamenten dort am schwierigsten, wo die Krankheitslast am höchsten und die Menschen am ärmsten sind. Der fehlende profitable Markt erklärt das unzureichende Interesse an der Entwicklung und Verbreitung neuer (Kombinations-)Therapeutika, welche eine einfachere Anwendung, kürzere Behandlungsdauer, höhere Heilungsraten, höhere Sicherheit und weniger Resistenzen ermöglichen sollten.
- Leishmaniose ist auch im Mittelmeerraum endemisch.
- Bei chronischen Hautläsionen und unklarem Fieber an Leishmaniose denken, auch lange nach Aufenthalt in Endemiegebieten.
- Basisdiagnostik bereits in der hausärztlichen Praxis initiieren.
- VL, MCL und komplexe CL erfordern eine systemische Therapie, die stationär begonnen werden sollte.
- Bei Immunsuppression, Nachweis von L. infantum oder L. aethiopica sowie bei unklaren Fällen an Spezialambulanzen überweisen.
Die Autorin dankt Dr. med. A. Montag für die Bereitstellung des Bildmaterials sowie Dr. med. C. Adamczick für kritische Anmerkungen zum Text.
Interessenkonflikte: Die Autorin hat keine deklariert
Erschienen in: Der Allgemeinarzt, 2019; 41 (11) Seite 46-49