Durch neue Erkenntnisse in der Krebstherapie muss auch das Kolonkarzinom heute viel differenzierter gemanagt werden. Vor allem für die Systemtherapie ist die Zahl der Behandlungsoptionen – aufgrund neuer Chemo-, Kombinations- und Antikörpertherapien – rasant gestiegen. Ähnlich sieht es bei den heute sehr viel komplexeren, operativen Verfahren aus. Eine große Herausforderung beim Dickdarmkrebs bleibt die ambulante Betreuung der betroffenen Patienten.
Das Lebenszeitrisiko für Darmkrebs beträgt bei Männer 7,0 % und bei Frauen 5,7 %. Durch die Vorsorgekoloskopie sinkt dieses Risiko in Deutschland seit zehn Jahren ab. Dies gilt aber nur für linksseitige Kolon- und Rektumkarzinome, die in der Regel aus koloskopisch gut sichtbaren Polypen entstehen (klassische Adenom-Karzinom-Sequenz). Anders sieht es bei Karzinomen im rechtsseitigen Kolon aus, für die bislang kein wesentlicher Rückgang erreicht werden konnte. Eine Ursache dürfte in der häufig andersartigen Karzinomentstehung über flache, schlecht sichtbare Adenome mit einer rascheren malignen Transformation liegen (sessil serratierte Adenome). Auch sind familiär bedingte Kolonkarzinome bei Lynch-Syndrom (circa 10 % aller Kolonkarzinome) meist im rechten Dickdarm lokalisiert. Diese unterliegen einer rascheren malignen Transformation und treten häufig auch vor dem 50. Lebensjahr auf. Die Vorsorgekoloskopie ab dem 55. Lebensjahr (Männer – wenn möglich– ab dem 50.) ist die wichtigste Maßnahme zur weiteren Reduktion des kolorektalen Karzinoms. Ein Test auf okkultes Blut ersetzt die Darmspiegelung nicht [16].
Diagnostik
Der histologische Nachweis des Karzinoms vor der Therapie ist obligat. Die dafür geforderten Parameter werden allerdings immer umfangreicher (von der Infiltrationstiefe bei Frühkarzinomen über Perineuralscheideninfiltration bis zu den molekularen Markern MMR bzw. MSI, BRAF, KRAS). Für das Staging des Kolonkarzinoms ist die Abgrenzung vom Rektumkarzinom essenziell. Entscheidend hierfür: die Höhe des Tumors – Kolonkarzinome sind alle oberhalb von 16 cm. Für Kolonkarzinome muss nach den Leitlinien noch eine Abdomensonographie (optional mit Kontrastmittel), ein Röntgen-Thorax und ein CEA-Spiegel gemacht werden [16]. Für eine differenzierte Therapie und die Wahl der Op. ist dies jedoch nicht mehr ausreichend. Eine CT erhöht die diagnostische Genauigkeit für die Detektion von Lebermetastasen [7]. Zudem kann man damit den Tumor präoperativ meist eindeutig lokalisieren und die Gefäßanatomie darstellen, was beim laparoskopischen Vorgehen extrem hilfreich ist. Unabdingbar bei kleinen Tumoren ist die Markierung der Tumorlokalisation durch eine koloskopische Tuscheinjektion [5]. Die meisten Kliniken werden heute eine möglichst frühzeitige Vorstellung des Patienten während des Stagingprozesses empfehlen, um spezifische Untersuchungen besser planen zu können.
Therapie
Die Therapieoptionen des Kolonkarzinoms lassen sich in fünf Kategorien einteilen (vgl. Kasuistik):
Koloskopische Therapie
Meist handelt es sich hier um abgetragene Polypen, in denen sich schon ein Karzinom entwickelt hat. Dieses muss histologisch komplett abgetragen sein und eine "Low-Risk"-Histologie vorliegen [16]. Durch neue Techniken der lokalen Abtragung (z. B. endoskopische Submukosadissektion, ESD) wird sich der Anteil für diese Therapieoption sicher weiter erhöhen. Cave: Bei ausgedehnten endoskopischen Abtragungen kann es nach Tagen noch zu einer Perforation mit Peritonitis kommen.
Onkologische Resektion
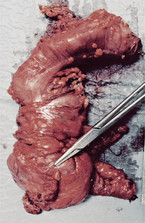
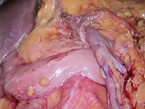
Mit dieser Option werden lokal resektable Tumoren ohne Fernmetastasen behandelt. Die Art der Operation ist gegenwärtig in intensiver Diskussion: 2009 wurde das Konzept der Complete mesocolic excision (CME) publiziert [10]. Dieser Eingriff ist zumindest für rechtsseitige Kolonkarzinome sehr viel komplexer als die Standardhemikolektomie (Abb. 2 und 3). Die bisherigen Daten legen nahe, dass dadurch eine Verbesserung des Fünf-Jahresüberlebens von etwa 10 % erzielt werden kann [4]. Allerdings steht das Ergebnis der weltweit einzigen prospektiven Studie noch aus [3]. Eine weitere Frage ist, ob der Eingriff in offener oder in laparoskopischer Technik durchgeführt werden sollte. Die Datenlage dafür ist relativ klar: Bei adäquater Expertise ist die laparoskopische Operation mit einem geringeren Risiko und einer schnelleren Rekonvaleszenz bei gleichem Langzeitergebnis verbunden [2, 18]. Dies gilt insbesondere für ältere und komorbide Patienten [15]. Damit muss derzeit die Kombination von CME und Laparoskopie als die beste Option angesehen werden. Im Stadium III (positive Lymphknoten im Op.-Präparat) ist eine adjuvante Chemotherapie über sechs Monate indiziert. Der Effekt auf das Fünf-Jahresüberleben liegt bei etwa plus 20 % [8, 19]. Im Stadium II ist dies fakultativ [16]. In Deutschland erreicht man mit diesem Vorgehen derzeit für die Stadien I, II und III Fünf-Jahresüberlebensraten von 83,0 %, 76,4 % und 67,0 % [1].
Für die ambulante Nachbehandlung ist die körperliche Aktivität des Patienten das wichtigste Therapieziel. Eine formale Schonung oder eine Restriktion der Belastung (z. B. Heben von Lasten< 10 kg) sind obsolet. Sinnvoll ist eine Vorgabe für die tägliche Belastung, z. B. ein Spaziergang, der in Intervallen von drei bis sieben Tagen erweitert werden kann. Postoperative Wundschmerzen sollten mit Metamizol oder Paracetamol (Patienten unter ASS) behandelt werden. NSAR sind wegen der negativen Wirkung auf die Anastomosenheilung ungünstig [9]. Bei Durchfällen nach Rechtshemikolektomie sollte an eine chologene Diarrhoe gedacht werden, die mit Colestyramin behandelbar ist.
Multimodale Therapie in kurativer Intention
Eine begrenzte (Oligo-) Metastasierung kann häufig noch kurativ behandelt werden. Eine Limitation auf solitäre Metastasen oder solche in einem Organsystem gilt dabei nicht mehr. Entscheidend ist vielmehr, ob sämtliche Tumorlokalisationen primär oder nach einer Chemotherapie reseziert werden können.
Statt einer operativen Entfernung können auch lokal destruierende Verfahren wie Mikrowellenablation oder stereotaktische Bestrahlungen eingesetzt werden. Bei einer limitierten Peritonealkarzinose kann der Arzt eine chirurgische Entfernung der Metastasen und eine intraoperative Chemoperfusion (HIPEC) erwägen [20]. Die Prognose hängt natürlich vom Ausmaß der Metastasierung ab und liegt bei isolierter Lebermetastasierung um die 50 % beim Fünf-Jahresüberleben [6]. Bei Metastasierung in mehr als ein Organsystem werden aber immerhin noch 28 % erreicht [11]. Patienten in einer oligometastasierten Situation müssen regelmäßig, besonders nach gutem Ansprechen auf eine Chemotherapie, in einer interdisziplinären Konferenz besprochen werden, um mögliche kurative Therapieansätze zu evaluieren.
Palliative Therapie
Die palliative Therapie beim Kolonkarzinom beschränkt sich nicht ausschließlich auf Symp-tomkontrolle. Mit den neuen Chemo- bzw. Immuntherapien kann eine substanzielle Verlängerung des Patientenüberlebens erreicht werden. Das mediane Überleben hat sich zwischenzeitlich bei optimalem Management von acht auf aktuell 30 Monate verlängert [12]. Patienten mit über zehnjährigen Verläufen sind keine Seltenheit. Entscheidend ist die richtige Weichenstellung am Anfang. So ist z. B. zu klären, ob zunächst eine palliative Tumoroperation zur Verhinderung eines Ileus durchgeführt werden muss. Dabei zeichnet sich die Tendenz ab, zuerst eine Chemotherapie einzuleiten, um diese nicht durch chirurgische Komplikationen zu gefährden. Zudem scheint es auch in der Palliativsituation prognostisch günstig zu sein, Lebermetastasen zu resezieren oder zu abladieren [17]. Die Systemtherapie ist inzwischen sehr komplex geworden. Sie setzt sich in der Regel aus einer Kombination von 5-Fluoruracil/Folinsäure bzw. Capecitabin mit Oxaliplatin oder Irinotecan zusammen. Hinzu kommen häufig – je nach Mutationsstatus im RAS-Gen – Antikörper gegen EGRF (Cetuximab, Panitumumab) oder VEGF (Bevacizumab, Ramucirumab, Aflibercept). Neu ist die Kombination von Trifluridin und Tipiracil [14]. Für Patienten mit einem Lynch-Syndrom bzw. Mikrosatelliteninstabilität scheint eine Immunmodulation mit Checkpoint-Inhibitoren (PD-1-Blocker) wie Nivolumab und Pembrolizumab sehr erfolgversprechend [13].
Best supportive Care
Neben einer suffizienten Schmerztherapie kann bei einer malignen intestinalen Obstruktion die Anlage einer Ablauf-PEG oder/und eine heimparenterale Ernährung sinnvoll sein, um die Lebensqualität zu verbessern. In die Weiterversorgung nach der Klinik sollten Kooperationspartner wie SAPV, Palliativstationen oder Hospize einbezogen werden. In der Regel sollten dies die Sozialdienste und die Überleitungspflege der Kliniken in die Wege leiten.
Nachsorge
Eine strukturierte Nachsorge ist für das Kolonkarzinom in den Stadien II und III empfohlen (Stadium I nur optional) [16]: in den ersten zwei Jahren halbjährlich und danach – bis zum fünften Jahr – jährlich. Neben der Evaluation sind Sonographie, CEA-Spiegel und Röntgen-Thorax-Aufnahme gefordert. Eine Koloskopie sollte nach einem Jahr und nach fünf Jahren erfolgen. Die Kontrollen im Stadium IV legt der behandelnde Onkologe individuell fest.
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2017; 39 (20) Seite 18-22