Kann man das eigene Immunsystem als Waffe gegen Krebs nutzen? Man kann. Die sogenannten Checkpoint-Inhibitoren stehen als neue Therapieoption im Sinne einer Immuntherapie bereits u. a. für das Melanom, den nicht kleinzelligen Lungenkrebs, einige urologische Tumoren und M. Hodgkin zur Verfügung. Auch bei gastrointestinalen Tumoren konnten diese Substanzen in neueren Studien erstaunliche Erfolge verbuchen, sodass mit einer baldigen Zulassung auch in dieser Indikation zu rechnen ist.
Checkpoint-Moleküle sind funktionelle Schlüssel des Immunsystems. Hemmende Immun-Checkpoints werden auch Co-Inhibitoren genannt und sind für die Selbsttoleranz unverzichtbar. Hemmt man diese Inhibitoren pharmakologisch, ist das, als würde man im Körper eine Bremse lösen, damit das Immunsystem in Fahrt kommt. Präklinische Ergebnisse zur Funktion von Immun-Checkpoints und die Beobachtung tumorinfiltrierender Lymphozyten (TIL) führten dazu, dass Antikörper gegen diese Checkpoints entwickelt und zugelassen wurden. Die derzeit in ihrer klinischen Wirksamkeit am besten untersuchten Checkpoint-Moleküle – unter vielen weiteren – sind CTLA-4, PD-1 und PD-L1. Eine wegweisende Studie zeigte bei metastasierten, vorbehandelten Melanompatienten einen deutlichen Überlebensvorteil mit dem CTLA-4-Antikörper Ipilimumab (Yervoy®) gegenüber der Kontrollgruppe [1]. Es folgten Zulassungsstudien zu PD-1-Antikörpern, die eine enorme Effektivität beim malignen Melanom (MM) zeigten und Ein-Jahres-Überlebensraten bei metastasierten, zuvor unbehandelten Patienten von über 70 % erzielten [2]. Aktuell ist von der europäischen Arzneimittelbehörde EMA kein Checkpoint-Inhibitor für die Therapie gastrointestinaler Karzinome zugelassen. Die am weitesten entwickelten – Ipilimumab, Nivolumab und Pembrolizumab – bei GI-Tumoren befinden sich noch in Phase II-/III-Studien. Sind die Ergebnisse erfolgversprechend, ist mit einer Zulassung für GI-Tumoren in naher Zukunft zu rechnen.
Kolorektales Karzinom
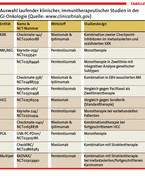
Guinney et al. definierten 2015 anhand molekularer Eigenschaften vier konsensuelle Subtypen des kolorektalen Karzinoms (KRK). Die erste Subgruppe zeichnet sich durch eine hohe Immuninfiltration aus und zeigt molekular eine hohe Mikrosatelliteninstabilität (MSI-H) [3]. Zu dieser Gruppe gehören etwa 14 % der KRK-Patienten. Eine Mikrosatelliteninstabilität (MSI) ist auf defekte Mismatch-Repair-Systeme (dMMR) zurückzuführen, also auf fehlerhafte DNA-Reparaturmechanismen. Folge dieser dMMR ist eine stark erhöhte Mutationsrate, was ein vermehrtes Auftreten sog. Neo-Antigene zur Folge hat, die vom Immunsystem erkannt werden und in eine starke Immuninfiltration münden [5, 6]. Folgerichtig wurden in einer Phase-II-Studie mit Pembrolizumab metastasierte dMMR-KRK-Patienten mit MMR-intakten KRK-Patienten verglichen. Nach einer Therapie über 20 Wochen mit 14-tägigen Infusionsintervallen hatte die Interventionsgruppe der dMMR-Patienten ein progressionsfreies Überleben (PFS) von 78 % gegenüber einem PFS von 11 % in der Kontrollgruppe [6]. Vorläufige Ergebnisse einer Phase-II-Studie mit Nivolumab als Monotherapie und einer Kombination von Nivolumab mit Ipilimumab, bei der ebenfalls vorbehandelte metastasierte Patienten mit und ohne MSI eingeschlossen wurden, zeigten ein objektives Ansprechen nach definierten Kriterien (RECIST) von 27 % bzw. 15 % [6]. Diese ersten Ergebnisse werden derzeit in mehreren Phase-III-Studien evaluiert (Tabelle). Bisherige Untersuchungen weisen darauf hin, dass die Wirksamkeit der Therapie mit der Präsenz von Neo-Antigenen zusammenhängt, für die MSI-H ein Surrogatmarker ist [7].
Magen- und Adenokarzinom des Gastro-ösophagealen Übergangs (AEG /Ösophaguskarzinom
Auch beim Magenkarzinom (MK) gibt es eine Subgruppe mit hoher MSI (je nach Literatur 8 – 16 %), die meist vom intestinalen Typ ist. Ähnlich wie im KRK ist dies ein günstiger prognostischer Faktor bei frühem Tumorstadium [8, 9]. Ösophaguskarzinome zeigten sich größtenteils mikrosatellitenstabil bzw. gering verändert [10]. In einer Teilstudie der Keynote-012-Studie (Phase Ib mit Pembrolizumab) waren 39 Patienten mit PD-L1-positiven Tumoren eingeschlossen, von denen 36 ausgewertet wurden. Acht Patienten (22 %, 95 % KI 10 – 39) zeigten nach objektiven Kriterien ein teilweises Ansprechen [11]. In einer Teilstudie der Checkmate-032-Studie (Phase I), die den PD-1-Antikörper Nivolumab als Monotherapie bei MK und Adenokarzinom des gastroösophagealen Übergangs (AEG) untersuchte, sprachen 12 % [12] in dMMR-Tumoren unabhängig vom PD-L1-Status darauf an. Somit zeichnet sich, wie beim KRK, ein Zusammenhang des Therapieerfolgs mit dem MSI-Status ab.
Hepatozelluläres (HCC) und cholangiozelluläres Karzinom
Im HCC zeigte sich ein positiver Zusammenhang bei der Anzahl tumorattackierender Lymphozyten mit dem Gesamtüberleben bzw. der Rezidivwahrscheinlichkeit nach primärer Resektion [13, 14]. Phase I-/II-Studien mit Nivolumab brachten ebenfalls erste vielversprechende Ergebnisse [15, 16], sodass auch hier mittlerweile eine Phase-III-Studie läuft, die Nivolumab gegen die bisherige Standardtherapie des fortgeschrittenen HCC (Sorafenib) testet (Tabelle). Auch der zweite zugelassene PD-1-Antikörper Pembrolizumab befindet sich aktuell in Phase-III-Studien (Keynote-224, Keynote-240). Für CTLA-4-Inhibitoren laufen zudem Untersuchungen in Kombination mit lokal-ablativen Verfahren, wobei hier die Ansprechrate mit 23,5 % angegeben wird [17]. Wie bei anderen GI-Tumoren scheint beim HCC nur ein Teil der Patienten zu profitieren; die molekularen Hintergründe sind noch unklar. Zum cholangiozellulären Karzinom (CCC) als alleinige Indikation ließen sich keine immuntherapeutischen klinischen Studien finden.
Pankreaskarzinom (PCA)
Im PCA gibt es ebenfalls positive Hinweise von tumorinfiltrierenden Lymphozyten und dem Überleben [18] sowie ein ausgeprägtes immunsuppressives Mikromilieu [19]. Während eine Monotherapie mit Ipilimumab beim lokal fortgeschrittenen oder metastasierten PCA erfolglos blieb [20], ging in einer Studie, in der Ipilimumab mit einer Vakzinierung gegen Tumorzellen verbunden wurde, bei sieben von 15 Patienten der Tumormarker CA19-9 zurück und bei drei von 15 zeigte sich ein stabiler Verlauf über viele Wochen [21]. Insgesamt liegen für das PCA weniger klinische Ergebnisse vor als z. B. für KRK oder MK. Auch hier laufen weitere klinische Studien.
Mögliche Nebenwirkungen
Auf der Hand liegen heute immunassoziierte, autoimmun-ähnliche Nebenwirkungen von Checkpoint-Inhibitoren. Phase-I-/II-Studien zu den die Signalwege hemmenden Molekülen des PD-1-/PD-L1-Systems zeigten hohe Nebenwirkungsraten bis über 60 % [6, 22, 23]. Schwerwiegende (Grad 3 – 4 nach CTC) therapieassoziierte Nebenwirkungen traten in 9 – 20 % auf. CTLA-4-Inhibitoren zeigten in einer Phase-III-Studie sogar immunassoziierte Nebenwirkungen von bis zu 80 %, wovon 22,9 % schwerwiegend waren [1]. Hier lagen jeweils gastrointestinale Beschwerden wie Diarrhoe oder Übelkeit bzw. Erbrechen mit über 30 % vorne, gefolgt von Hauterscheinungen wie Rush, Pruritus, Vitiligo und anderen (kombiniert ebenfalls über 30 %). Zudem kam es zu Pneumonitiden, rheumatischen Krankheitsbildern von Arthralgien bis Sicca-Syndrom, Endokrinopathien wie Hypothyreoidismus, Neuropathien und Hepatitiden.
Bei Grad 3 – 4 der Nebenwirkungen handelte es sich mit einer Häufigkeit von 9 bis 18 % meist ebenfalls um gastrointestinale Symptome wie Diarrhoe und Kolitis [24]. Insgesamt scheint es unter PD-1-/PD-L1-Antikörpern weniger schwerwiegende Nebenwirkungen als bei CTLA-4-Antikörpern zu geben. Erfahrungen beim MM zeigen, dass die meisten Nebenwirkungen mit Kortikosteroiden beherrschbar sind und nach einigen Wochen abklingen [25]. Leichtere Nebenwirkungen (Grad 1 – 2) können eventuell toleriert werden, ggf. muss man die Therapie unterbrechen und topische Steroide geben. Grad 3 – 4 der Nebenwirkungen müssen stationär überwacht werden. Hier ist eine Unterbrechung oder der Abbruch zwingend, ebenso eine immunsuppressive Therapie. Auch allgemeine Nebenwirkungen wie Zytopenien, Fatigue, Hyponatriämie oder Hypoalbuminämie treten auf.
Fazit
Für das KRK und MK zeichnet sich der MSI-Status als Prädiktor dafür ab, ob die Therapie anspricht. Umgekehrt bedeutet dies: Die Patienten müssen auf entsprechende molekulare Veränderungen kontrolliert werden. Eine Untersuchung auf MSI kann aus Tumorbiopsien entweder PCR-basiert oder immunhistochemisch erfolgen. Bei Ansprechen ist von einer lebenslangen Therapie auszugehen.
Der Fokus neuer Studien wird auf Kombinationstherapien liegen, die gängige Radiochemotherapien mit Methoden der Immuntherapien (nicht nur Checkpoint-Inhibition) oder Immuntherapien untereinander kombinieren, z. B. die Kombination von PD-L1- und CTLA-4- Inhibitoren (Tabelle). Die stark immunogene Wirkung einer hochdosierten Strahlentherapie ist hier von zentralem Interesse, da durch einen induzierten massiven Tumorzerfall viele tumorassoziierte Neo-Antigene mit immunogenisierender Wirkung freigesetzt werden [26, 27]. Eine Kombination von einer Strahlen- mit einer Immuntherapie war experimentell schon erfolgreich [28], was zu mehreren sich anschließenden klinischen Studien geführt hat (Tabelle).
Interessenkonflikte: NH und ME werden für die Durchführung von klinischen Studien von BMS unterstützt.
Erschienen in: Der Allgemeinarzt, 2017; 39 (11) Seite 44-46