Eine Infektion mit dem Magenkeim Helicobacter pylori ist häufig und kann Folgeerkrankungen wie Magen- und Duodenalulzera oder ein Magenkarzinom nach sich ziehen. Bei der Wahl der Erstlinientherapie sollte man vor allem die Risikofaktoren für eine Clarithromycinresistenz berücksichtigen. Ist diese wahrscheinlich, wäre die Standard-Tripeltherapie über sieben Tage keine gute Option.
Helicobacter pylori (H. pylori) ist ein Bakterium, das meist in der frühen Kindheit innerhalb der Familie erworben wird, die Magenschleimhaut besiedelt und eine chronisch-aktive Gastritis induziert. Auf diesem Boden können sich Symptome und Folgeerkrankungen entwickeln. Hierzu rechnet man: die Ulkuskrankheit (Ulcera ventriculi und duodeni), das MALT (Mucosa-associated lymphoid tissue)-Lymphom, das Magenkarzinom, die Dyspepsie (Reizmagen) und einige extragastrale Erkrankungen wie die Idiopathische Thrombozytopenische Purpura (ITP). Die aktuelle deutsche Leitlinie von 2016 hat die Indikationen für eine H. pylori-Eradikation zusammengefasst [1]. Sie bedient sich dabei der üblichen Leitlinien-Terminologie: "Soll" bedeutet eine starke Empfehlung, "Sollte" eine Empfehlung und "Kann" eine offene Empfehlung (Tabelle 1).
H. pylori-Eradikation: Voraussetzungen und Therapie
Eine H. pylori-Eradikation setzt eine bestehende Indikation (Tabelle 1) und den Nachweis der Infektion voraus. Dieser kann durch den histologischen Nachweis von H. pylori und einer chronisch-aktiven Gastritis erfolgen, wobei dies eine Gastroskopie mit Biopsien erfordert. Alternativ sind nicht-invasive Verfahren wie der 13C-Harnstoff-Atemtest und der Stuhlantigennachweis verfügbar, die sich im Verlauf auch zur Kontrolle des Eradikationserfolgs anbieten.
Die erste deutsche Leitlinie von 2009 empfahl zur Erstlinientherapie eine siebentägige Therapie mit einem Protonenpumpeninhibitor sowie Clarithromycin plus Metronidazol ("Italienische Tripeltherapie") oder Amoxicillin ("Französische Tripeltherapie") [2]. Eine 2015 publizierte Netzwerkanalyse zeigte hingegen, dass diese beiden Standard-Tripeltherapien über sieben Tage nur eine Eradikationsrate von 73 % erreichen [3]. Dies liegt eindeutig unter der in der deutschen Leitlinie geforderten Erfolgsrate von 80 % [1]. Eine Verlängerung der Therapie-dauer auf 10 – 14 Tage und eine Vierfachtherapie erfüllen hingegen dieses Qualitätskriterium ausnahmslos.
Eine wesentliche Ursache für das Versagen der Standard-Tripeltherapie ist das Vorliegen einer primären Clarithromycinresistenz, die in Europa nach einer Erhebung aus den Jahren 2008 – 2009 zwischen 6 % und 37 % schwankt [4]. In Deutschland lag sie damals bei 6,9 %. Zwischenzeitlich gibt es neuere Daten zur Resistenzentwicklung. Eine aktuelle Erhebung des deutschen ResiNet-Netzwerks an 1.851 Proben therapienaiver Patienten mit H. pylori ergab eine primäre Resistenzrate für Clarithromycin von 11,3 %, wobei im Beobachtungszeitraum von 2015 – 2018 keine Steigerung zu verzeichnen war [5]. Bemerkenswert ist ferner ein Anstieg der primären Resistenzrate gegenüber Levofloxacin auf aktuell 13,4 %. Dies lässt Auswirkungen auf die Zweitlinientherapie erwarten. Die Resistenzrate gegenüber Tetrazyklin ist mit 2,5 % sehr niedrig.
Für eine aktualisierte Therapieempfehlung ist eine weitere Netzwerkanalyse zu beachten, die auch getrennt Regionen mit hoher (> 15 %) und niedriger (< 15 %) Clarithromycinresistenz untersuchte [6]. Setzt man die siebentägige Standard-Tripeltherapie als Kontrolle, so hat eine 14-tägige Sequenztherapie eine fast vierfach und eine zehntägige Bismuth-basierte Quadrupeltherapie eine 2,6-fach höhere Wirksamkeit.
Aktuelle Therapieempfehlung
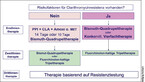
Abhängig von der Wahrscheinlichkeit einer Clarithromycinresistenz wird in der aktuellen deutschen Leitlinie ein Therapiealgorithmus gemäß Abb. 1 empfohlen. Initiales Entscheidungskriterium ist die Wahrscheinlichkeit für eine primäre Clarithromycinresistenz. Sie wird bei Patienten aus Süd- und Osteuropa sowie bei früherer Makrolidbehandlung als hoch eingeschätzt. Für sie sollte die Tripeltherapie nicht mehr zur Anwendung kommen. In dieser Situation empfiehlt sich eine Bismuth-Quadrupeltherapie. Diese wird auch bei niedriger Clarithromycinresistenz, die auf die deutschstämmige Bevölkerung nach wie vor zutrifft, als Option in der Erstlinientherapie angesehen. Alternativ steht für dieses Patientenkollektiv unverändert die französische oder die italienische Tripeltherapie zur Verfügung, sofern keine Penicillinallergie vorliegt. Allerdings kann man eine siebentägige Therapie nicht mehr guten Gewissens vertreten.
Entscheidet man sich für die Tripeltherapie, sollte man sie über 14 Tage geben. Eine Fluorchinolon-haltige Tripeltherapie erscheint nicht zuletzt wegen der mit 13,4 % hohen Resistenzrate gegenüber Levofloxacin problematisch. Künftig wird man möglicherweise eine Resistenztestung fordern.
Begleitende Maßnahmen
Welche Begleitmaßnahmen können den Eradikationserfolg positiv beeinflussen? Wichtig sind die sorgfältige Aufklärung des Patienten über die Einnahme der Medikamente und die Motivation zur Therapietreue. Es empfiehlt sich, die Arzneimittel vor den Mahlzeiten einzunehmen. Probiotika können indirekt die Erfolgsaussichten der Eradikation erhöhen, indem sie Nebenwirkungen der Antibiotika abmildern und dadurch die Therapieadhärenz positiv unterstützen [7]. Rauchende Patienten sollte man zum Rauchstopp motivieren.
Nach der Eradikationsbehandlung
Eine Kontrolle des Eradikationserfolgs wird unabhängig von der Indikation zur Behandlung explizit und unter Berücksichtigung der Mindestzeitabstände (zwei Wochen nach Absetzen des PPI, vier Wochen nach Ende einer Antibiotikaeinnahme) empfohlen. Danach ist bei dokumentiertem Eradikationserfolg eine routinemäßige Suche nach einer H. pylori-Reinfektion nicht erforderlich.
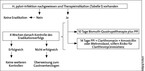
Abb. 2 zeigt einen Vorschlag für strukturiertes Vorgehen in der Praxis unter Berücksichtigung der möglichen Therapieoptionen.
Interessenkonflikte: Der Autor hat keine deklariert
Erschienen in: Der Allgemeinarzt, 2020; 42 (19) Seite 20-22