Die diabetische Neuropathie ist eine häufige Komplikation bei Diabetes mellitus. Dem Hausarzt fällt bei der Früherkennung der Nervenfunktionsstörung, die bei vielen Diabetes-Patienten bereits frühzeitig auftritt, eine Schlüsselrolle zu. Da viele Patienten nur subtile Symptome wie eine verminderte Reizwahrnehmung in den Extremitäten haben, sollten Diabetes-Patienten regelmäßig auf Neuropathien gescreent werden. Neben der peripheren Neuropathie, die an der Ätiologie des diabetischen Fußsyndroms beteiligt ist, gibt es eine autonome diabetische Neuropathie mit einer Vielzahl von Organmanifestationen, z. B. im kardiovaskulären System oder Gastrointestinaltrakt.
- im Bereich des vegetativen Nervensystems, das z. B. Herz, Gefäße, Magen-Darm-Trakt, Blase und Geschlechtsorgane steuert (autonome Neuropathie), oder
- im Bereich der Nerven, die sensorische oder motorische Aufgaben erfüllen (periphere sensomotorische diabetische Neuropathie). Die häufigste Form ist hier die distale sensomotorische Polyneuropathie (DSPN), die etwa drei Viertel aller diabetischen Neuropathien ausmacht und die sich in der Regel symmetrisch in den Extremitäten (vor allem Füße, seltener Hände) ausbreitet [2].
Früh- und Spätsymptome
Typische Symptome der DSPN sind Gefühlsstörungen in Füßen und Zehen (strumpfförmig) oder Händen (handschuhförmig), wie Ameisenlaufen oder Kribbeln, Minderwahrnehmung von sensiblen Reizen, z. B. Vibrations-, Druck- und Temperaturempfindung (von den Patienten lange Zeit nicht bemerkt!), Reflexabschwächung und motorische Symptome wie leichte Lähmungen und Muskelkrämpfe. In fortgeschritteneren Stadien leiden viele Patienten unter neuropathischen (als brennend empfundenen) Schmerzen oder Schmerzüberempfindlichkeit (Allodynie), z. B. bei einfacher Berührung, die oft mit Schlafstörungen verbunden sind.
Je länger ein Diabetes mellitus besteht und je schlechter die Blutzuckereinstellung ist, desto höher ist das Risiko für eine diabetische Neuropathie. Zu den weiteren Risikofaktoren zählen Komorbiditäten wie Hypertonie und pAVK, Alkohol- und Nikotinabusus sowie mangelnde körperliche Aktivität [1]. Bei der diabetischen Neuropathie handelt es sich um eine Ausschlussdiagnose. Andere, meist behandelbare Ursachen einer Neuropathie müssen zuvor ausgeschlossen werden, z. B. toxische Polyneuropathien (Alkoholabusus, Medikamente u. a. Zytostatika, Amiodaron, Metronidazol, Phenytoin), Mangel-Neuropathien (Vitamine B12, B1, B6, Resorptionsstörungen), Neuroborreliose, Urämie, maligne Tumoren (vor allem kleinzelliges Bronchialkarzinom) oder erbliche Neuropathien. Nicht selten liegt auch eine gemischte Pathogenese vor. In einer retrospektiven Studie bei 103 Diabetikern mit DSPN wurden bei mehr als der Hälfte zusätzliche Neuropathie-Ursachen gefunden [3]. Neben monoklonaler Gammopathie, neurotoxischer Medikation, Alkoholmissbrauch, Vitamin-B12-Mangel, Nieren- oder chronischen Darmerkrankungen ist auch ein Vitamin-B1-Mangel bei Diabetikern häufig [3, 9].
Die diabetische Neuropathie galt lange Zeit als Spätkomplikation eines Diabetes. Aber die axonale Degeneration beginnt bereits im präklinischen Stadium, vor allem bei den "small-fiber"-Neuropathien, und schreitet im weiteren Verlauf fort. Bei vielen Typ-2-Diabetikern kann bereits zum Zeitpunkt der Diabetesdiagnose eine sensomotorische diabetische Neuropathie in der Peripherie nachgewiesen werden. In einer Studie ergaben sich sogar bei fast jeder vierten älteren Person mit Prädiabetes (61 – 82 Jahre alt) Hinweise für eine DSPN [4]. Den meisten von ihnen war nicht bekannt, dass sie eine Nervenfunktionsstörung hatten.
Früh screenen!
Bis zu 50 % der diabetischen peripheren Neuropathien können asymptomatisch verlaufen und werden gar nicht oder erst sehr spät erkannt. Viele Patienten mit DSPN haben auch eine subklinische Neuropathie, bei der lediglich quantitative neurophysiologische Tests, z. B. die Druck-, Temperatur- und Vibrationsempfindung, pathologisch sind. Daraus ergibt sich die Notwendigkeit eines frühzeitigen Screenings. Denn durch eine frühzeitige Therapie kann der Verlauf der Neuropathie gebessert und das erhöhte Risiko für ein diabetisches Fußsyndrom verringert werden.
Ebenso wichtig ist die Früherkennung einer autonomen diabetischen Neuropathie, die nicht nur mit einer eingeschränkten Lebensqualität, sondern auch mit einer reduzierten Lebenserwartung einhergeht. Bei Diabetikern mit kardiovaskulärer autonomer diabetischer Neuropathie (KAND) – Kennzeichen u. a. Ruhetachykardie, reduzierte Herzfrequenzvariabilität, orthostatische Hypotonie – ist das Sterberisiko im Vergleich zu Patienten ohne KAND im Verlauf von bis zu 15 Jahren um den Faktor 3,5 erhöht [1].
Ein Screening auf eine sensomotorische und/oder autonome diabetische Neuropathie wird in der Nationalen Versorgungsleitlinie "Neuropathie bei Diabetes im Erwachsenenalter" [5, wird derzeit überarbeitet] sowie von der Deutschen Diabetes-Gesellschaft [1] bei Patienten mit Typ-2-Diabetes zum Zeitpunkt der Diabetesdiagnose und bei Patienten mit Typ-1-Diabetes spätestens fünf Jahre nach Diagnosestellung empfohlen. Insbesondere zur Früherkennung der DSPN gibt es einfache neurologische Untersuchungsmethoden, die auch in der Allgemeinarztpraxis vorgenommen werden können (Tabelle 1) [1]. Diese Tests sollten immer beidseits und seitenvergleichend vorgenommen werden. Eine weiterführende Untersuchung wird bei symptomatischen Patienten, vor allem bei unklaren Schmerzen oder anderen neuropathischen Symptomen, und allen Patienten mit pathologischen Testergebnissen bzw. auffälligen anamnestischen Befunden in der Screening-Untersuchung (Druck- und Berührungsempfindung mit 10-g-Monofilament, Vibrationsempfindung mit 128-Hz-Stimmgabel, Achillessehnenreflex) empfohlen [1, 5]. Subjektive Symptome einer sensomotorischen Neuropathie werden klinisch mit dem Neuropathie-Symptom-Score (NSS) und der Schweregrad sensibler Defizite mit dem Neuropathie-Defizit-Score (NDS) erfasst. Als Minimalkriterien für die Diagnose gelten:
- mäßig ausgeprägte neurologische Defizite (NDS 6–8 Punkte) mit oder ohne Beschwerden oder
- leichte neurologische Defizite (NDS 3–5 Punkte) mit mäßig ausgeprägten Beschwerden (NSS 4–6 Punkte) [1].
Autonome diabetische Neuropathie
Einfache Tests für ein Screening auf eine autonome diabetische Neuropathie gibt es nicht. Folgende Symptome können jedoch richtungsweisend sein, wenn auch mit geringer Spezifität und Sensitivität [1]:- Ruhetachykardie
- Störungen im gastrointestinalen Bereich (dyspeptische Symptome, Obstipation, Diarrhoe, Stuhlinkontinenz)
- Blasenfunktionsstörungen, sexuelle Funktionsstörungen
- gestörte Hypoglykämiewahrnehmung
- Schweißsekretionsstörungen
- anderweitig nicht begründete Blutglukoseschwankungen.
Diese Symptome einer ADN sollten bei der Anamneseerhebung bei Diabetikern abgefragt werden. Empfehlenswert ist dazu der Survey of Autonomic Symptoms (SAS), ein einfacher validierter Fragebogen mit 12 Fragen zu autonomen Symptomen [6], der auch auf Deutsch zur Verfügung steht [7].
Wird keine Neuropathie nachgewiesen, soll das Screening einmal jährlich wiederholt werden. Bei Verdacht auf oder Vorliegen einer diabetischen Neuropathie sollte, abhängig von der individuellen Krankheitssituation, zumindest eine halbjährliche Verlaufskontrolle erfolgen. Liegen zusätzlich eine pAVK und/oder Fußdeformitäten vor, werden alle drei Monate Kontrollen empfohlen.
Neuropathie oft unerkannt
Die Prävalenz einer DSPN wird bei Diabetikern im Mittel auf 30 % geschätzt. 13 bis 26 % der Diabetiker weisen eine schmerzhafte Neuropathie auf [1]. Im Rahmen der PROTECT-Studie wurde eine noch höhere Prävalenz ermittelt: Bei etwa der Hälfte der 1.850 Teilnehmer, darunter 943 Typ-2-Diabetiker, 126 Typ-1-Diabetiker und 781 Nicht-Diabetiker, wurde eine DSPN nachgewiesen [8]. Dabei zeigte sich auch, dass die Bedeutung der Nervenerkrankung nach wie vor unterschätzt wird. Selbst von den Studienteilnehmern mit schmerzhafter DSPN wussten die meisten nichts von ihrer Neuropathie.
Fußcheck als Screening-Instrument
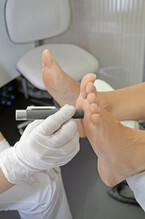
Die Daten der PROTECT-Studie wurden im Rahmen der nationalen Aufklärungsinitiative "Diabetes: Hören Sie auf Ihre Füße?" erfasst. 1.850 Personen nahmen die Gelegenheit zu einem kostenlosen Neuropathie-Screening wahr, bei dem Temperaturempfinden (mittels TipTherm®), Druck- bzw. Berührungsempfinden (10-g-Monofilament) und Vibrationswahrnehmung (128-Hz-Stimmgabel) der Füße überprüft wurden (Abb. 1a und b). Eine DSPN wurde bei 44 % der Typ-1-, bei 55 % der Typ-2-Diabetiker und sogar bei 48 % der Nicht-Diabetiker festgestellt. Allerdings wurde in der Gruppe von Teilnehmern, bei denen keine Blutzuckerstörung bekannt war, bei der HbA1c-Messung bei 35 % ein Prädiabetes und bei knapp 4 % ein manifester Diabetes nachgewiesen.
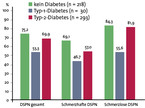
Besonders alarmierend: Fast 70 % der Studienteilnehmer, bei denen eine Neuropathie nachgewiesen wurde, wussten zuvor nicht, dass sie unter dieser Nervenerkrankung litten. Selbst bei den Befragten, die Schmerzen oder Brennen in den Füßen als Beschwerden angaben, war die Nervenschädigung zwei Dritteln nicht bekannt. Besonders hoch war die Dunkelziffer bei schmerzloser Neuropathie, die symptomlos verläuft oder sich durch Taubheitsgefühl oder Parästhesien in den Füßen äußert: Sie war im Mittel in 80 % der Fälle anamnestisch nicht diagnostiziert. Am höchsten war die Rate in der Nicht-Diabetiker-Gruppe, gefolgt von Typ-2- und Typ-1-Diabetikern (Abb. 2).
Ca. 25 bis 30 % der Betroffenen hatten eine schmerzlose DSPN, rund 13 % eine atypische mit Schmerzen nur beim Gehen. Parästhesien bzw. Taubheitsgefühl an den Füßen waren die häufigsten Symptome, Schmerzen nahmen in der Regel mit dem Schweregrad der Neuropathie zu.
Weitere Ergebnisse der Untersuchung:- Bei Typ-2-Diabetikern korrelierte eine schmerzhafte DSPN mit einem höheren Body-Mass-Index (BMI), dagegen
- ging eine schmerzlose DSPN gehäuft mit niedrigerem BMI einher.
- Bei Typ-2-Diabetikern war eine schmerzhafte, bei Nicht-Diabetikern die schmerzlose DSPN mit einer pAVK assoziiert.
- Sowohl bei Typ-2- als auch Nicht-Diabetikern zeigte sich ein Zusammenhang zwischen schmerzloser Neuropathie und männlichem Geschlecht [8].
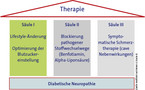
Das 3-Säulen-Modell der Therapie
Durch frühzeitige Behandlung einer diabetischen Neuropathie können das Fortschreiten der Erkrankung verhindert und Symptome gelindert werden. Im Vordergrund der Therapie steht dabei, die nervenschädigenden Faktoren auszuschalten. Die Diabeteseinstellung muss optimiert werden, denn eine Hyperglykämie führt zu zellschädigenden Prozessen wie oxidativem Stress und Bildung aggressiver Advanced Glycation Endproducts (AGEs), die Folgeerkrankungen verursachen. Ebenfalls wichtig ist ein Ausgleich eines häufig gravierenden Mangels an Vitamin B1 (Thiamin) bei Diabetikern, da über die Niere verstärkt Vitamin B1 ausgeschieden wird. In einer britischen Studie wurden bei Typ-1- und Typ-2-Diabetikern um durchschnittlich 75 % niedrigere Thiamin-Plasma-Spiegel nachgewiesen als bei Gesunden [9]. Da das Vitamin zentrale Funktionen im Nerven- und Glukosestoffwechsel hat, fördert ein Defizit Nervenschäden und Störungen im Glukose-Metabolismus.
Bei der Therapie der diabetischen Polyneuropathie hat sich ein 3-Säulen-Schema etabliert (Abb. 3).
Die erste Säule und zugleich bedeutendste Maßnahme: Das Risiko senken durch Optimierung der Blutzuckereinstellung, Kontrolle weiterer kardiovaskulärer Risikofaktoren wie Hypertonie und Hyperlipidämie und Lebensstilinterventionen. Empfohlen werden ein Verzicht auf Alkohol und Nikotin sowie viel körperliche Bewegung. In der DCCT-Studie bei Typ-1-Diabetikern reduzierte eine normnahe Diabeteseinstellung das Auftreten einer klinischen Neuropathie um 69 % (p=0,006) nach fünf Jahren im Vergleich zur Kontrollgruppe [10]. Die Progression der Neuropathie konnte um 57 % gebremst werden. Die neuroprotektive Wirkung einer guten Blutzuckereinstellung wurde bei Typ-2-Diabetikern bisher allerdings noch nicht eindeutig belegt.
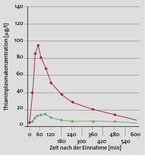
Die zweite Säule: Blockierung pathogener Stoffwechselwege, die durch Hyperglykämien aktiviert werden. Dazu stehen gut verträgliche Substanzen wie Benfotiamin und die antioxidativ wirkende Alpha-Liponsäure zur Verfügung. Benfotiamin ist eine Vorstufe von Vitamin B1 (Thiamin) mit einer ca. 5-fach höheren Bioverfügbarkeit als herkömmliches Thiamin (Abb. 4) [11]. Neue Messungen belegen, dass bei Gabe des fettlöslichen Prodrugs im Blut und vor allem intrazellulär höhere Konzentrationen von Thiamin-Diphosphat (aktive Form von Vitamin B1) erzielt werden als bei Anwendung wasserlöslicher Thiaminsalze [11, 12].
Vitamin-B1-Substitution
Eine Supplementation von Benfotiamin kann bei Diabetikern einen Vitamin-B1-Mangel effektiv ausgleichen und so zur Therapie der diabetischen Neuropathie und zur Linderung bereits vorhandener schmerzhafter und sensorischer Neuropathie-Symptome beitragen. Vitamin B1 wird u. a. als Cofaktor von verschiedenen Enzymen benötigt, die pathogene Stoffwechselwege bremsen [13]. Ein entscheidender Faktor für die Hemmung nervenschädigender Prozesse scheint die Transketolase zu sein, die durch Vitamin B1 bzw. noch stärker durch Benfotiamin aktiviert wird. Neue Forschungsarbeiten bestätigen den Zusammenhang zwischen der Transketolase und der Entstehung bzw. Ausprägung einer Neuropathie [14].
In einer sechswöchigen plazebokontrollierten Studie bei 165 Patienten mit DSPN wurde mit hochdosiertem Benfotiamin (600 mg; Wirkstoff in milgamma®protekt) in der Per-Protokoll-Analyse der Neuropathie-Symptom-Score signifikant verringert. Die Schmerzen vieler Patienten verringerten sich deutlich. Die Verbesserungen waren ausgeprägter bei hochdosierter Therapie (600 mg vs. 300 mg täglich) und nahmen mit zunehmender Studiendauer zu [15]. Ähnliche Ergebnisse wurden in einer weiteren plazebokontrollierten Studie über drei Wochen bei insgesamt 40 Diabetikern mit Polyneuropathie erzielt, die mit täglich 400 mg Benfotiamin behandelt wurden [16].
Ergänzung mit Alpha-Liponsäure
Ein weiterer Ansatz einer pathogenetisch begründeten Therapie ist die Gabe von Alpha-Liponsäure, Bestandteil des Pyruvatdehydrogenase-Komplexes und Co-Enzym bei oxidativer Decarboxylierung von Alpha-Ketosäure. Sowohl für die intravenöse als auch orale Applikation von Alpha-Liponsäure wurde eine Reduktion neuropathischer Symptome beschrieben [17, 18]. Benfotiamin und Alpha-Liponsäure ergänzen sich in ihren Wirkmechanismen [19]. In einer vierwöchigen Studie bei Typ-1-Diabetikern wurden mit der Kombinationstherapie (2 x 300 mg Benfotiamin, 2 x 600 mg Alpha-Liponsäure täglich) Marker Hyperglykämie-induzierter Stoffwechselwege verringert [20].
Die dritte Säule bildet die symptomatische Therapie neuropathischer Schmerzen. Wirksam sind vor allem Antikonvulsiva, Antidepressiva (Trizyklika, Serotonin-Noradrenalin-Wiederaufnahmehemmer) und langwirkende Opioide. Als Alternative kommt auch eine lokale Behandlung mit Capsaicin oder Elektrostimulation infrage. Substanzen mit erhöhten renalen und kardiovaskulären Langzeitrisiken wie NSAR oder Coxibe sind zur Therapie neuropathischer Schmerzen bei Diabetikern nicht geeignet [1]. Die Wirksamkeit der Pharmakotherapie sollte bei adäquater Dosis frühestens nach zwei Wochen beurteilt werden. Bei Wirkungslosigkeit sollte die Therapie abgesetzt werden. Sorgfältig zu beachten sind bei der systemischen Therapie der DSPN das hohe Risiko für Nebenwirkungen, Arzneimittelinteraktionen und die Abhängigkeitsgefahr. Zudem greift die symptomatische Therapie nicht in das Krankheitsgeschehen ein, so dass eine Progression der Nervenschädigung nicht aufgehalten wird. Daher sollten zusätzlich kausale und pathogenetisch begründete Therapiemaßnahmen erfolgen.
Interessenkonflikte: Prof. Stracke hält Vorträge für Wörwag Pharma
Auf unserem CME-Portal www.kirchheim-forum-cme.de können Sie ab dem 19.09.2018 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Der Allgemeinarzt, 2018; 40 (15) Seite 40-45