Die chronische Wunde ist keine eigenständige Erkrankung. Sie ist ein Symptom verschiedener Grunderkrankungen wie pAVK, CVI oder Diabetes mellitus. Die Behandlung ist komplex, da nur eine Kombination aus ursachenspezifischer Therapie der Grunderkrankung und individueller Lokaltherapie heilungsfördernd und damit effektiv ist.
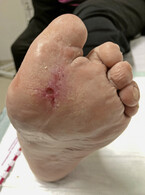
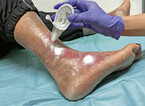
Eine Wunde wird als chronisch bezeichnet, wenn sie länger als 6 – 8 Wochen besteht [Dissemond et al., 2017]. Allerdings werden auch neu aufgetretene Wunden bei Patienten, die bereits schwer heilende Wunden haben oder hatten, von Beginn an als „chronisch“ bezeichnet, da sie erfahrungsgemäß nicht regelhaft heilen. Ein Beispiel dafür ist das diabetische Fußsyndrom mit rezidivierenden Wunden (Abb. 1), mal in Remission, dann wieder mit spontaner Eröffnung durch unbemerkte lokale Drucküberbelastung.
Bei Erstvorstellung sollte die Identifikation der Wundursache im Vordergrund stehen. Dazu sind eine ausführliche Anamnese sowie die Organisation und Durchführung einer ausreichenden und gezielten Diagnostik (s. u.) erforderlich. Eine strukturierte, an die Phasen der Wundheilung angepasste Therapieplanung sollte sich anschließen.
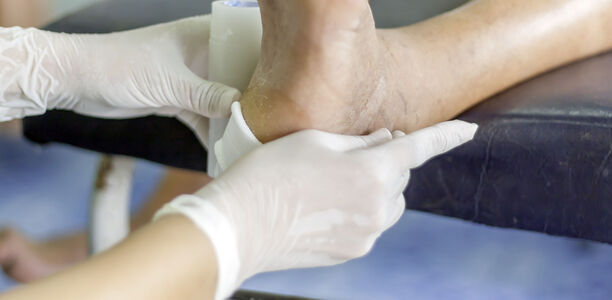
Die Lokaltherapie außerhalb der ärztlichen Praxis wird im Idealfall von speziell geschultem und/oder zertifiziertem Pflegepersonal, den Wundexpert:innen nach ICW [TÜV, 2021] oder Wundspezialist:innen [SAfW, 2017] durchgeführt, begleitet von einer systematischen Befunddokumentation und einer digitalen Fotodokumentation der Wunde.
Diagnostik chronischer Wunden
Das Wichtigste bei der Erfolg versprechenden Therapie chronischer Wunden ist das Aufdecken ihrer Ursache [DGfW-S3-Leitlinie, 2012]. Nur wenn die Grunderkrankung identifiziert und so gut wie möglich therapiert ist, kann eine individuelle und stadiengerechte Lokaltherapie wirksam sein.
Handelt es sich um Wunden, die am lateralen oder im medialen Unterschenkel (Ulcus cruris) lokalisiert sind, so liegt meist eine vaskuläre Genese vor. Anhand der Wundoptik ist es nicht sicher zu entscheiden, ob es sich um eine arterielle oder venöse Ursache handelt.
Manchmal jedoch gibt die Wundumgebung erste Hinweise, da bei venöser Genese häufiger eine (beidseitige) Beinschwellung vorliegt. Allerdings sind nicht automatisch alle Wunden, die nicht durch venöse Insuffizienz bedingt sind, arteriellen Charakters: Auch das sogenannte „Ulcus mixtum“ ist vergleichsweise häufig. Dementsprechend sollte die Diagnostik eines Ulcus cruris folgende Untersuchungen beinhalten:
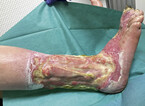
- Beurteilung der Haut und sichtbarer Gefäße (Zeichen des postthrombotischen Syndroms (PTS), Stauungsdermatitis, Hauttemperatur etc.) (Abb. 2)
- Bei (beidseitigen) Beinödemen: Lymphödem? Erysipel (klinischer Befund, Entzündungsmarker)? Lipödem (Tastbefund, paradoxer Kneiftest)? Kardiale bzw. renale Ödeme (Anamnese, kardiologische Diagnostik, Serologie)? Chronisch-entzündliche Ödeme (rheumatisch-immunologische Serologie) oder Hypalbuminämie (Serologie)?
- Bestimmung des Knöchel-Arm-Index (Ankle Brachial Index, ABI), welcher zum Nachweis und zur Verlaufsbeurteilung einer pAVK dient: Quotient aus systolischem Blutdruck des Unterschenkels und des Oberarms (Tabelle 1)
- Durchführen einer Dopplersonografie zur Identifikation eines PTS, einer Varikosis, einer Leitveneninsuffizienz und von Stenosen.
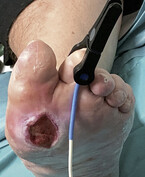
- Durchführung einer beidseitigen Oszillografie an den unteren Extremitäten zur Bestimmung der arteriellen Durchblutungssituation (Abb. 1a).
- Speziellere Diagnostik bei V. a. arterielle Komponente mittels Duplexsonografie gefolgt von CT-Angiografie (CTA) oder MR-Angiografie (MRA).
Lokaltherapie chronischer Wunden
Die zurzeit umfassendsten Empfehlungen zur Therapie chronischer Wunden im deutschsprachigen Raum gibt die S3-Leitlinie der AWMF [DGfW, 2012, in Novellierung], an deren Verfassung zwölf Fachgesellschaften und auch Patienten beteiligt waren. Sie beinhaltet eine umfassende Analyse von 4.998 systematischen Referenzen zur Wundbehandlung mit Identifizierung von 26 systematischen Übersichtsarbeiten und 38 kontrollierten Interventionsstudien. Daraus resultieren 37 konsentierte Expertenempfehlungen, wobei davon nur 7 evidenzbasiert und 30 GCP-Empfehlungen sind. Somit beruht die empfohlene Wundtherapie im Wesentlichen auf Konsens von ärztlichen und pflegerischen Wundexperten. Dies ist nicht unbedingt negativ, da im internationalen Kontext eine große Übereinstimmung hinsichtlich der Lokaltherapie chronischer Wunden besteht.
Schwieriger gestaltet sich jedoch die genaue Produktwahl, da sich die Wundprodukte der einzelnen Hersteller in Wirkung und Funktion stark unterscheiden können, obwohl die Packungsbeilagen gleiche oder ähnliche Inhaltsstoffe beschreiben.
1. Wundexsudatmanagement
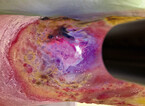
Wundexsudat entsteht im Rahmen des natürlichen und regelrechten Heilungsprozesses. Es ist essenziell und gewährleistet ein feuchtes Wundmilieu mit Bereitstellung von Nährstoffen zum Zellwachstum und Wundverschluss [Lloyd Jones, 2014]. Das Exsudatmanagement von stark sezernierenden Wunden stellt hohe Ansprüche an die lokale Wundtherapie. Bei geringer bis mäßiggradiger Exsudation sollten polyester- und viskosehaltige Wundauflagen oder Alginate verwendet werden; bei stark exsudierenden Wunden vorwiegend PU-Schäume, Gelbildner und stark absorptionsfähige Polymere, sog. Superabsorber [Dissemond et al., 2017] (Abb. 3).
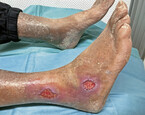
Wenn eine sehr starke Exsudation auf einer (beginnenden) lokalen Wundinfektion basiert (Abb. 4), sollte der Primärverband – je nach Ausprägung – eine wirkstoffhaltige Wundauflage, z. B. mit ionischem oder nanokristallinem Silber oder PHMB, oder ein hydrophobes Wundnetz sein (s. u.). Bei dieser Art der Therapie ist zumeist ein Sekundärverband aus PU-Schaumstoff bzw. ein Superabsorber zur zusätzlichen Exsudataufnahme erforderlich.
2. Kritische bakterielle Kolonisation und Infektion
Ist das Wundexsudat verfärbt und zeigt sich ein untypischer oder unangenehmer Wundgeruch, so liegt eine (beginnende) Wundinfektion vor und die Therapie sollte rasch den geänderten Bedingungen angepasst werden [Dissemond et al., 2017]. Erste Wahl dazu ist die ausgiebige Wundreinigung mit antimikrobiellen Lösungen (z. B. hypochlorigen Säuren, Polyhexanid(PHMB)-Lösung, Octenisept®) [Alvarez-Marin et al., 2017]. Für die unterschiedlichen Spüllösungen müssen die variierenden Einwirkzeiten (5 – 15 Min.) beachtet werden, damit sie ausreichend antimikrobiell wirken. Physiologische Kochsalzlösung ist in der Regel bei kritisch kolonisierten, infizierten oder mit Biofilm besiedelten Wunden (Abb. 4) nicht ausreichend.
Wenn die Wunde Beläge enthält, ist ein oberflächliches Débridement sinnvoll, um nekrotisches Material zu entfernen und die Bakterienmenge zu reduzieren. Das scharfe Débridement zeigt hierbei die besten und schnellsten Effekte, ist jedoch im ambulanten Sektor nicht immer realisierbar (z. B. bei Blutungsgefahr durch Marcumarisierung oder Varikosis). An weiteren Formen des Débridements stehen das autolytische (z. B. Hydrogele), das proteolytische (z. B. Iruxol N®), das biochirurgische (z. B. Madentherapie), das physikalische (z. B. Ultraschall) und das hydrochirurgische zur Verfügung, wobei für keines eine ausreichende Evidenz vorliegt [DGfW-S3-Leitlinie, 2012]. Nach lokaler Intervention sollte die infizierte Wunde mit einer wirkstoffhaltigen Wundauflage (antiseptisch, nicht antibiotisch) bedeckt werden.
Zur Wahl des in der Wundauflage enthaltenden Wirkstoffes gibt es keine Evidenz, sondern ausschließlich Expertenempfehlungen. In der Leitlinie werden explizit polihexanid-, biguanid-, silber- oder octenidinhaltige Wundauflagen/Gele sowie Cadexomer-Iod, PVP-Iod-Salbe, PVP-Iod-Gel oder PVP-Iod-Gaze als gleichwertig benannt.
Anders als Antibiotika, die meist nur einen Mechanismus des bakteriellen Stoffwechsels blockieren, adressieren die o. g. antimikrobiellen Lösungen und Substanzen verschiedene Orte an der bakteriellen Zellwand, ihrer Zellmembran oder auch im Inneren der Bakterienzelle. Sie haben somit diverse Möglichkeiten, die Replikation der Bakterienzellen zu verhindern oder sie zu töten [Williamson, 2017]. Deshalb besteht bisher keine klinisch relevante Antiseptika-Resistenz der typischen Wundbakterien.
Zumeist werden silberhaltige Wundauflagen als Primärverband bei infizierten und biofilmbesiedelten Wunden genutzt [Kramer et al., 2018; Lo et al., 2009], aber auch PHMB-haltige Wundauflagen zeigen in Studien eine gute antimikrobielle Wirksamkeit [Huebner et al., 2010; Lenselink et al., 2011]. Für Wundauflagen mit Silberanteil sollte die Therapiedauer 14 Tage nicht überschreiten [Dissemond et al., 2017]. Aufgrund starker Exsudation ist häufig die Applikation eines Sekundärverbands (z. B. Superabsorber) nötig. Bei starker Wundfeuchte sollten der Wundrand und die Wundumgebung nicht außer Acht gelassen werden [Dissemond et al., 2017]: In Abhängigkeit von Exsudatmenge, lokaler Feuchtigkeit oder Hauttrockenheit ist die Pflege mit zink-, kortison-, antiseptika- und/oder ureahaltigen Salben und Pasten sehr sinnvoll, um das umliegende Gewebe zu schützen und eine Zunahme der Wundgröße zu vermeiden.
Antibiotika-Verordnung
Neben der Lokaltherapie wird auch die Verordnung einer begleitenden systemischen Antibiotikatherapie kritisch diskutiert [Rajala et al., 2020]. Grund dafür ist, dass Patienten mit chronischen Wunden eher keine Heilung erfahren, sondern sich bestenfalls in einer Remission ihrer Wunden befinden, sich also die Frage einer oralen oder auch intravenösen, meist stationären Antibiotikagabe immer wieder stellt. Gegen eine eher großzügige Verordnung spricht das Risiko der Entwicklung einer Antibiotikaresistenz der Wundbakterien. Diese ist gefürchtet, da eine systemische Infektion mit ihren „eigenen“ Bakterien für die meist betagten Patienten lebensbedrohlich sein kann.
Würde der behandelnde Arzt bei jedem Infekt-Verdacht ein Antibiotikum verordnen, so wäre die Wahrscheinlichkeit groß, dass sich die bakterielle Kolonisation der Wunde zugunsten der resistenten Bakterien verschiebt [Dissemond et al., 2005]. Somit sollte die Verordnung von Antibiotika wohl überdacht und klinisch durch den Lokalbefund, den Laborbefund und den Allgemeinzustand des Patienten gerechtfertigt sein. Auch die S2k-Leitlinie „Kalkulierte parenterale Initialtherapie bakterieller Erkrankungen bei Erwachsenen – Update 2018“ [Bodmann et al., 2018] definiert als Indikationen zur systemischen sequenziellen Antibiotikagabe bei schlechter Studienlage mangels anerkannter Kriterien und dementsprechend fehlender Evidenz nur
- systemische Zeichen einer Infektion,
- eingeschränkte Durchblutung (z. B. pAVK) oder Resorption,
- oberflächlich ausgedehnte Infektionen,
- einen Übergang in eine tiefer reichende, schwere Phlegmone,
- eine Lokalisation an den Beugesehnen bzw. im Gesicht.
Wann genau und bei welchem Patienten eine Antibiotikatherapie begonnen werden sollte, bleibt eine vergleichsweise freie, ärztlich individuelle Entscheidung. Die Indikation hängt neben o. g. insbesondere vom individuellen Risiko des Patienten aufgrund bestehender Grunderkrankungen und den Möglichkeiten zur engmaschigen Kontrolle des (Lokal-)Befundes mit ggf. schneller Änderung der ärztlichen Therapie ab. Eine lokale Applikation von Antibiotikacreme oder -salbe wird jedoch von den meisten Ärzten auch wegen der möglichen Kontaktsensibilisierung als obsolet angesehen.
Fazit
Für den einzelnen Patienten richtig bei der lokalen Therapie chronischer Wunden zu entscheiden, ist vergleichsweise anspruchsvoll, da die Evidenzlage in diesem Gebiet deutlich schlechter als in den meisten medizinischen Bereichen ist. Dies mag daran liegen, dass in der Zulassung von Wundprodukten das Medizinproduktegesetz (MPG) und nicht das Arzneimittelgesetz (AMG) angewendet wird. Es fehlt also die Motivation, aufwendige und teure randomisiert kontrollierte Studien durchzuführen. Nichtsdestotrotz existieren eindeutige (inter-)nationale Expertenempfehlungen, die dem Behandelnden in der täglichen Praxis als Entscheidungshilfen dienen können. Die Erfahrung zeigt, dass nach bestmöglicher Therapie der Grunderkrankung eine sukzessive, wenn auch meist langsame Wundheilung mittels stadiengerechter Lokaltherapie induziert werden kann.
Prof. Dr. Ewa K. Stürmer
Erschienen in: DERMAforum, 2021; 25 (12) Seite 6-7