Die Psoriasis wird heute als systemische Erkrankung aufgefasst, die Hautsymptome, eine mögliche Gelenkbeteiligung sowie charakteristische Komorbiditäten umfasst. Viele Betroffene haben aufgrund der systemischen Entzündung auch ein erhöhtes kardiovaskuläres Risiko. Wichtig ist es, diejenigen Patienten zu identifizieren, die eine mittelschwere bis schwere Erkrankung mit einem erhöhten systemischen Entzündungsdruck aufweisen. Bei ihnen ist die Entzündungskontrolle ein vorrangiges Therapieziel. Daher profitieren sie in der Regel von einer systemischen und zielgerichteten Therapie. Diese Fortbildung gibt einen Überblick über den aktuellen Wissenstand bei der komplexen Systemerkrankung Psoriasis und bei ihren Therapiemöglichkeiten.
In Deutschland liegt die Ein-Jahres-Prävalenz der Psoriasis – ermittelt für das Jahr 2005 – bei etwa 2,5 % [1, 2, 3]. Damit sind ca. zwei Millionen Menschen von dieser chronisch entzündlichen Erkrankung der Haut betroffen. Bei über 90 % der Patienten kommt es zu einem chronischen Verlauf [4].
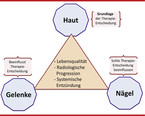
Die Psoriasis wird heute als systemische Erkrankung aufgefasst, die nicht nur die typischen Symptome der Haut umfasst, sondern oft auch eine Nagel- und/oder Gelenkbeteiligung (Psoriasis-Arthritis) sowie weitere charakteristische Begleiterkrankungen [4].
Haut
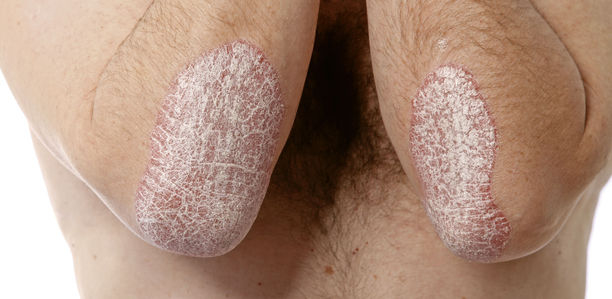
Die häufigste Manifestationsform an der Haut (vgl. Abb. 1) ist die Psoriasis vulgaris oder Psoriasis vom Plaque-Typ. An ihr sind ungefähr 80 % aller Psoriasis-Patienten erkrankt. Typisch sind scharf begrenzte, rötliche, leicht erhabene Plaques, die mit silbrig-weißen Schuppen bedeckt sind. Diese treten bevorzugt an den Prädilektionsstellen auf, wie den Streckseiten von Ellenbogen und Knie, der Kreuzbeingegend mit Analfalte und auch an der Kopfhaut. Grundsätzlich kann jedoch jedes Körperareal von Psoriasisherden betroffen sein.
Weitere Manifestationsformen der Psoriasis sind:
- Psoriasis guttata. Hier handelt es sich um eine eher akut verlaufende Form mit kleinen (0,1 – 1,5 cm), aber klinisch ähnlichen Läsionen wie bei der Plaque-Psoriasis. Diese Form tritt häufig als Erstmanifestation im Kindes- oder Jugendalter auf, nicht selten nach einer Infektion mit Streptokokken. Ein Übergang in eine Psoriasis vulgaris ist möglich.
- Psoriasis intertriginosa/Psoriasis inversa. Die entzündlich schuppenden Herde treten in den Körperfalten auf (Achseln, Leisten, submammär, Bauchfalte, Analfalte), entweder ausschließlich (selten) oder zusätzlich zu den typischen Plaques an den Streckseiten. Hierzu wird auch die Psoriasis im Intimbereich gerechnet.
- Die psoriatische Erythrodermie ist die seltene Maximalvariante der Psoriasis vulgaris, bei der die gesamte Haut betroffen ist und die häufig von Komplikationen begleitet eine stationäre Behandlung notwendig macht.
- Die pustulösen Psoriasisformen lassen sich in verschiedene Subtypen unterteilen. Allen gemeinsam ist das Auftreten eitriger Pusteln, die steril sind, das heißt, es sind keine Erreger in den Pusteln nachweisbar. Ein Subtyp ist die Pustulosis palmoplantaris (PPP), die ausschließlich die Handinnenflächen und/oder Fußsohlen betrifft. Bei dieser lokalisierten genetisch vermutlich eigenständigen Form entwickeln sich Pusteln und feste Schuppenauflagerungen (Hyperkeratosen), die auch zu bedeutenden funktionellen und physischen Beschwerden führen können.
Häufig verläuft die Psoriasis über viele Jahre chronisch bis progredient oder sie tritt in akuten Schüben auf, nicht selten als Folge von Infekten, Stress oder der Einnahme bestimmter Medikamente. In der schubfreien Zeit kann die Haut komplett abheilen [4].
Jeder Psoriasis-Patient entwickelt im Verlauf seiner Krankheitsgeschichte seine "eigene" Psoriasis. Die Klassifizierung anhand des Hautbefundes ist bedeutsam, wichtiger ist es jedoch, den Patienten in einem Gesamtkontext zu sehen.
Nagelpsoriasis
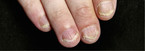
Bei allen Formen der Psoriasis kann es zu charakteristischen Nagelveränderungen kommen, die häufig schwer zu behandeln sind. Etwa jeder zweite Psoriasispatient bekommt auch eine Nagelpsoriasis [5]. Bei Patienten mit einer Gelenkmanifestation können es bis zu 80 % sein.
Häufige Veränderungen an den Nägeln sind:
- Tüpfelnägel: Charakterisiert durch kleine, wenige Millimeter große punktförmige Einsenkungen der Nagelplatte (vgl. Abb. 2).
- Onychodystrophie: Eine Zerstörung der Nägel, die Teile oder den ganzen Nagel betreffen kann. Eine wichtige Differenzialdiagnose ist der Nagelpilz.
- Ölflecken: Gelbe bis bräunliche, scharf begrenzte Verfärbungen unterhalb der Nagelplatte. Diese sind besonders stigmatisierend für die Betroffenen, weil sie mit "ungepflegt sein" oder "Suchterkrankung" assoziiert werden.
- Subunguale Hyperkeratose: Sie tritt bei ca. 30 – 40 % der Patienten auf und ist eigentlich eine Psoriasisplaque unter dem Nagel, der schmutzig werden kann.
Nagelveränderungen sind sehr stigmatisierend für die Patienten. Darüber hinaus ist eine Nagelpsoriasis mit einem schwereren Krankheitsverlauf assoziiert [6] und Prädiktor für eine fakultative Gelenkbeteiligung.
Gelenke – Psoriasis-Arthritis (PsA)
Eine Gelenkmanifestation wird bei 20 – 30 % der Psoriasispatienten beobachtet. Von diesen sind 40 bis 57 % von erosiven Gelenkveränderungen betroffen [7]. Wann sich Erosionen entwickeln, ist individuell sehr verschieden. Es gibt Studien, die zeigen, dass erosive Veränderungen der Gelenke in etwa einem Viertel der Fälle bereits innerhalb von zehn Monaten nach Beginn der Psoriasis-Arthritis nachweisbar sind, bei über 40 % der Patienten innerhalb von zwei Jahren nach Beginn einer Psoriasis-Arthritis [8]. Daher spricht man auch von einem "Window of Opportunity", einem Zeitfenster, in dem man sowohl diagnostisch als auch therapeutisch reagieren kann.
Patienten mit Psoriasis-Arthritis weisen in 70 – 80 % der Fälle eine Nagelbeteiligung auf. Diese tritt bei ihnen damit deutlich häufiger auf als bei Patienten ohne PsA [9].
Wichtig ist, bei Patienten mit Schuppenflechte immer und regelmäßig nach Schmerzen und Schwellungen der Gelenke und nach Morgensteifigkeit zu fragen.
Pathophysiologie – das Geschehen in der Haut
Die Psoriasis wird heutzutage als eine multifaktorielle Erkrankung gesehen. Die Bereitschaft, die Krankheit zu entwickeln, wird in den meisten Fällen vererbt. Ob aus einem Genotyp auch ein Phänotyp entsteht, kann von weiteren (Auslöse-)Faktoren abhängen. Dazu gehören beispielsweise Stress, Medikamente, Traumata oder Infektionen [4].
Was in der Folge in der Haut abläuft, kann als hochkomplexe immunologische Reaktion beschrieben werden. Diese weist eine starke entzündliche Komponente auf mit epidermaler Hyperproliferation und gestörter Differenzierung der Keratinozyten. Dies führt zur Bildung der sich auftürmenden Hautschuppen. Dabei sind verschiedenste Immunzellen und Zytokine beteiligt. Wichtige – auch als therapeutische Angriffspunkte genutzte – Zytokine sind der Tumornekrosefaktor-alpha (TNF-alpha) und die proentzündlich wirkenden Interleukine-12 und -23 sowie Interleukin-17 [10].
Auslösefaktoren
Die Auslösefaktoren, die eine Psoriasis triggern können, lassen sich in externe und interne Trigger unterteilen (vgl. Übersicht 1).
Externe Trigger
Beim sogenannten Köbner-Phänomen können Verletzungen, Druck- und Scherkräfte und/oder Unterbrechungen der Kontinuität der Haut zu Psoriasisläsionen führen, selbst bei vorher gesunder Haut. So sieht man Psoriasisplaques zum Beispiel auf einem Tattoo oder einer Narbe. Auch saisonale Effekte existieren, Verschlechterungen sieht man in Herbst und Winter, während sich die Hautläsionen im späten Frühjahr und Sommer bessern. Zu den externen Auslösern gehören auch Arzneimittel, wie zum Beispiel Betablocker, die bei vielen Patienten eine Psoriasis unterhalten oder verschlechtern können. Auch Alkohol und Nikotin, Überernährung und Adipositas zählen zu den externen Auslösefaktoren. Insbesondere dem Bauchfett wird ein ausgesprochen hohes proinflammatorisches Potenzial zugewiesen.
Interne Trigger
Infektionskrankheiten, vor allem wenn sie durch Streptokokken ausgelöst sind, können dazu führen, dass Immunreaktionen angestoßen werden. Hierzu gehören auch Infekte, die subklinisch verlaufen. Daher kann es sinnvoll sein, bei Patienten mit mittelschwerer bis schwerer Psoriasis, die neu aufgetreten ist oder auch chronisch verläuft, eine Infektfokussuche durchzuführen (Sonographie der Nasennebenhöhlen, Untersuchung des Zahnstatus, gynäkologische Abklärung). Zum Beispiel können subklinisch verlaufende Sinusitiden immunologisch eine Schuppenflechte erhalten. Hormonelle Faktoren beeinflussen das Ausmaß der Läsionen, so wird eine Schuppenflechte in der Pubertät häufig schlechter, in der Schwangerschaft hingegen mitunter besser. Bekannt ist auch, dass psychische Belastungen und Stress die Psoriasis negativ beeinflussen können.
Eine wichtige Aufgabe ist daher, in Zusammenarbeit mit dem Patienten modifizierbare Auslösefaktoren zu identifizieren und diese nach Möglichkeit zu vermeiden.
Eingeschränkte Lebensqualität
Die Lebensqualitäts-Einschränkungen der Patienten sind bedeutend und korrelieren nicht mit dem Schweregrad der Hautläsionen. Die Einschränkungen betreffen jedoch alle Bereiche des Lebens (vgl. Übersicht 2). Das Stigma der sichtbaren Erkrankung bewirkt unter anderem verminderte Chancen im Beruf, eingeschränkte Möglichkeiten in der Lebensgestaltung und Probleme bei der Partnerwahl und der Sexualität. Auch in der Kindheit mit ihren vulnerablen Entwicklungsphasen ist der Leidensdruck der Psoriasis bedeutend.
Daher geht die gesundheitsbezogene Lebensqualität (health-related quality of life; HRQoL) als wichtiger Parameter mit ein in die Beurteilung des Schweregrades der Psoriasis [4]. Sie lässt sich einfach mit dem weltweit eingesetzten und auch in Deutschland validierten Fragebogen "Dermatologischer Lebensqualitäts-Index" (DLQI) messen (vgl. Übersicht 3). Diesen kann der Patient im Wartezimmer schnell ausfüllen. Er besteht aus zehn Multiple-Choice-Fragen zu fünf verschiedenen Lebensbereichen. Die DLQI-Werte reichen von minimal 0 bis maximal 30 Punkten. Je niedriger der Wert ist, umso höher ist die Lebensqualität. Eine Veränderung von fünf Punkten ist relevant und wahrnehmbar [11]. Der Fragebogen ist unter diesem Link als PDF-Download erhältlich: http://www.psonet.de/wp-content/uploads/downloads/2012/07/2008-Dermatologischer-Lebensqualitäts-Iindex-DLQI.pdf
Schweregrad bestimmen
In die Bewertung des Schweregrades sollten immer die Größe und Intensität des Hautbefalls (PASI, BSA) eingehen, die Lokalisation der Hautläsionen (sichtbarer Bereich: Gesicht, Nägel oder Intimbereich) sowie die individuelle Lebensqualität [4].
Die BSA (Body Surface Area) gibt den Prozentsatz der betroffenen Körperoberfläche an. Als Faustregel repräsentiert die Handfläche ein Prozent der Körperoberfläche (KOF).
Der Psoriasis Area and Severity Index (PASI) wird meist in klinischen Studien eingesetzt, ist aber auch im ärztlichen Alltag relativ einfach zu erheben. Der PASI kann einen Wert zwischen 0 und 72 einnehmen (vgl. Abb. 3). Es werden die vier Körperregionen Kopf, Arme, Rumpf und Beine betrachtet. Dabei werden für jede Körperregion drei Symptome beurteilt: die Intensität der Rötung (Erythem), die Intensität der Verdickung der Haut (Infiltration) und die Intensität der Schuppung, jeweils auf einer Skala von 0 bis 4. Die Abschätzung der betroffenen Körperoberfläche erfolgt auf einer Skala von 0 (nicht betroffen) bis 6 (komplett betroffen). Damit können pro Körperregion maximal 18 Punkte vergeben werden. Bei vier betrachteten Körperarealen sind das 72 Punkte. Mit dem PASI kann der Schweregrad des Hautbefalls einer Psoriasis vulgaris besonders bei mittelschwerer bis schwerer Erkrankung sicher eingeschätzt werden [4].
"Upgrade" des Schweregrads
Patienten, die nur wenige Hautläsionen aufweisen mit einem PASI oder BSA < 10, können trotzdem starke oder sehr starke Einschränkungen der Lebensqualität haben. Dies ist häufig der Fall, wenn die Nägel, das Gesicht oder der Genitalbereich betroffen sind. Eine starke Einschränkung der Lebensqualität kann dazu führen, dass der Schweregrad der Erkrankung höhergestuft werden muss ("Upgrade") und sich daraus auch eine Indikation für eine Systemtherapie ergibt [13].
Komorbidität
Zur typischen Komorbidität zählen andere chronisch entzündliche Erkrankungen. So treten bei Psoriasispatienten im Vergleich zur übrigen Bevölkerung signifikant häufiger Autoimmunerkrankungen wie Arthritis, Morbus Crohn oder Colitis ulcerosa auf (vgl. Übersicht 4). Auch leiden sie etwa zwei- bis dreimal häufiger unter Erkrankungen, die das kardiovaskuläre Risiko erhöhen. Dazu gehören vor allem: Adipositas, Hypertonie, Typ-2-Diabetes, Fettstoffwechselstörung [1], auch zusammengefasst als Metabolisches Syndrom.
Bei Patienten ab mittelschwerer Psoriasis sollte der Hausarzt immer kardiovaskuläre Risikofaktoren beziehungsweise Komorbiditäten erfassen. Konkret bedeutet das: Blutdruck messen, Blutzucker und Blutfette kontrollieren sowie Gewicht bzw. Taille-Hüft-Verhältnis ermitteln. Hierfür wurden innerhalb der Fachgesellschaft interdisziplinäre Algorithmen entwickelt [14].
Therapieentscheidung: Topisch oder systemisch?
Dank einer intensiven jahrzehntelangen experimentellen und klinischen Forschung hat sich inzwischen eine nie gekannte Breite möglicher Behandlungsansätze ergeben. So wurden für die Psoriasis an der Haut seit 2005 vier neue Arzneimittel zugelassen, für die Anwendung bei Psoriasis-Arthritis sogar sechs Präparate. Mit den bisher verfügbaren und diesen neuen Arzneimitteln ist es möglich, einem großen Teil der Betroffenen nachhaltig zu helfen.
Für die Therapieentscheidung "topisch" oder "systemisch" ist es wichtig, zwischen "leichter Psoriasis" und "mittelschwerer bis schwerer" Psoriasis zu unterscheiden. Ab einem PASI > 10 oder einem BSA > 10 und einer stark eingeschränkten Lebensqualität (DLQI > 10) liegt eine mittelschwere bis schwere Psoriasis vor [3, 9]. Von besonderer Bedeutung sind hier insbesondere auch exponierte Hautareale. Weiter sollten Indikatoren für einen möglichen schweren Krankheitsverlauf berücksichtigt werden, wie Psoriasis-Arthritis, Nagelbefall und eine mögliche systemische Entzündungsaktivität, die sich in unterschiedlicher Komorbidität zeigen kann (vgl. Abb. 4).
Die leichte Psoriasis ist die Domäne der topischen Therapie, während die mittelschwere bis schwere Schuppenflechte in der Regel systemisch behandelt wird. Grundlage jeder Behandlung ist die Basistherapie mit wirkstofffreien Salbengrundlagen oder topischen Zubereitungen von Harnstoff und Salicylsäure [4]. Die Basistherapie spielt bei Psoriasis vulgaris eine wichtige Rolle [15]. Dies gilt unabhängig vom Schweregrad der Erkrankung oder dem angewendeten Therapiekonzept. Sie trägt dazu bei, Symptome wie Juckreiz und Schuppenbildung zu vermindern, Exazerbationen zu reduzieren und somit die Remission nach einer erfolgreichen Therapie zu verlängern [15]. Entsprechend kann durch eine adäquate Basistherapie auch die stark beeinträchtigte Lebensqualität von Psoriasis-Patienten positiv beeinflusst werden. Bedauerlicherweise wird jedoch der Stellenwert einer Basistherapie bei Psoriasis noch immer unterschätzt.
Topische Therapie
Für die leichten Formen der Psoriasis werden topische Therapien empfohlen. Momentaner Goldstandard sind topisches Vitamin D3 und topische Steroide. Bewährt haben sich auch Kombinationspräparate aus Kortison und Vitamin D3.
Systemische Therapie
Bei mittelschweren und/oder schweren Formen der Schuppenflechte ist eine systemische Therapie indiziert. Hier stehen die "klassischen" Systemtherapeutika wie Ciclosporin, Fumarsäureester, Methotrexat und die Retinoide, die eher selten und bei speziellen Formen eingesetzt werden, als medikamentöse Erstlinientherapie neben der Fototherapie zur Verfügung. Seit 2015 ist das Biologikum Secukinumab zugelassen, ein gegen Interleukin-17A gerichteter Antikörper, der als einziges Biologikum ein First-Line-Label hat und damit unter bestimmten Voraussetzungen auch in der Erstlinientherapie der Psoriasis eingesetzt werden kann (vgl. Übersicht 5).
Wenn die Erstlinientherapie keinen ausreichenden Therapieerfolg erzielt hat oder bei Unverträglichkeiten oder Kontraindikationen für die konventionellen systemischen Therapeutika kann ein Biologikum eingesetzt werden. Hier sind derzeit mit Adalimumab, Etanercept und Infliximab drei gegen TNF-alpha gerichtete Biologika zugelassen. Weiter ist der gegen Interleukin-12 und -23 gerichtete monoklonale Antikörper Ustekinumab zur Behandlung der Plaque-Psoriasis und Psoriasis-Arthritis zugelassen.
2015 wurden die ersten Biosimilars zu Infliximab auch für die Behandlung der Psoriasis vulgaris in der Zweitlinientherapie zugelassen. Bei Biosimilars handelt es sich um Kopien des Original-Antikörpers. Auf molekularer Ebene sind Biosimilars nicht absolut identisch mit dem Referenzprodukt, aber sehr ähnlich.
Ebenfalls seit 2015 ist mit Apremilast ein oral einzunehmendes sogenanntes "Small Molecule" für die systemische Zweitlinientherapie zugelassen. Es handelt sich um einen Phosphodiesterase-Hemmstoff, der u. a. die Produktion des proentzündlichen Interleukin-17 und weiterer Botenstoffe hemmt.
Wahl des geeigneten systemischen Therapeutikums
Jeder Patient benötigt eine individuelle Therapieplanung. Sowohl die "konventionellen" Systemtherapien als auch die modernen Biologika fordern eine sorgfältige Untersuchung des Patienten vor Therapiebeginn und eine regelmäßige Therapieüberwachung und -begleitung.
Bei der Wahl des geeigneten systemischen Therapeutikums müssen vor allem die Begleiterkrankungen und die Begleitmedikation berücksichtigt werden. Letztlich geht es darum, klinische Kriterien (Psoriasisform und -lokalisation, Schweregrad, Komorbidität und Vortherapien) mit dem Medikamentenprofil (Effektivität bei Psoriasis und Psoriasis-Arthritis, Effektivität bei Komorbiditäten, Sicherheit und praktische Anwendbarkeit) und den Patientencharakteristika (Präferenzen, Alter, Geschlecht, Sozioökonomie, Adhärenz) abzustimmen. Weiter berücksichtigt werden müssen Vorgaben der Zulassungsbehörden, Kostenfragen und aktuelle Evidenz bzw. Leitlinienempfehlungen.
Biologika
Für alle Biologika gilt: Sie wurden in klinischen Studien gut untersucht und ihre Wirksamkeit und Sicherheit sind mit höchstem Evidenzniveau belegt [16].
Ein wichtiges Problem stellt allerdings in der Praxis das Nachlassen des Ansprechens auf Biologika dar, das während der Erhaltungstherapie mit der Zeit vorkommen kann. Vor allem bei TNF-alpha-Antagonisten wurde dies bereits häufiger in der Literatur beschrieben [17].
Laut den Zulassungen der verschiedenen Biologika liegen keine Kontraindikationen bei kardiovaskulären Erkrankungen vor, mit Ausnahme der TNF-alpha-Antagonisten Adalimumab und Infliximab, die bei mäßiger bis schwerer Herzinsuffizienz (NYHA-Klasse III/IV) kontraindiziert sind.
Es konnte darüber hinaus sogar ein signifikant geringeres Auftreten von Herzinfarkten unter einer Psoriasis-Therapie mit TNF-alpha-Antagonisten im Vergleich zu einer topischen oder Fototherapie gezeigt werden (Daten einer großen US-amerikanischen Versicherung) [18].
Fazit
Die Therapie der Psoriasis hat sich mit dem zunehmenden Einsatz der Biologika in den letzten zehn Jahren stark gewandelt. Bei Patienten mit mittelschwerer bis schwerer Psoriasis ist die systemische, nach Möglichkeit zielgerichtete Therapie Standard. Bei der Therapiewahl müssen viele Faktoren berücksichtigt werden, wie z. B. Begleiterkrankungen.
Es gibt jedoch noch Verbesserungsbedarf in der Versorgung der Psoriasispatienten. Aus Patientenperspektive stehen ein früher Therapiebeginn sowie eine wirksame und dauerhafte sichere Therapie im Vordergrund. Aus Arztperspektive sind die Prävention von Begleiterkrankungen und die langfristige Medikamentenadhärenz wichtig.
Interessenkonflikte: Marc A. Radtke war oder ist als Berater und/oder Redner und/ oder Teilnehmer an klinischen und versorgungwissenschaftlichen Studien tätig, die von folgende Firmen unterstützt wurden oder werden: Abbott/AbbVie, Almirall-Hermal, Amgen, Biogen, Celgene, Eucerin, Galderma, Janssen, La Roche Posay, Leo Pharma, Medac, MSD, Mundipharma, Novartis, Pfizer.
Auf unserem CME-Portal www.med-etraining.de können Sie ab dem 07.10.2015 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Dieser CME-Beitrag wurde unterstützt von der Janssen-Cilag GmbH.
Erschienen in: Der Allgemeinarzt, 2015; 37 (16) Seite 16-22