10 – 30 % der Senioren über 75 Jahre haben einen Mangel an Vitamin B12. Eine chronische Unterversorgung mit dem Vitamin geht nicht nur mit unspezifischen Symptomen wie Abgeschlagenheit und Magen-Darm-Beschwerden einher, sondern auch mit Blutbildveränderungen sowie neurologischen und psychiatrischen Störungen. Auch ein Zusammenhang zwischen einem Vitamin-B12-Mangel und einem erhöhten Risiko für Alzheimer-Demenz ist inzwischen belegt. Laut neuen Daten zählt ein Vitamin-B12-Mangel zu den häufigsten behandelbaren Ursachen einer Demenz. Deshalb sollte bei Risikopersonen für einen Mangel regelmäßig der Vitamin-B12-Status bestimmt werden und bei Bedarf eine Substitutionstherapie erfolgen. Der folgende Beitrag informiert über die Bedeutung von Vitamin B12, die Symptome eines Vitamin-B12-Mangels sowie über Diagnostik und Therapie.
Vitamin B12 (Cobalamin) zählt zu den essenziellen Vitaminen. Der Tagesbedarf beträgt für Jugendliche und Erwachsene 3 µg (Schwangere 3,5 µg/Tag, Stillende 4 µg/Tag) [1] und ist durch eine normale Mischkost in der Regel einfach zu decken. Über eine für westliche Industrienationen typische Ernährung werden täglich etwa 3–30 µg Vitamin B12 aufgenommen [2]. Eine Unterversorgung droht insbesondere Älteren aufgrund von Resorptionsstörungen sowie Vegetariern und Veganern.
In der Gesamtbevölkerung ist ein Vitamin-B12-Mangel bei normaler Ernährung selten. Dennoch weisen 62 % der Schwangeren, 25 – 86 % der Kinder, 21 – 41 % der Erwachsenen und 11 – 30 % der älteren Personen einen Mangel auf [3]. In Deutschland liegen laut Daten der Nationalen Verzehrstudie rund 8 % der Männer und ein Viertel der Frauen bei der Vitamin-B12-Zufuhr unter dem empfohlenen Tagesbedarf [4]. Bei Mädchen und Frauen im Alter bis 24 Jahre waren über 30 % betroffen.
Ursachen des Vitamin-B12-Mangels
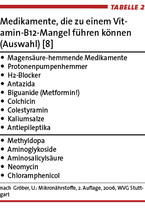
Die Gründe für die hohe Prävalenz des Vitamin-B12-Mangels bei Älteren und insbesondere Pflegeheimbewohnern sind weit verbreitete Resorptionsstörungen bei Senioren wie Nahrungs-Cobalamin-Malabsorption, oft in Verbindung mit einem prädisponierenden Faktor wie atrophischer Gastritis oder chronischer Helicobacter-pylori-Infektion [2]. Bei einer Malabsorption kann das in Nahrungsmitteln enthaltene Cobalamin im Darm nur ungenügend verarbeitet werden oder es besteht ein Mangel an intestinalen Cobalamin-Transport-Proteinen. Auch eine perniziöse Anämie, die ebenfalls mit einem Mangel an Transport-Proteinen wie Intrinsic Factor assoziiert ist, kann zu einem Vitamin-B12-Mangel beitragen. Sehr selten sind genetische Störungen des Vitamin-B12-Stoffwechsels (<1 %) [2]. Generell haben Patienten mit intestinalen Erkrankungen wie atrophischer Gastritis, Pankreasinsuffizienz oder chronisch-entzündlichen Darmerkrankungen ein erhöhtes Risiko für Mangelerscheinungen (Tabelle 1 ). Auch ein Magenbypass, chronischer Alkoholkonsum oder Arzneimittel können die Resorption von Cobalamin beeinträchtigen. Relevant ist z. B. die Einnahme von säurehemmenden Arzneimitteln wie Protonenpumpenhemmern, H2-Rezeptor-Antagonisten und Antazida sowie die Langzeiteinnahme des Antidiabetikums Metformin [2, 6]. Zu weiteren Medikamenten, die mit Cobalamin interagieren können, zählen das Gichtmittel Colchicin, der Lipidsenker Coles-
tyramin, Antiepileptika und Methyldopa sowie Antibiotika wie Aminoglykoside, Neomycin und Chloramphenicol (Tabelle 2) [7]. Außer bei Älteren sollte insbesondere auch bei schwangeren Frauen wegen des erhöhten Vitamin-B12-Bedarfs an das mögliche Vorliegen eines Mangels gedacht werden. Ein Mangel kann sowohl zu einer verzögerten Entwicklung des Fetus beitragen als auch bei Neugeborenen zu neurologischen Symptomen wie Reizbarkeit, Apathie, Appetitlosigkeit oder Erbrechen und zu motorischen und psychischen Entwicklungsstörungen führen [8].
Cobalamin wird zu einem großen Teil passiv resorbiert
Vitamin B12 wird im Darm sowohl aktiv als auch passiv resorbiert. Je mehr Cobalamin verfügbar ist, desto größer ist der Anteil, der passiv durch Diffusion über die Darmschleimhaut aufgenommen werden kann [2, 9]. Für den aktiven Transport wird Cobalamin im Dünndarm an Intrinsic Factor gebunden. Dieser Komplex wird im distalen Abschnitt des Ileums über die Cubilin-Rezeptoren der Mukosazellen aufgenommen. Abhängig von der Dichte der Rezeptoren werden täglich maximal 1,5 µg Cobalamin aufgenommen [9]. Dies bedeutet, dass bei hoher Verfügbarkeit von Vitamin B12 im Darm, z. B. im Rahmen einer oralen Substitutionstherapie, mehr Cobalamin passiv, also Intrinsic-Factor-unabhängig, als aktiv resorbiert wird.
Bei Mangel entsteht Hyperhomocysteinämie
Cobalamin wird im Cytoplasma in Methyl- und Adenosylcobalamin umgewandelt, die als Coenzyme für Methylierungsprozesse fungieren [9]. Methylcobalamin wird für die Umwandlung von Homocystein zu Methionin benötigt. Steht zu wenig zur Verfügung, kann sich eine Hyperhomocysteinämie entwickeln, die mit einem erhöhten kardiovaskulären Risiko assoziiert ist. Zudem entsteht ein funktioneller Folatmangel. Bei einem Mangel an Vitamin B12 und an Folsäure ist die Bildung von Purinbasen und Thymidin beeinträchtigt. Infolgedessen ist die Zellvermehrung gestört [9]. Adenosylcobalamin ist Co-Faktor der Methylmalonyl-CoA-Synthase und wird unter anderem für die Proliferation, Reifung und Regeneration von Nervenzellen benötigt [10]. Bei einem Mangel häuft sich Methylmalonsäure (MMA) an. Dadurch wird die Bildung der Myelinscheiden von Nervenzellen und die Markbildung der Hinterstränge beeinträchtigt [9].
Vielfältige unspezifische Symptome
Die Symptome eines Vitamin-B12-Mangels sind vielfältig, unspezifisch und oft subtil. Wegen der großen Vitamin-B12-Reservespeicher in unserem Körper (insgesamt 2–5 mg, davon 60 % in der Leber) entwickeln sich bei chronischer Unterversorgung Symptome schleichend mit einer Verzögerung von 5–10 Jahren [2]. Am häufigsten sind infolge der beeinträchtigten Purin- und Pyrimidin-Synthese Blutbildveränderungen wie perniziöse Anämie. Charakteristisch ist eine Blutarmut mit extrem großen roten Blutkörperchen (megaloblastäre Anämie). In schwereren Fällen können auch Leukopenie und Thrombozytopenie auftreten. Zu den klinischen Symptomen zählen blasse Haut, Atrophie der Schleimhäute, Huntersche Glossitis mit Zungenbrennen, Schwäche, Ermüdbarkeit, Antriebsarmut und Schwindel [9]. Durch einen B12-Mangel ausgelöst werden können auch Magen-Darm-Beschwerden (Dyspepsie, Übelkeit, Erbrechen, Diarrhoe) sowie gynäkologische Beschwerden wie eine Atrophie der Vaginalschleimhaut [2]. Denn das Wachstum von Oberflächenzellen ist bei Vitamin-B12-Mangel gestört. Dies kann sich klinisch z. B. auch in Form von Mundwinkeleinrissen (Rhagaden) und in seltenen Fällen durch Braunwerdung der Haut äußern.
Den Blutbildveränderungen um Monate oder Jahre vorausgehen können neurologische und psychiatrische Symptome unterschiedlich schwerer Ausprägung. Zu den möglichen Symptomen zählen:
Neurologische Symptome
- Parästhesien (Kribbeln bzw. Ameisenlaufen in Armen oder Beinen)
- Sensibilitätsstörungen (z. B. pelziges Taubheitsgefühl)
- Gangunsicherheit ("Gehen wie auf Watte")
- Erhöhte Sturzneigung
- Störungen der Tiefensensibilität (Erkennen und Lage der Stellung z. B. der Beine ist gestört)
- Ausfall der Reflexe
- Lähmungen [7, 9]
Zerebrale/psychische Symptome
- Verwirrtheit
- Störungen von Gedächtnis und Urteilsvermögen
- Apathie
- Depressionen
- Psychotische Zustände
- Demenz
Eine neurologische Folgeerkrankung eines langjährigen B12-Mangels ist die funikuläre Spinalerkrankung (Myelose), die durch die Entmarkung von Hintersträngen und Störung der Pyramidenseitenbahnen des Rückenmarks ausgelöst wird [9, 10].
Zusammenhang mit Morbus Alzheimer
Zunehmend mehr Daten belegen den Zusammenhang zwischen einem Vitamin-B12-Mangel und einer Alzheimer-Demenz (AD). So könnte durch rechtzeitigen Ausgleich eines Vitamin-B12-Mangels manche Demenzerkrankung verhindert werden. In einer chinesischen Fall-Kontroll-Studie bei 230 älteren Patienten, darunter 115 mit Alzheimer-Demenz und 115 Kontrollpersonen, wurden Assoziationen zwischen niedrigen Vitamin-B12-Spiegeln und erhöhten Homocysteinwerten im Serum mit einem erhöhten Alzheimer-Risiko nachgewiesen [11]. Waren sowohl die Vitamin-B12-Werte auffällig (< 400 pg/ml) als auch die Homocysteinwerte erhöht (≥ 15 µmol/l), war das AD-Risiko rund 30-fach höher als bei Studienteilnehmern mit Normwerten. Die Folatspiegel hatten auf diesen Zusammenhang keinen Einfluss.
- Holotranscobalamin < 35 pmol/l
- Serum-Cobalamin-Spiegel < 150 pmol/l bei 2 separaten Messungen oder Serum-Cobalamin-Spiegel < 150 pmol/l und Gesamtserum-Homocystein > 10 µmol/l
- Methylmalonsäurespiegel > 300 nmol/l (nach Ausschluss von Niereninsuffizienz, Folat- und Vitamin-B6-Mangel)
In einer deutschen Untersuchung mit 160 geriatrischen Patienten mit Demenzverdacht wurden bei mehr als 30 % aller neu diagnostizierten Demenzerkrankungen und bei 18 % der Patienten mit bekannter Demenz behandelbare Ursachen der Erkrankung nachgewiesen [12]. Am häufigsten waren dies bei Patienten mit neu diagnostizierter Demenz neben depressiver Pseudodemenz (13 %) und Normaldruck-Hydrocephalus (8 %) ein Vitamin-B12-Mangel (10 %). Bei mehr als der Hälfte der Studienteilnehmer fielen außerdem zu niedrige Folatspiegel auf. Da aber der Zusammenhang zwischen Demenz und den Folatspiegeln unklar ist, wurde dies nicht zu den behandelbaren Ursachen gezählt.
Bei Demenzverdacht Vitamin-B12-Spiegel messen!
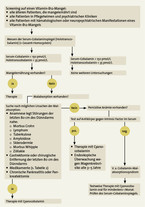
In der deutschen S3-Leitlinie Demenz wird empfohlen, bei Patienten mit Verdacht auf eine Demenzerkrankung durch bildgebende Verfahren und Laboruntersuchungen, unter anderem die Messung der Vitamin-B12-Spiegel, behandelbare Ursachen der Erkrankung aufzuspüren [13]. Allerdings können auch durch eine potenziell ursächliche Therapie bereits bestehende kognitive Defizite oft nicht mehr verbessert werden. Ein Vitamin-B12-Mangel sollte daher möglichst frühzeitig erkannt werden, um die Entwicklung oft irreversibler neurologischer Symptome zu verhindern. Geeignet wäre dafür zum Beispiel ein Screening von älteren Patienten in schlechtem Ernährungszustand, Bewohnern von Pflegeheimen, Patienten in psychiatrischen Kliniken sowie Patienten mit hämatologischen oder neuropsychiatrischen Symptomen, die mit einem Vitamin-B12-Mangel einhergehen können (vgl. Übersicht 1).
Standard zum Nachweis eines Vitamin-B12-Mangels ist die Messung des Gesamt-Vitamin-B12 im Serum, eventuell in Kombination mit der Messung der Homocysteinspiegel als funktioneller Indikator eines Vitamin-B12-Mangels (vgl. Infokasten). Allerdings ist das Gesamt-Vitamin-B12 ein später, relativ unsensitiver und unspezifischer Biomarker des B12-Mangels, weil dabei vorwiegend die inaktive Speicherform gemessen wird. Bei einer Gesamt-Vitamin-B12-Konzentration im unteren Referenzbereich zwischen 150 und 400 pmol/l kann ein B12-Mangel nicht sicher ausgeschlossen werden [10].
Zuverlässiger ist die Messung von Holotranscobalamin (Holo-TC), das den Status des tatsächlich aktiven Vitamin B12 wiedergibt. Erniedrigte Werte (< 35 pmol/l) sind der früheste Marker eines B12-Mangels und ein Hinweis darauf, dass der Körper über nicht ausreichend verwertbares Vitamin B12 verfügt und die B12-Speicher sich aufgrund der negativen Vitamin-B12-Bilanz bereits leeren. In diesem Stadium werden klinische oder hämatologische Symptome noch nicht beobachtet [10]. Personen mit Holo-TC-Werten zwischen 35 und 50 pmol/l sind Risikopatienten für einen Vitamin-B12-Mangel.
Erniedrigte Holo-TC-Werte in Verbindung mit erhöhten Methylmalonsäure (MMA)- (> 300 nmol/l) und erhöhten Homocysteinspiegeln (> 10 µmol/l), beides funktionelle Indikatoren eines B12-Mangels, weisen auf einen metabolisch manifesten Vitamin-B12-Mangel hin. Auch in diesem Stadium können klinische Symptome noch fehlen. Differenzialdiagnostisch zu beachten ist, dass die MMA-Werte auch bei eingeschränkter Nierenfunktion erhöht sein können und auch ein Mangel an Folsäure und Vitamin B6 zur Hyperhomocysteinämie führen kann. Auch Urinuntersuchungen mit Nachweis einer Methylmalonaturie oder einer Homocysteinurie können auf einen Vitamin-B12-Mangel hinweisen [9].
Therapie des B12-Mangels
Frühzeitig erkannt kann der Mangel durch Umstellung der Ernährung oder eine Substitutionstherapie ausgeglichen und der Entwicklung von Symptomen vorgebeugt werden. Zu den Anwendungsgebieten von Vitamin B12 zählen außerdem eine Hyperhomocysteinämie, eine hyperchrome makrozytäre Megaloblastenanämie (Perniziosa, Biermer-Anämie, Addison-Anämie) und eine funikuläre Spinalerkrankung [9]. Die Empfehlungen hinsichtlich Dosierung und Anwendung der B12-Substitution sind bisher nicht einheitlich. Infrage kommt eine parenterale (i.v./i.m./s.c.) oder orale Substitutionstherapie, für die unterschiedliche Cobalamine zur Verfügung stehen. Therapeutisch eingesetzt werden Cyanocobalamin und Hydroxocobalamin, die im Organismus zu den aktiven Coenzymen Methylcobalamin oder 5´-Adenosylcobalamin umgewandelt werden. Cyanocobalamin gilt als stabiler als Hydroxocobalamin [9].
Standard ist die parenterale Gabe von Cobalamin, da die Bioverfügbarkeit von oralem Cobalamin aufgrund der Abhängigkeit von Intrinsic Factor als gering galt. Inzwischen belegen aber zunehmend mehr Studiendaten, dass eine hochdosierte orale Substitutionstherapie auch bei gestörter aktiver Resorption den Vitamin-B12-Mangel rasch ausgleichen kann, ohne dass eine parenterale Gabe notwendig wird. Ausnahmen sind Patienten mit schweren neurologischen Störungen oder mit perniziöser Anämie, bei denen initial eine parenterale Substitutionstherapie notwendig ist.
Cobalaminspiegel steigen dosisabhängig
Bei einer Substitutionstherapie steigen die Cobalaminspiegel im Serum dosisabhängig (Abb. 1). Als niedrigste notwendige Tagesdosen von oralem Cyanocobalamin zum Ausgleich eines Vitamin-B12-Mangels bei älteren Personen (Gesamt-Vitamin-B12 135–406 pg/ml, MAA ≥ 0,26 µmol/l) erwiesen sich in einer Dosisfindungsstudie Konzentrationen oberhalb von 600 µg – mehr als das 200-Fache der empfohlenen Nahrungszufuhr von 3 µg täglich [14].
In einer Vergleichsstudie über 4 Monate bei 38 Patienten mit neu diagnostiziertem Vitamin-B12-Mangel, im Mittel 71 Jahre alt, war eine Substitutionstherapie mit oralem Cyanocobalamin (2 mg täglich) einer Injektionstherapie (1 mg i.m. an den Tagen 1, 3, 7, 10, 14, 21, 30, 60, 90) mindestens ebenbürtig. Beurteilt wurden sowohl hämatologische als auch neurologische Parameter sowie die Serumwerte von Cobalamin, Methylmalonsäure und Homocystein. Bei 4 von 18 Patienten unter oraler Substitutionstherapie und bei 4 von 15 Patienten aus der i.m.-Gruppe wurden deutliche Verbesserungen neurologischer Symptome wie Parästhesien, Ataxie oder Gedächtnisverlust festgestellt. Alle Serummarker für einen Vitamin-B12-Mangel wurden bei allen Behandelten deutlich verbessert. Die Cobalamin- und MAA-Werte wurden bei Patienten der oralen Substitutionsgruppe sogar signifikant stärker gebessert als in der i.m.-Gruppe (Abb. 2) [15]. Auch ein Cochrane-Review von 2 randomisierten kontrollierten Studien mit insgesamt 108 Patienten mit Vitamin-B-Mangel (≤ 240 pg/ml) bestätigt die Gleichwertigkeit einer oralen Cobalamin-Therapie (1 mg bzw. 2 mg täglich) mit einer intramuskulären Substitutionstherapie (1 mg) [16]. In der zweiten Vergleichsstudie bei 70 Patienten mit megaloblastärer Anämie aufgrund eines Vitamin-B12-Mangels, im Mittel 60 bzw. 64 Jahre alt, wurde Cobalamin sowohl bei oraler als auch i.m.-Therapie in der Dosis von 1 mg verabreicht (in den ersten 10 Tagen täglich, in den folgenden 4 Wochen wöchentlich, danach monatlich). 60 Patienten schlossen die 3-monatige Studie ab. Beide Therapieformen waren zur Verbesserung hämatologischer Parameter wie Hb-Werte und Leukozytenzahl, beurteilt an den Tagen 30 und 90, ähnlich effektiv. Auch die mittleren Serum-Cobalamin-Spiegel erhöhten sich in beiden Gruppen deutlich. Bei 21 Patienten wurden bei Studienbeginn neurologische Auffälligkeiten wie kognitive Defizite (n=7), periphere Neuropathien (n=9) und Verlust des Vibrationsempfindens (n=5) festgestellt. Bei rund drei Viertel der Behandelten, sowohl in der peroralen als auch der i.m.-Gruppe, wurden bereits nach einmonatiger Therapie deutliche Verbesserungen dieser Symptome festgestellt. Die orale Therapie erwies sich nach Angaben der Autoren als besser verträglich als die intramuskuläre.
Diesen Daten zufolge dürfte die orale Substitutionstherapie bei den meisten Patienten mit Vitamin-B12-Mangel eine der parenteralen Applikation gleichwertige Alternative sein, die von den Patienten vorgezogen werden dürfte. Weitere Vergleichsstudien wären allerdings wünschenswert, insbesondere bei Patienten mit Malabsorption.
Interessenkonflikte: Der Autor hat keine deklariert.
Auf unserem CME-Portal www.med-etraining.de können Sie ab dem 18.4.2016 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Der Allgemeinarzt, 2016; 38 (7) Seite 38-43