UV-Strahlung stellt einerseits einen wichtigen Risikofaktor für die Entstehung von Hautkrebs dar. Andererseits ist eine unzureichende UV-Exposition der Haut durch den resultierenden Vitamin-D-Mangel ein schwerwiegendes gesundheitliches Risiko. In diesem Beitrag wird das Spannungsfeld zwischen positiven und negativen Effekten der UV-Strahlung unter Berücksichtigung neuer Forschungsergebnisse erörtert und es werden Empfehlungen zu einem gesundheitsbewussten Umgang mit der Sonne gegeben.
Die richtige Bewertung und Abwägung der positiven und negativen Effekte von UV-Strahlung wird derzeit sowohl in medizinischen Fachkreisen als auch in der allgemeinen Bevölkerung intensiv und kontrovers diskutiert [12, 21, 22]. Aktuell ist es daher ein wichtiges Ziel, über einzelne wissenschaftliche und medizinische Fachgebiete hinaus einheitliche Informationen und Empfehlungen für einen gesunden Umgang mit Sonne und UV-Strahlung zu entwickeln und zu kommunizieren [12, 21, 22].
Bei der Bewertung der positiven und negativen Effekte von UV-Strahlung befinden wir uns in einem Dilemma [12, 21, 22]. Einerseits stellt die solare UV-Strahlung den wichtigsten umweltbedingten Risikofaktor für die Entstehung von hellem Hautkrebs (Basalzellkarzinome, aktinische Keratosen, Plattenepithelkarzinome der Haut) dar und ist auch für die Pathogenese des malignen Melanoms von Bedeutung [15]. Folgerichtig stellen Maßnahmen zum Sonnenschutz insbesondere bei Risikogruppen einen wichtigen Bestandteil zur Prävention von Hautkrebs dar.
Andererseits wissen wir heute, dass auch eine unzureichende UV-Exposition der Haut durch den resultierenden Vitamin-D-Mangel mit schwerwiegenden gesundheitlichen Risiken (u. a. erhöhtes Risiko für zahlreiche Herz-Kreislauf-, Infektions-, Autoimmun- und Krebserkrankungen) assoziiert ist [12, 21, 22]. Denn der überwiegende Anteil des benötigten Vitamin D wird in der Haut unter der Einwirkung von Sonnenlicht gebildet [12, 21, 22].
Vitamin-D-Stoffwechsel
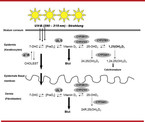
Die Bezeichnung „Vitamin D“ ist eigentlich eine Fehlbezeichnung, da Vitamin D im Widerspruch zur Definition von Vitaminen im menschlichen Organismus eigenständig gebildet wird [12, 21]. Für die kutane Vitamin-D-Synthese (Abb. 1) muss allerdings ausreichend Sonnenlicht (UV-B) zur Verfügung stehen [12, 21]. Die beiden wichtigsten Formen der Vitamin-D-Metabolite (Calciferole) sind Vitamin D3 (auch Cholecalciferol, Colecalciferol oder Calciol genannt) und Vitamin D2 (Ergocalciferol) [12, 21]. Während Vitamin D3 in der Haut gebildet oder über tierische Lebensmittel aufgenommen wird, gelangt Vitamin D2 über pflanzliche Lebensmittel in den Körper [12, 21]. Der biologisch aktive Metabolit der Calciferole ist das 1,25-Dihydroxyvitamin D3 (1,25(OH)2D3, Calcitriol) [12, 21].
Ausgangspunkt der Vitamin-D-Biosynthese ist 7-Dehydrocholesterol (7-DHC) [12, 21]. Dieses wird in der Haut gespeichert und dort in einem photochemischen Prozess unter der Einwirkung von ultravioletter Strahlung (UV-B, Wellenlänge: 290 – 315 nm) über Zwischenstufen zu Vitamin D3 metabolisiert [12, 21] (Abb. 1). Bei übermäßiger Sonneneinstrahlung wird eine Kumulation von Vitamin D3 in der Haut durch die dann einsetzende Bildung unwirksamer Nebenprodukte verhindert [12, 21] (Abb. 1). Vitamin D3 ist biologisch weitestgehend inaktiv und wird erst durch zwei enzymatisch vermittelte Hydroxylierungen in Leber und Niere zu 1,25(OH)2D3, dem aktiven Vitamin-D-Hormon [12, 21]. Hierzu gelangt Vitamin D3 zunächst über den Blutweg in die Leber, wo es zu 25-Hydroxyvitamin D3 (25(OH)D3) hydroxyliert wird. 25(OH)D3 ist die Hauptzirkulationsform an Vitamin-D-Metaboliten im Blut und wichtigster Laborparameter für die Beurteilung des Vitamin-D-Status [12].
Obwohl es bislang keinen allgemeinen Konsens über den optimalen 25(OH)D-Serumspiegel gibt, wird ein Vitamin-D-Mangel (Defizienz) von den meisten Experten bei 25(OH)D-Serumwerten unter 20 ng/ml (50 nmol/l) angenommen [12]. Auch die Frage nach dem optimalen Bereich ist bisher nicht klar beantwortet. Nach einer aktuell gebräuchlichen Einteilung werden 25(OH)D-Serumwerte von 21 – 29 ng/ml (52 – 72 nmol/l) als relative Vitamin-D-Insuffizienz angesehen, ein Spiegel von 30 ng/ml (75 nmol/l) oder mehr als ausreichend [12]. Vitamin-D-Intoxikation wird in der Regel erst ab 25(OH)D-Serumwerten über 150 ng/ml (374 nmol/l) beobachtet [12]. Unter Verwendung dieser Definitionen wurde geschätzt, dass weltweit mehr als 1 Milliarde Menschen von Vitamin-D-Mangel (Defizienz) oder -Insuffizienz betroffen sind [12].
Die für die Umwandlung zum aktiven Vitamin-D-Hormon 1,25(OH)2D3 entscheidende zweite Hydroxylierung findet überwiegend in der Niere statt [12]. Bei fortgeschrittener Niereninsuffizienz ist die 1,25(OH)2D3-Synthese deutlich eingeschränkt [12]. Die renale Produktion von 1,25(OH)2D3 wird über zentrale Steuerungsmechanismen, u. a. durch den Plasma-Parathormonspiegel sowie den Kalzium- und Phosphorserumspiegel, streng reguliert [12]. Wenn 1,25(OH)2D3 im Überschuss vorliegt, wird es in der Leber und in anderen Organen durch die Induktion eines P450-Enzyms (CYP24A1, Vitamin-D-24-Hydroxylase) vermehrt in einen biologisch inaktiven Metaboliten (24,25(OH)2D3) umgewandelt [12].
Negative und positive Wirkungen der Sonnenstrahlung
Sonnenlicht wirkt sich vielfältig auf den menschlichen Organismus aus [12, 15]. Als negative Auswirkung einer übermäßigen Sonnenlichtexposition ist neben Dermatitis solaris, Katarakt und Hautalterung v. a. das erhöhte Hautkrebsrisiko zu nennen [15]. Sowohl der helle Hautkrebs (Basalzellkarzinom, aktinische Keratose, Plattenepithelkarzinom) als auch der schwarze Hautkrebs (malignes Melanom) weisen weltweit eine steigende Inzidenz auf [12, 15, 21, 22]. Für die steigenden Inzidenzraten des hellen Hautkrebses, der überwiegend in höherem Lebensalter in chronisch lichtexponierten Hautarealen auftritt, wird von einigen Experten eine erhöhte kumulative UV-Exposition verantwortlich gemacht [15, 21, 22]. Hierzu können häufige Aktivitäten im Freien beitragen. Aber vor allem die älter werdende Bevölkerung (sogenannte Alterspyramide) führt dazu, dass immer mehr Menschen eine hohe kumulative UV-Belastung aufweisen [15, 21, 22]. Für den hellen Hautkrebs gilt der Satz: „Die Haut vergisst keinen Strahl.“ Anders verhält es sich dagegen mit dem Melanomrisiko: Während häufige Episoden kurzzeitiger, intensiver Sonnenlichtexposition (v. a. Sonnenbrände in der Kindheit) das Risiko erhöhen, scheint regelmäßige, maßvolle Sonnenlichtexposition eher eine protektive Wirkung zu haben [7, 8, 9, 14, 17, 19]. Sonnenbrände sind deshalb unbedingt zu vermeiden.
Auf der anderen Seite hat das Sonnenlicht auch wichtige positive gesundheitliche Auswirkungen, deren Bedeutung häufig unterschätzt wird [12, 15]. Neben den stimmungsaufhellenden Wirkungen durch die Freisetzung von Botenstoffen im Gehirn (v. a. Endorphine und Serotonin) ist hier v. a. die kutane Vitamin-D-Synthese zu nennen. Denn ca. 90 % des vom menschlichen Organismus benötigten Vitamin D wird in der Haut unter der Einwirkung von UV-B-Strahlung gebildet [12]. Zwar kann Vitamin D auch über die Nahrung aufgenommen und verstoffwechselt werden (Vitamin D2/Vitamin D3), aber unter unseren Lebensbedingungen können dadurch nur etwa 10 % des Vitamin-D-Bedarfs gedeckt werden, denn nur wenige Nahrungsmittel enthalten relevante Mengen (v. a. ölige Fische wie Lachs, Makrele und Hering sowie Fischöle und Lebertran) [12].
Vitamin-D-Zufuhr über Lebensmittel in Deutschland
Die Deutsche Gesellschaft für Ernährung e. V. empfiehlt derzeit in diesen aktualisierten D-A-CH-Referenzwerten für die Nährstoffzufuhr [3] eine tägliche Zufuhr von Vitamin D in Höhe von 20 µg für Kinder und Erwachsene (auch für ältere Menschen ≥ 65 Jahre); das entspricht 800 Internationalen Einheiten (IE). Für Säuglinge (bis zwölf Monate) werden 10 µg pro Tag (400 IE) empfohlen.
Nach der Nationalen Verzehrstudie (NVS II) liegt in Deutschland die mediane Vitamin-D-Zufuhr bei Männern im Alter von 14 bis 80 Jahren bei 2,9 μg pro Tag und bei gleichaltrigen Frauen bei 2,2 μg pro Tag. Die mediane Zufuhr an Vitamin D steigt bei beiden Geschlechtern im Lauf des Lebens an und liegt bei Senioren (65 – 80 Jahre) ebenso wie in der nächstjüngeren Altersgruppe (51 – 64 Jahre) bei 3,3 µg (Männer) bzw. 2,6 µg (Frauen) pro Tag.
Bei Kindern und Jugendlichen ist die mediane Zufuhr noch geringer: Laut der EsKiMo-Studie (Ernährungsmodul der KiGGS-Studie) nehmen 6- bis 11-jährige Jungen 1,4 μg und gleichaltrige Mädchen 1,3 μg Vitamin D pro Tag auf [21]. Die größte Menge an Vitamin D wird über Fisch (ca. 33 %) und Fischerzeugnisse (ca. 15 %) aufgenommen. Jeweils etwa 10 % der Vitamin-D-Zufuhr stammen aus Fetten, Eiern bzw. Milch/Käse [2].
Aufgaben von Vitamin D und mögliche Mangelerscheinungen
Eine wichtige Funktion des Vitamin-D-Systems ist die Aufrechterhaltung eines stabilen Plasma-Kalzium-Spiegels und die Regulation des Knochenstoffwechsels durch Bereitstellung von Kalzium für die Knochenmineralisation [12]. Dies geschieht durch Steigerung der intestinalen Kalzium- und Phosphataufnahme, Beeinflussung von Knochenmineralisation und Knochenresorption, Suppression der Nebenschilddrüsenfunktion und Beeinflussung der renalen Kalzium- und Phosphatexkretion [12]. Patienten mit hohen 25(OH)D-Serumspiegeln weisen eine entsprechend hohe Knochenmineraldichte auf [6, 20]. Es konnte gezeigt werden, dass die tägliche Einnahme von Vitamin D das Risiko für eine Hüftfraktur um etwa 25 % reduziert [6]. Eine Studie mit Untersuchung von 675 Knochenbiopsien ergab pathologische Knochenmineralisationsveränderungen ausschließlich bei Patienten, deren 25(OH)D-Serumwerte unter 75 nmol/l lagen [20]. Die Autoren zogen die Schlussfolgerung, dass zur Gewährleistung einer optimalen Knochengesundheit der 25(OH)D-Serumspiegel mindestens 75 nmol/l (30 ng/ml) betragen sollte [20].
Entgegen der früheren Ansicht ist Vitamin D aber nicht ausschließlich für den Kalzium- und Knochenstoffwechsel von großer Bedeutung. Es wirkt sich günstig auf Muskulatur und Herz-Kreislauf-System aus, schützt vor Autoimmunerkrankungen und Krebs und steigert die Infektabwehr [12]. Epidemiologische Untersuchungen zeigen, dass mit zunehmender Entfernung des Wohnortes vom Äquator das Risiko ansteigt, an verschiedenen malignen Tumoren (u. a. Mamma-, Ovarial-, Kolon- und Prostatakarzinom) zu erkranken oder zu versterben [12]. Ein Zusammenhang dieser Beobachtungen mit erniedrigten Vitamin-D-Serumspiegeln wurde nachgewiesen [12]. Auf direkte oder indirekte Art und Weise kontrolliert das Vitamin-D-Hormon mehrere hundert Gene, u. a. auch solche Gene, die die Regulation der zellulären Proliferation, Differenzierung, Apoptose und Angioneogenese steuern [12]. So beeinflusst 1,25(OH)2D3 in zahlreichen Geweben als ortsständig produzierter Faktor das lokale Wachstum.
Auch viele andere chronische Erkrankungen (u. a. Herz-Kreislauf-, Autoimmun- und Infektionskrankheiten) treten mit zunehmender Nähe zum Äquator seltener auf. Diese Beobachtung sowie bestätigende epidemiologische und klinische Studien sprechen dafür, dass ein Vitamin-D-Mangel auch für diese Erkrankungen einen Risikofaktor darstellt [12].
Vitamin-D-Mangel: Ursachen, Prävention und Therapie
Vitamin-D-Mangel geht in den meisten Fällen auf eine unzureichende kutane Vitamin-D-Synthese zurück. Die Ursachen hierfür sind vielfältig: u. a. geringe UV-Exposition, geringe Intensität der UV-B-Strahlung während der Wintermonate (sog. „Vitamin-D-Winter“), eine ausgeprägte Hautpigmentierung (Dunkelhäutige benötigen im Vergleich zu Hellhäutigen die 10- bis 50-fache Dosis an UV-B-Strahlung, um gleiche Mengen an 1,25(OH)2D3 zu produzieren), zunehmendes Alter (die Vitamin-D-Produktion ist bei 70-jährigen Menschen drei- bis fünffach geringer) und die Anwendung von Sonnenschutzcremes (v. a. Lichtschutzfaktor > 8).
In der Regel genügt eine maßvolle und begrenzte Sonnenlichtexposition, um eine ausreichende Vitamin-D-Synthese zu erzielen [12, 21, 22]. Das Maß für UV-Strahlenqualität und UV-Strahlungsintensität ist der weltweit einheitliche UV-Index. Er gibt die sonnenbrandwirksame (UV-B-) Strahlungsintensität an, die maximal an einem Tag erreicht werden kann, und wird im Internet und in Tageszeitungen veröffentlicht. Je höher der UV-Index ist, desto höher ist die UV-B-Strahlungsintensität. Mit steigender UV-B-Strahlungsintensität kann bis zu einem gewissen Grad auch mehr Vitamin D gebildet werden, es steigt aber auch das Risiko für schädliche Gesundheitsfolgen. In Deutschland wird allerdings ca. sechs Monate im Jahr ein UV-Index von 3 unterschritten und eine ausreichende Vitamin-D-Synthese ist damit nicht gewährleistet [24]. Die Exposition des Körpers in Badebekleidung mit einer minimalen Erythemdosis (MED) Sonnenstrahlung – jener UV-Dosis, die eine gerade sichtbare Hautrötung hervorruft – entspricht nach Schätzungen in etwa der oralen Einnahme von 10 000 bis 25 000 IE Vitamin D [12]. Deshalb wird von einigen Autoren die Exposition von ca. 25 % der Körperoberfläche (z. B. Hände, Arme und Gesicht) zwei- bis dreimal pro Woche mit einer Dosis von bis zu einem Drittel oder der Hälfte der MED im Frühjahr, Sommer und Herbst als ausreichend angesehen, um eine suffiziente Vitamin-D-Versorgung zu gewährleisten [12]. Ein Vitamin-D-Mangel kann aber auch durch eine verminderte intestinale Adsorption, erworbene und angeborene Störungen des Vitamin-D-Metabolismus sowie eine Vitamin-D-Resistenz ausgelöst werden.
Auch eine orale Vitamin-D-Supplementierung ist in Risikogruppen wie der deutschen Bevölkerung zur Prävention des Vitamin-D-Mangels effektiv. Obwohl es auch hierzu keine einheitliche Meinung gibt, wurden in einem Konsensus-Meeting 2012 in Frankfurt gewichtsadaptierte Empfehlungen erarbeitet [4, 5] (Tabelle 1). Zur Therapie des Vitamin-D-Mangels kann bei Erwachsenen die wöchentliche Gabe von 50 000 IU Vitamin D3 (oder Vitamin D2) über acht Wochen empfohlen werden, alternativ die tägliche Gabe von 6 000 IE Vitamin D3 (oder Vitamin D2), um einen 25(OH)D-Serumwert über 75 nmol/l (30 ng/ml) zu erreichen. Anschließend sollte eine Erhaltungstherapie mit 1 500 – 2 000 IU/d Vitamin D3 (oder Vitamin D2) durchgeführt werden (Tabelle 2) [15]. Die Empfehlungen für andere Bevölkerungsgruppen sind ebenfalls in Tabelle 2 zusammengefasst.
Vitamin-D-Versorgung in Deutschland
Zur Beurteilung der Versorgungslage mit Vitamin D stehen in Deutschland neben den oben aufgeführten Daten zur Vitamin-D-Zufuhr über die Ernährung Daten zur Konzentration von 25(OH)D im Serum zur Verfügung. In repräsentativen deutschlandweiten Studien des Robert Koch-Instituts zur Vitamin-D-Versorgung in Deutschland wurden die 25(OH)D-Konzentrationen im Serum bei 3 917 Erwachsenen im Alter von 18 bis 79 Jahren sowie von 10 015 Kindern und Jugendlichen im Alter von 1 bis 17 Jahren gemessen (Tabelle 3) [3, 10, 11].
Die mediane Serumkonzentration von 25(OH) D betrug bei den Kindern und Jugendlichen 41,8 nmol/l und bei den Erwachsenen 44,9 nmol/l. Die 25(OH)D-Konzentrationen unterliegen einer großen saisonalen Abhängigkeit, sie sind im Bevölkerungsdurchschnitt niedriger im Winter als im Sommer. Im Winter reichten die Anteile einer 25(OH)D-Konzentration unter 50 nmol/l von ca. 50 % bei 1- bis 2-Jährigen über 60 % bei 18- bis 79-Jährigen bis zu über 80 % bei 11- bis 17-Jährigen.
Bei 186 Bewohnern zweier Pflegeheime in Nürnberg (mittleres Alter 85,5 ± 8 Jahre) lag die mediane Serumkonzentration von 25(OH)D bei 20,8 nmol/l. Blutwerte unter 25 nmol/l wurden bei 68 % der Bewohner festgestellt, Werte unter 50 nmol/l bei 91 %. Lediglich 4 % hatten Werte über 75 nmol/l (Tabelle 4) [3, 16].
Schlussfolgerungen
Ein bewusstes Verhalten gegenüber der Sonne ist wichtig für die Gesundheit. Nach dem heutigen wissenschaftlichen Kenntnisstand überwiegen bei einer maßvollen Sonnenlichtbestrahlung deren positive (u. a. durch Vitamin-D-Synthese) gegenüber den negativen (mutagenen) Effekten, denn zur körpereigenen (kutanen) Vitamin-D-Bildung wird beim Menschen ausreichend UV-B-Strahlung benötigt. Ein Vitamin-D-Mangel ist mit gravierenden gesundheitlichen Risiken verbunden. Daher ist es wichtig, die Haut regelmäßig UV-Strahlung auszusetzen.
Allerdings kann UV-Strahlung und hier insbesondere die UV-B-Strahlung zu Sonnenbrand führen und das Hautkrebsrisiko erhöhen. Dauerhafte hohe UV-Intensitäten sind daher zu meiden. Zur Mittagszeit zwischen 11 Uhr und 15 Uhr ist besondere Vorsicht geboten. Ganz wichtig: Hautrötung (Sonnenbrand) ist unbedingt zu vermeiden. In den meisten Regionen genügt eine kurzzeitige und begrenzte Sonnenlichtexposition, um ausreichend hohe Vitamin-D-Spiegel zu erzielen. In Deutschland genügt es für die Bildung ausreichender Vitamin-D-Mengen, wenn man von April bis September Hände, Arme und Gesicht unbedeckt und ohne Sonnenschutz zwei- bis dreimal pro Woche einem Drittel bis der Hälfte der sonnenbrandwirksamen UV-Dosis aussetzt. Menschen mit dem in Deutschland häufigsten Hauttyp II würden bei einem UV-Index von 8 innerhalb von etwa 20 Minuten einen Sonnenbrand bekommen. Dementsprechend müssten sie sich für eine ausreichende Vitamin-D-Bildung nur etwa sechs bis zehn Minuten in der Sonne aufhalten. In der Mittagszeit zwischen 11 und 15 Uhr kann dies bereits durch kurze Aufenthalte im Freien – z. B. bei einem kurzen Spaziergang in der Mittagspause – erreicht werden. Bei längeren Aufenthalten in der Sonne werden Sonnenschutzmaßnahmen entsprechend dem individuellen Hauttyp und dem UV-Index empfohlen.
Der Vitamin-D-Spiegel sollte insbesondere in solchen Bevölkerungsgruppen regelmäßig kontrolliert werden, die aufgrund fehlender oder zu geringer UV-Bestrahlung ein hohes Risiko für die Entwicklung eines Vitamin-D-Mangels haben (z. B. bettlägerige Menschen in Pflegeheimen, Menschen mit Hauttyp I, traditionell verschleierte Menschen oder Patienten, die unter immunsuppressiver Behandlung einen konsequenten Sonnenschutz betreiben müssen).
Einem bestehenden, ärztlich diagnostizierten Vitamin-D-Mangel ist mit geeigneten ärztlich kontrollierten Therapien zu begegnen, z. B. durch orale Vitamin-D-Substitution. Die einmal wöchentliche orale Gabe von 50 000 IE über insgesamt acht Wochen stellt eine effiziente und sichere Methode zur Behandlung des Vitamin-D-Mangels dar. Eine Maßnahme zur Sicherstellung einer ausreichenden Vitamin-D-Versorgung, besonders bei bettlägerigen Patienten in Pflegeheimen, besteht in der monatlichen Gabe von 50 000 IE Vitamin D.
Prof. Dr. med. Jörg Reichrath
Interessenkonflikte: Der Autor hat keine deklariert.
Auf unserem CME-Portal www.med-etraining.de können Sie ab dem 8.9.2014 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Der Allgemeinarzt, 2014; 35 (14) Seite 16-22