Die chronisch-entzündliche Darmerkrankung Morbus Crohn ist heute gut behandelbar – wenn auch nach wie vor nicht heilbar. Welche Therapien sich eignen, um die Beschwerden des Patienten zu bessern, hängt stark davon ab, wie schwer welche Teile seines Verdauungstraktes betroffen sind. In besonders schweren Fällen kann auch eine Operation notwendig sein. Die wichtigsten Op.-Indikationen und -strategien hier im Überblick.
Eine 23-jährige Patientin mit Morbus Crohn und multiplen medikamentösen Vor-Therapien (u.a. Azathioprin, Adalimumab, Infliximab), aktuell unter 30 mg/die Prednisolon, wird konsiliarisch chirurgisch vorgestellt. Es liegt ein Gewichtsverlust von 10 kg in acht Wochen und eine Subileus-Symptomatik vor. Die Entzündungsparameter sind mäßig erhöht (CRP = 80 mg/L) und es besteht eine ausgeprägte Hypalbuminämie von 18 g/L. Im MR-Sellink zeigt sich eine längerstreckige (ca. 10 cm), entzündliche Stenose ileozökal mit kleinem mesenterialen Abszess bei V.a. Fistel und mit konsekutiver Dilatation des vorgeschalteten Darms.
Interdisziplinär wird nun das weitere Procedere bei therapie-refraktärer Situation und zunehmender klinischer Verschlechterung festgelegt: Nach antibiotischer Therapie mit Ciprofloxacin und Metronidazol und nach Reduktion der Prednisolon-Dosis auf < 10 mg/die wird eine laparoskopische Ileozökalresektion mit Resektionsstomaanlage durchgeführt, woraufhin sich der Zustand der Patientin rasch konsolidiert und das Resektionsstoma bei deutlich verbesserter Ernährungssituation nach acht Wochen zurückverlegt wird.Die Op.-Indikationen bei Morbus Crohn können in relative und absolute sowie je nach klinischer Dringlichkeit in (semi-)elektive und notfallmäßige unterteilt werden. Allerdings sind die Übergänge hier fließend.
Relative Op.-Indikationen
Zu den relativen Op.-Indikationen zählen interenterische und perianale Fisteln, Stenosen und Abszesse, die primär interventionell drainierbar sind, sowie niedriggradige Dysplasien. Bei Vorliegen einer relativen Op.-Indikation sollte der Patient sorgfältig auch über Alternativen aufgeklärt werden.
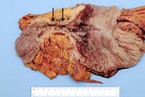
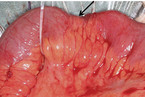
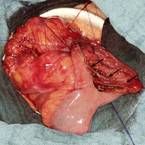
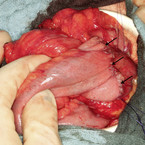
Laut deutscher Leitlinie kann beispielsweise bei medikamentös ausgereizter Dünndarmstenose < 5 cm entweder eine endoskopische Dilatation (sofern diese endoskopisch zugänglich ist) oder die chirurgische Sanierung mit dem Patienten besprochen werden. Bei Stenosen ≥ 5 cm (vgl. Abb. 1 und 2) empfiehlt die Leitlinie eine chirurgische Therapie, entweder im Sinne einer Resektion oder einer Strikturoplastik. Zudem sollte der Patient bei isoliertem Ileozökalbefall über die Möglichkeit einer primären Operation, auch vor Eskalation der medikamentösen Therapie, aufgeklärt werden, da über 80 % mit einem derartigen Befall ohnehin in der Folge operiert werden müssen und über die Hälfte der resezierten Patienten dann langfristig rezidivfrei bleiben [1, 2, 3]. Zudem ist die Morbidität der Op. sehr gering, potenziell nebenwirkungsreiche immunsuppressive Therapien können beendet werden. Die Lebensqualität bessert sich in der Regel rasch – im Gegensatz zur medikamentösen Therapieeskalation.
Relative Op.-Indikationen
Absolute Op.-Indikationen stellen hochgradige Dysplasien, Karzinome, Kolonstenosen unklarer Dignität und bestimmte Fisteln (enterovesikale, retroperitoneal blind endende, enterokutane, stark sezernierende und hohe Fisteln mit resultierendem Kurzdarmsyndrom) sowie Notfälle wie Perforation, Blutung, toxisches Megakolon oder konservativ frustran therapierter Ileus dar [4]. Intraabdominelle oder pelvine Abszesse sollten zunächst antibiotisch therapiert und interventionell (oder chirurgisch) drainiert werden, da hierdurch die Rate an Stomaanlagen sowie die postoperative Morbidität gesenkt werden können [5, 6]. Anschließend muss die Op.-Indikation zeitnah reevaluiert werden, da das Risiko eines Rezidivabszesses bei über 50 %
liegt, die Abszess-Ursache häufig eine blind endende Fistel ist und die meisten der Patienten unter Immunsuppression stehen, was die Gefahr einer Sepsisentstehung naturgemäß erhöht [7, 4].
Op.-Zeitpunkt
Die Wahl des Op.-Zeitpunktes wird durch die "Härte" der Indikation (relativ versus absolut), die Beeinträchtigung der Lebensqualität, den Allgemein- bzw. Ernährungszustand des Patienten sowie die aktuelle medikamentöse Therapie beeinflusst. Postoperative lokalseptische Komplikationen sind bei schlechtem Ernährungszustand des Patienten (Albumin < 30 g/L), intraabdominellen Abszessen und immunsuppressiver Therapie erhöht [8]. Daher sollten diese Prädiktoren postoperativer Morbidität möglichst präoperativ adressiert werden. So lässt sich der Ernährungszustand des Patienten durch präoperative enterale und ggf. auch parenterale Zusatzernährung verbessern, intraabdominelle Abszesse sollten drainiert und Steroide reduziert werden (< 20 mg/die Prednisolon oder Äquivalenzdosen anderer Steroide). Auch wenn die bisherige Evidenz widersprüchlich ist, so finden sich in der Literatur doch eindeutige Hinweise darauf, dass insbesondere auch Biologika die perioperative Komplikationsrate erhöhen [9 – 12]. In unserer Klinik werden deshalb präoperativ – sofern keine Notfallindikation vorliegt – Steroide auf < 10 mg/die reduziert, das Albumin auf ≥ 30 g/L gesteigert und Biologika (anti-TNF-α-Antikörper) mindestens vier Wochen pausiert.
Op.-Strategie
Da der Morbus Crohn chirurgisch nicht heilbar ist (Ausnahme "Quasiheilung" in gut 50 % nach Ileozökalresektion bei isolierten ileozökalem Befall, siehe neue deutsche Leitlinie), sollte stets nur eine limitierte Resektion oder noch besser, wenn anwendbar, eine Strikturoplastik erfolgen, damit der Patient so wenig Darm wie möglich verliert. Neuere Strikturoplastiktechniken erlauben die Anwendung dieser darmerhaltenden Operationstechnik auch bei langstreckigen Stenosen (bis über 50 cm!) [13]. Nur wenn ein Karzinom vorliegt, ist die radikale onkologische Resektion analog zum Vorgehen beim sporadischen Karzinom indiziert. Malignitätsverdacht und unklare Kolonstenosen sind absolute Kontraindikationen, Darmphlegmone/-fistel und verdickte und fibrosierte Darmwand sowie massive Darmdilatation stellen relative Kontraindikationen für eine Strikturoplastik dar [14].
Laut aktueller Leitlinie kann Patienten mit Crohn-Kolitis, bei denen weder ein perianaler noch ein Dünndarmbefall vorliegt, die Proktokolektomie mit ileoanaler Pouchanlage angeboten werden [4]. Bei derartigen Patienten mit isoliertem Kolonbefall ist das Risiko einer chronischen Pouchitis oder eines Pouchversagens im Vergleich zu Colitis-ulcerosa-Patienten nicht erhöht [15].
Bei Patienten in schlechtem Allgemein- und Ernährungszustand, unter immunsuppressiver Therapie sowie bei Vorliegen einer Notfallindikation ist die Komplikationsrate deutlich erhöht, weswegen potenziell sicherere Eingriffe durchgeführt werden sollten, also entweder eine Diskontinuitätsresektion erfolgen oder zumindest ein protektives Stoma einer primären Anastomose vorgeschaltet werden sollte [4]. Weil bei komplexen Operationen bei Morbus Crohn die Mortalität einer operativen Therapie von der Fallzahl signifikant abhängig ist, sollten diese Patienten nach aktueller Leitlinie von CED-erfahrenen Chirurgen in Zentren behandelt werden. Bei perianalen Crohnmanifestationen: Asymptomatische Fisteln sollten nur in Ausnahmefällen chirurgisch therapiert werden. Vor Beginn einer konservativen Fisteltherapie muss ein Abszess ausgeschlossen bzw. drainiert sein. Komplexere Fisteln sollten in der Regel nicht gespalten, sondern mit einer Fadendrainage versorgt werden [4].
Op.-Technik
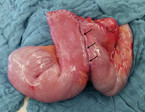
In randomisiert kontrollierten Studien ergab sich weder zwischen Seit-zu-Seit- (Abb. 3: breite Seit-zu-Seit-Anastomose) und End-zu-End-Anastomose noch zwischen Hand- und Klammernaht ein Unterschied hinsichtlich Rezidiv- und Komplikationsrate [16, 17], so dass die Anastomosentechnik letztendlich der Präferenz des Chirurgen obliegt. In unserer Klinik führen wir mittlerweile häufig eine Kono-S-Anastomose durch (Abb. 4 und 5), die einer antimesenterialen funktionellen End-zu-End-Handnaht entspricht und den Vorteil hat, dass sie breit angelegt, aber bei Stenose auch gut endoskopisch dilatiert werden kann, was bei den Seit-zu-Seit-Anastomosen oft technisch schwierig ist [18].
Minimal-invasive Chirurgie (MIC)
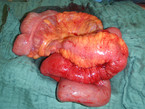
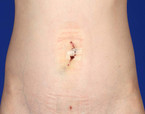
Ausgedehnte abdominelle Voroperationen, das Vorhandensein eines Konglomerattumors (Abb. 6) oder eines ausgeprägten interenterischen Fistelsystems, Malignitätsverdacht und ein schlechter Allgemeinzustand, der eine möglichst geringe Op.-Zeit besonders erstrebenswert macht, stellen mittlerweile nur noch relative Kontraindikationen für ein minimal-invasives Vorgehen dar. Bei Dünndarm- und Ileozökalresektionen wird die minimal invasive Operationstechnik mittlerweile explizit empfohlen, da hochwertige Studien, neben der offensichtlich besseren Kosmetik (Abb. 7), Vorteile im postoperativen Verlauf gegenüber einem konventionell offenen Vorgehen belegt haben [19]. Auch bei Rezidiven und in komplexen Fällen kann – bei Vorliegen adäquater Expertise in der minimal-invasiven Chirurgie – gemäß aktueller Leitlinie ein laparoskopisches Vorgehen gewählt werden, weil hier Vorteile in der frühen postoperativen Phase (u. a. kürzere Verweildauer) bei gleicher Komplikationsrate gezeigt worden sind [20, 21]. In der eigenen Klinik klären wir – sofern kein größerer Konglomerattumor vorliegt – prinzipiell über die Option des laparoskopischen Zugangs auf, konvertieren jedoch frühzeitig, falls ein minimal-invasives Vorgehen z. B. aufgrund von schweren Verwachsungen nicht oder nur unter erhöhtem Risiko möglich ist. Auch die Op. über einen einzelnen größeren Trokar ("single incision surgery") kann beim Morbus Crohn eingesetzt werden. Allerdings liefert die bisherige Evidenz keinen Hinweis auf einen Vorteil gegenüber dem konventionell laparoskopischen Zugang [22].
- Absolute Op.-Indikationen sind: hochgradige Dysplasien, Karzinom, Kolonstenosen unklarer Dignität, enterovesikale, retroperitoneal blind endende, enterokutane, stark sezernierende und hohe Fisteln mit resultierendem Kurzdarmsyndrom sowie Notfälle wie Perforation, Blutung, toxisches Megakolon oder konservativ frustran therapierter Ileus.
- Patienten mit komplexer Erkrankung sollten interdisziplinär diskutiert und chirurgische Optionen frühzeitig im Behandlungskonzept berücksichtigt werden.
- Komplexe Operationen sollten ausschließlich von CED-erfahrenen Chirurgen in Zentren durchgeführt werden.
- Bei isoliertem Ileozökalbefall ist die chirurgische Therapie gegenüber einer Eskalation der medikamentösen Behandlung als gleichwertig zu betrachten.
- Mit Ausnahme von onkologischen Indikationen sollten stets limitierte Resektionen oder Strikturoplastiken erfolgen; Kolonstenosen sollten nur in Ausnahmefällen mittels Strikturoplastik behandelt werden.
- MIC stellt mittlerweile das Standardverfahren dar und kann bei Vorliegen entsprechender laparoskopischer Expertise auch bei komplexen Befunden und voroperierten Patienten zum Einsatz kommen.
Interessenkonflikte: Die Autoren haben keine deklariert.
Erschienen in: Der Allgemeinarzt, 2016; 38 (14) Seite 44-47