Die Colitis ulcerosa ist eine kontinuierliche Mukosaentzündung, die mindestens das Rektum betrifft. Wegen des meist schubförmigen Verlaufes sollte eine optimale Therapie sowohl eine effektive Schubbehandlung (Remissionsinduktion) als auch eine Therapie zum Remissionserhalt umfassen. Dabei kommt den Aminosalicylaten eine herausragende Stellung zu.
Die Colitis ulcerosa betrifft insbesondere junge Menschen zwischen dem 20. und 30. Lebensjahr und ist mit etwa 200 000 Betroffenen in Deutschland neben dem Morbus Crohn die wichtigste chronisch entzündliche Darmerkrankung. Um die aktuelle Diagnostik und Therapie evidenzbasiert und praxisrelevant zusammenzufassen, wurde die bestehende S3-Leitlinie 2011 aktualisiert [1]. Für spezielle Fragestellungen kann auf die noch ausführlichere europäische Leitlinie zur Colitis ulcerosa der European Crohn’s and Colitis Organisation (ECCO) zurückgegriffen werden [2].
Zur Diagnostik gehören Laborwerte (z. B. Blutbild, C-reaktives Protein [CRP], alkalische Phosphatase – zur Erkennung einer in bis zu 10 % der Fälle assoziierten primär sklerosierenden Cholangitis), Bildgebung (z. B. Sonografie) und die Ileokoloskopie mit Biopsieentnahme.
Differenzialdiagnostisch sind infektiöse Darmerkrankungen und der Reizdarm abzugrenzen (Stuhlkulturen, Stuhluntersuchungen auf Clostridien, virologische Diagnostik [Zytomegalievirus]).
In der Verlaufsdiagnostik kommen insbesondere Blutbild, CRP, Stuhl-Calprotectin und Sonografie zum Einsatz. Die Endoskopie spielt in der Verlaufsroutine zunächst keine Rolle. Allerdings ist sie im Rahmen der Karzinomvorsorge ab Jahr 8 sehr wichtig, da das kolorektale Karzinomrisiko bei Patienten mit Colitis ulcerosa im Vergleich zur Normalbevölkerung erhöht ist. Anschließende Überwachungskoloskopien sollten, je nach Erkrankungsausdehnung, ab Jahr 8 (ausgedehnte Colitis) oder 15 (Linksseitencolitis) nach Erstmanifestation 1- bis 2-jährlich erfolgen.
Therapeutisches Vorgehen
Der akute Schub einer Colitis ulcerosa präsentiert sich zumeist mit blutiger Diarrhoe, Tenesmen und imperativem Stuhldrang. Zur Remissionsinduktion wird eine Kombination aus oral und rektal angewandten 5-Aminosalicylaten (5-ASA, Mesalazin) empfohlen, wobei einer täglichen Einmalgabe oraler retardierter Präparate gegenüber nicht-retardierten der Vorzug gegeben werden sollte. Bei ausschließlich leichter bis mäßiger Proktitis kann eine alleinige topische Anwendung von 5-ASA ausreichend sein.
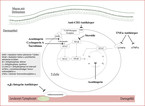
Bei fehlendem Ansprechen auf die genannte Therapie und insbesondere bei ausgedehntem Befall sollte eine systemische Steroidtherapie (0,5 – 1 mg Prednisolonäquivalent/kg Körpergewicht/Tag) verabreicht werden. Bei besonders schweren Schüben (stationäre Behandlung erforderlich) stehen derzeit die Calcineurinantagonisten Tacrolimus und Cyclosporin A (beide allerdings ohne Zulassung, daher nur stationär) und als Reservetherapie die anti-TNFα-Antikörper (insbesondere Infliximab) zur Verfügung (vgl. Abb. 1).
Auch in der Remissionserhaltung stellen Aminosalicylate einen Grundpfeiler der Therapie dar, wobei sich die Applikationsart nach dem Befallsmuster orientieren sollte (primär topische Therapie der Proktitis und distalen Colitis). Die remissionserhaltende Therapie ist für mindestens zwei Jahre durchzuführen. Da sie wahrscheinlich die Häufigkeit Colitis-assoziierter Karzinome im Verlauf senkt, wird eine Therapie mit Aminosalicylaten i. d. R. dauerhaft gegeben.
Eine stufenweise Eskalation sollte bei häufigen oder schweren Schüben erfolgen. Hierfür bestehende Möglichkeiten sind neben einer oral/rektalen Kombinationstherapie mit Aminosalicylaten und deren Dosiserhöhung eine Therapie mit Azathioprin (2,5 mg/kg Körpergewicht/Tag), mit einem der anti-TNFα-Antikörper (Infliximab, Adalimumab, Golimumab) oder dem anti-α4β7-Integrin-Antikörper Vedolizumab. Kortikosteroide haben in der Dauertherapie keinen Stellenwert.
Bei besonders schweren und refraktären Verläufen ist die Proktokolektomie mit Anlage eines ileoanalen Pouches eine exzellente Alternative. Sie sollte immer beim Nachweis von Colitis-assoziierten Karzinomen, hochgradigen Dysplasien oder Dysplasie-assoziierten Läsionen (DALMs) durchgeführt, aber auch bei medikamentös therapierefraktärem Schub und entsprechenden Komplikationen diskutiert werden.
Was gilt es zu beachten?
Das Risiko opportunistischer Infektionen und der Reaktivierung latenter Infektionen ist unter immunsupprimierender Therapie erhöht, sodass spätestens vor Beginn einer solchen eine Hepatitis-B-Infektion und eine Tuberkulose auszuschließen sind sowie eine suffiziente Therapie einer möglichen CMV- oder Clostridium-difficile-Erkrankung zu erfolgen hat. Auch der Impfstatus muss spätestens vor Einleitung einer Immunsuppression überprüft und gemäß den Empfehlungen des RKI ergänzt werden. Lebendimpfungen unter immunsupprimierender Therapie sind kontraindiziert.
Die Immunsuppression bedeutet nicht nur eine Infektionsgefahr, sondern auch – gerade bei Thiopurinanaloga, Calcineurinantagonisten und bei anti-TNFα-Antikörpern – höhere Raten an Hautkrebs und Epstein-Barr-Virus-assoziierten Non-Hodgkin-Lymphomen (letztgenannte nicht unter anti-TNFα-Antikörpern). Daher sollten ein konsequenter Sonnenschutz und jährliche dermatologische Untersuchungen erfolgen.
Therapie der Zukunft
Aufgrund der beschriebenen Nebenwirkungen einer dauerhaft immunsuppressiven Therapie und aufgrund therapieresistenter Verläufe mit hohen Rezidivraten sind neue Therapiestrategien gefragt, wobei auf die Wiederherstellung der gestörten mukosalen Barrierefunktion vermehrt Augenmerk gelegt wird.
Mutaflor® (E.coli Nissle) zeigte in Studien als einziges Probiotikum eine vergleichbare Wirkung zu Mesalazin im Rahmen der Remissionserhaltung [1], kommt jedoch aufgrund der weniger umfangreichen Studienlage nicht primär zur Anwendung. Auch die externe Zufuhr von Phosphatidylcholin, einem wichtigen Bestandteil des Mukus, zeigte in mesalazinrefraktären Verläufen eine gute Verbesserung der Krankheitsaktivität [3]. Für VSL#3® (Milchsäure- und Bifidobakterien) existieren lediglich positive Studienergebnisse in der Anwendung zusätzlich zur konventionellen Therapie [4].
Aufbauend auf weiterführenden Erkenntnissen zur Pathophysiologie der Erkrankung gelangen immer mehr hochspezifische Substanzen in die Testphasen, so beispielsweise anti-CD2-Antikörper, die allerdings bisher nur im humanisierten Tierversuch getestet wurden [5]. Weitere neue Formen des Targeting sind Thema multipler Forschungsgruppen, wobei insbesondere die Suche nach molekularen Angriffspunkten, wie man sie in der Onkologie bereits kennt, bislang nicht erfolgreich war. Unabhängig hiervon könnte der Calcineurinantagonist Tacrolimus, ein bisher nur in der Induktionstherapie verwendetes Medikament, auch in der Remissionserhaltung interessant werden, vorausgesetzt, es kämen doch noch Zulassungsstudien auf den Weg. Weitere Bestrebungen zielen auf verbesserte Applikationsformen ab. So ist neben dem bisher nur für die intravenöse Applikation zugelassenen Vedolizumab eine Studie für die subkutane Gabe in Planung. Als weiterer anti-α4β7-Integrin-Antikörper zeigte sich zuletzt Etrolizumab bei Patienten mit Colitis ulcerosa als wirksam, auch wenn dieser Antikörper bisher nicht zugelassen ist [6].
Interessenkonflikte: J. C. Hoffmann: Vortragshonorare durch die Falk Foundation, durch AbbVie, MSD und Takeda.
Erschienen in: Der Allgemeinarzt, 2015; 37 (14) Seite 37-40