Die Anzahl an Patienten, die Fragen zum Prostatakrebs in der allgemeinärztlichen Praxis haben, steigt stetig an. Informationsbedarf besteht nicht nur bei der PSA-basierten Vorsorge, sondern vor allem bei den inzwischen recht differenzierten Therapiemöglichkeiten. Heutzutage stehen außer der Operation und der Standard-Strahlentherapie neue Applikationen der Strahlentherapie, fokale, bildgestützte Therapien und last not least die Aktive Überwachung zur Verfügung.
Durch den demographischen Wandel ist eine weitere Zunahme der jährlichen ca. 70.000 Prostatakarzinomfälle zu erwarten. Gleichzeitig besteht für die frühen, gut differenzierten Formen des Prostatakarzinoms eine nur geringe Morbidität und Mortalität. Daher hat die allgemeinärztliche Einschätzung der bestehenden Komorbiditäten bei Patienten mit niedrigem Risiko und die daraus abgeleitete Überlebenswahrscheinlichkeit innerhalb der nächsten 10 – 15 Jahre einen sehr hohen Einfluss auf die Therapieentscheidungen bei der Prostatakrebsbehandlung.
Durch unterschiedliche Arbeiten zeigte sich, dass bei Niedrig-Risikopatienten die geringe krebsspezifische Mortalität in den Hintergrund tritt und Komorbiditäten unabhängig vom Alter einen größeren Einfluss auf die Prognose haben [1].
Wie sinnvoll ist das PSA-Screening?
In der Vergangenheit bestanden Unklarheiten zur onkologischen Sinnhaftigkeit der PSA-basierten Prostatakarzinom-Früherkennung, die in Deutschland eine IGeL-Leistung darstellt. Verursacht wurden diese Zweifel durch die erhöhte Detektion nicht-signifikanter Tumoren mit der Gefahr der Übertherapie, die Einschränkung der Lebensqualität der Patienten und die damit verbundenen Therapiekosten.
Durch die PLCO-Studie (Prostate, Lung, Colorectal and Ovarian Cancer Screening Trial), eine große US-amerikanische Screening-Studie, wurden diese Bedenken weiter verstärkt, da diese multizentrische Studie im Gegensatz zu einer ähnlich konzipierten europäischen Screening-Studie keinen signifikanten Vorteil des PSA-Screenings nachwies [2].
Nähere Betrachtungen der US-amerikanischen PLCO-Studie zeigten jedoch einen ausgeprägten methodologischen Bias der Studie, durch den die Wertigkeit der Ergebnisse komplett in Frage gestellt wurde. So besteht die PLCO-Studie aus zwei Armen, wobei im einen Arm regelmäßiges PSA-Screening, im anderen Arm jedoch keine Kontrollen durchgeführt wurden.
Da die US-amerikanische PLCO-Studie trotz ihrer hohen Patientenzahl konträre Ergebnisse im Vergleich zur europäischen ERSPC-Studie zeigte, wurden nähere Analysen der PLCO-Studie durchgeführt. Diese ergaben eine sehr hohe Kontaminationsrate im Kontrollarm. Obwohl diese Patienten eigentlich keine Information über ihren PSA haben sollten, wurden bei 85 % der Patienten in der Kontrollgruppe trotzdem PSA-Wert-Bestimmungen durchgeführt [3].. Durch diese Verletzung des Studiendesigns der US-amerikanischen Studie sind die Abweichungen der Ergebnisse von denjenigen der europäischen multizentrischen ERSPC-Studie zu erklären.
Die europäische Studie zum PSA-Screening (ERSPC; n = 162.243) zeigte hingegen eine signifikante Senkung (21 %) der prostatakrebsspezifischen Mortalität [4]. Ein aktuelles Update ergab dabei, dass mit längerem Follow-up die Number-needed-to-treat (27) und die Number-needed-to-screen (781) weiter sinken und tatsächlich auf dem Niveau der Zahlen beim Brustkrebsscreening liegen [5, 6].
Individuell beraten!
Da das Prostatakarzinom vornehmlich bei älteren Patienten auftritt, ist die Berücksichtigung bestehender Komorbiditäten und die genaue Aufklärung des Patienten über das Risiko und den Nutzen einer PSA-Kontrolle von höchster Bedeutung [7] (vgl. Tabelle 1). Hierbei sollte insbesondere die PSA-Dynamik beobachtet werden und immer auch eine digital-rektale Tastuntersuchung (DRU) erfolgen. Sollte sich im Rahmen einer PSA-Untersuchung die Indikation zur Stanzbiopsie stellen, so erfolgt in der Regel die Überweisung zum Spezialisten. Eine ASS-Therapie kann bei Biopsien in der Regel bei geringem, aber gut vertretbarem Risiko fortgeführt werden.
Definitive Therapieformen
Für das weitere strukturierte Vorgehen im hausärztlichen Bereich sind Kenntnisse über die Vor- und Nachteile der verschiedenen Therapieformen, insbesondere bei aktiver Überwachung (AS) und fokaler Therapie, sowie über die weitere Nachsorge notwendig.
Bei der Wahl einer definitiven Therapie bei intermediären oder aggressiven Prostatakarzinomen gilt in der Regel, dass Bestrahlung und Operation insgesamt als gleichwertig anzusehen sind. Dies zeigte eine Langzeitanalyse, in der die krebsspezifische Mortalität bei 1.643 Patienten nach aktiver Überwachung, Operation oder Bestrahlung verglichen wurde (ProtecT Trial) [8]. Insgesamt fehlt für eine abschließende Beurteilung ein längeres Followup. Bei jüngeren, kardiologisch unauffälligen Patienten wird jedoch häufig einer Operation der Vorzug gegeben, da im Falle eines Lokalrezidives eine adjuvante Strahlentherapie weiterhin möglich ist.
Vorgehen bei niedrigem Risiko
Eine besondere Gruppe bilden Patienten mit einem gut differenzierten Tumor (niedriger Gleason-Score: ≤ 6) und einer Niedrig-Risiko-Konstellation (PSA < 10, geringe Anzahl positiver Stanzbiopsien), da solche Tumoren insgesamt eine geringe Aggressivität aufweisen. Dabei ist es jedoch wichtig, die hohe Rate eines Gleason-Understagings zu beachten. Das heißt, dass bei einer Operation im Operationspräparat entgegen der stanzbioptischen Einschätzung doch bei 30 bis 50 % der Patienten aggressivere Tumoranteile vorhanden sind [9 – 13]. Dennoch werden bei einem Großteil dieser häufigen Tumoren aufgrund des nur sehr langsamen Progresses exzellente tumorspezifische Überlebensraten erreicht.
Daher besteht für eine kleine Gruppe der Niedrig-Risiko-Karzinome eine leitlinienkonforme Therapie im konservativen Vorgehen in Form einer aktiven Überwachung (vgl. Tabelle 2). Im Rahmen der aktiven Überwachung wird durch vierteljährliche Kontrolle des PSA-Wertes und zusätzliche Re-Biopsie in definierten Abständen sowie bei unklarem PSA-Anstieg die Durchführung einer definitiven Therapie verzögert bzw. komplett vermieden.
Aktive Überwachung
Durch Aktive Überwachung wird die in erfahrenen Händen zwar geringe, aber dennoch vorhandene behandlungsassoziierte Morbidität einer radikalen Prostatektomie oder Radiatio der Prostata erst dann riskiert, wenn dies onkologisch erforderlich ist.
Ein aktueller Vergleich zwischen Operation, Bestrahlung und Aktiver Überwachung zeigte in der letztgenannten Gruppe vergleichbare Daten bezüglich krebsspezifischer Sterblichkeit. Allerdings war eine höhere Rate an Metastasierung nach AS zu verzeichnen [8]. In 30 – 50 % wird im Verlauf einer AS auf eine definitive Therapie gewechselt, wobei allerdings auch zu beachten ist, dass auch die Verzögerung einer potenziellen Inkontinenz/Impotenz einen großen Gewinn an Lebensqualität bedeutet [14, 15]..
Die Durchführung einer AS beinhaltet unter anderem eine erneute Bestätigungsbiopsie der Prostata, welche meist sechs Monate nach initialer Diagnosestellung durchgeführt werden sollte. In dieser werden bei 20 – 30 % der Patienten ein höherer Gleason-Score oder eine höhere Anzahl von tumortragenden Stanzen nachgewiesen, so dass eine AS nicht mehr indiziert ist. Ebenfalls zu beachten ist, dass gemäß D’Amico-Klassifizierung bei fortgeschrittenem Tastbefund (cT>2a) kein Niedrig-Risiko-Karzinom mehr vorliegt [16].
Bestätigt sich jedoch das Low-volume-Niedrigrisiko-Prostatakarzinom, können dreimonatliche PSA-Kontrollen durchgeführt werden, wobei auch eine DRU erfolgen sollte [7]. Es existieren verschiedene Protokolle bezüglich der Durchführung einer AS, wobei als Hauptsäulen immer die PSA-Kontrollen und die Re-Biopsie gelten (Tabelle 2).
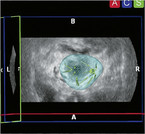
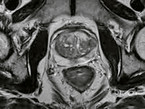
Durch die Fortschritte der Bildgebung per MRT der Prostata kann bei der Biopsie und Fusionsbiopsie eine bessere Charakterisierung des vorliegenden Tumors und Planung der weiteren Therapie erzielt werden.
Möglichkeiten der fokalen Therapie
Als bildgestützte Verfahren existieren neuerdings unterschiedliche Möglichkeiten der fokalen Therapie beim lokal begrenzten Prostatakarzinom in Form von intensiviertem Ultraschall, Kryotherapie oder photodynamischer Therapie (Tabelle 3). Diese Verfahren sind aktuell aufgrund des experimentellen Charakters nur in Studien zugelassen. Die Indikation zur fokalen Therapie besteht allgemein bei Patienten mit frühen Tumoren, die einer invasiven Therapie oder der Strategie der aktiven Überwachung negativ gegenüber eingestellt sind.
Obwohl das Prostatakarzinom ein in der Regel multifokal wachsender Tumor ist, ist ein Vorteil der fokalen Therapie, dass bei einzelnen frühen Formen nicht immer die gesamte Drüse behandelt werden muss. Häufig kann durch die fokale Therapie eine definitive Therapie verhindert oder zumindest verzögert werden. Eine aktuelle Übersichtsarbeit wies dabei gute Kontinenz- und Potenz-Ergebnisse nach (zwischen 83,3 und 100 % sowie zwischen 81,5 und 100 %). Gleichzeitig trat eine nur geringe Komplikationsrate auf [19].
Trotz dieser insgesamt ermutigenden Ergebnisse sollte jedoch stets auf den noch experimentellen Charakter der Verfahren und die bestehenden kurativen Alternativen hingewiesen werden. So besteht neben dem multifokalen Wachstum (in 60 – 80 %) das Problem, dass andere als die mittels MRT grafisch identifizierten Index-Läsionen häufig signifikante Tumoranteile tragen (in bis zu 20 %). Hieraus ergibt sich ein hohes Rezidivrisiko. Darüber hinaus kann trotz aktuell laufender Studien (z. B. PART-Trial) aufgrund der notwendigen Nachbeobachtungszeit aktuell noch keine endgültige Aussage zur onkologischen Sicherheit gemacht werden.
Daher wird in den aktuellen S3-Leitlinien zur Therapie des Prostatakrebses trotz der potenziell guten Verträglichkeit eine eindeutige Empfehlung gegen die Durchführung fokaler Therapien wie z. B. die HIFU-Verfahren (Hochintensiver Fokussierter Ultraschall), Kryotherapie oder Hyperthermie gegeben.
Zusammenfassung
Das Prostatakarzinom erfordert eine enge Zusammenarbeit zwischen dem Hausarzt und dem Spezialisten, da die verschiedenen Komorbiditäten einen großen Einfluss auf alle Therapieentscheidungen haben. Hierbei spielt insbesondere die Einschätzung der Lebenserwartung, die Abklärung etwaiger Gerinnungsstörungen und z. B. die Narkosefähigkeit eine große Rolle.
Zusätzlich wird sich in Zukunft der Allgemeinarzt vermehrt mit Fragen seiner Patienten zur Auswahl der definitiven Therapie konfrontiert sehen. Durch die in der Regel langjährige Kenntnis des Patienten kommt dem Rat des Allgemeinarztes insbesondere bei den langsam wachsenden Niedrig-Risiko-Tumoren eine große Bedeutung zu. Neben den etablierten kurativen Standardverfahren der Radikalen Prostatektomie und Formen der Strahlentherapie hat sich die Aktive Überwachung fest etabliert. Die Sicherheit dieser Überwachungsstrategie ist in unterschiedlichen Serien bereits mehrfach gezeigt worden. Hierdurch kann das Risiko einer in erfahrenen Händen seltenen, aber dann sehr belastenden postoperativen Einschränkung der Lebensqualität nach Prostatektomie oder Bestrahlung durch Inkontinenz/Impotenz reduziert werden. Für die Formen der fokalen Therapie fehlen entsprechende Langzeit- oder Vergleichsstudien, so dass die Anwendung aktuell lediglich als experimentell in Studien empfohlen wird.
Für die Aktive Überwachung spielt die MRT eine große Rolle, da hierdurch eine bessere Risikostratifizierung und der Ausschluss größerer multifokaler Tumoren erreicht werden kann. Dennoch besteht bei der Aktiven Überwachung, insbesondere bei weit gefassten Einschlusskriterien, ein höheres Risiko für das Auftreten von Metastasen, das durch eine präzisere Risikostratifizierung per MRT möglicherweise reduziert werden kann. Dies sollte, insbesondere bei der Therapiewahl bei jüngeren Patienten und beim Vorliegen eines familiären Prostatakarzinoms, beachtet werden. Darüber hinaus besteht bei Patienten, die mit einer Aktiven Überwachung behandelt werden, häufig eine psychische Belastung. Diese wird oft durch die Empfindung verursacht, dass sich ein Tumor im Körper befindet der "unbehandelt" ist. Hieraus kann sich ein erhöhter Betreuungs- und Gesprächsbedarf ableiten. Durch fundierte Kenntnisse über den in der Regel sehr langsamen Verlauf eines Niedrig-Risiko-Prostatakarzinoms, über die Bedeutung der PSA-Überwachung und durch die zusätzliche Sicherheit durch die Prostata-MRT kann meist erreicht werden, dass die aktive Überwachung mit engmaschigen Kontrollen fortgesetzt werden kann.
Interessenkonflikte: Die Autoren haben keine deklariert.
Auf unserem CME-Portal www.kirchheim-forum-cme.de können Sie ab dem 22.5.2018 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Der Allgemeinarzt, 2018; 40 (9) Seite 50-55