Ein Mangel an Vitamin B12 (Cobalamin) ist häufiger als gedacht und bleibt nicht selten unerkannt. In der Allgemeinbevölkerung sind rund 4 % betroffen, in Risikogruppen, vor allem Ältere und Patienten mit chronischen Darmerkrankungen, bis zu 20 % und mehr. Die unspezifischen Symptome eines Vitamin-B12-Mangels wie Blutbildveränderungen, neurologische Störungen oder psychiatrische Auffälligkeiten erschweren die Diagnose. Empfohlen wird deshalb, bei Risikopersonen alle zwei bis drei Jahre den Vitamin-B12-Status zu bestimmen. Was Sie zur Physiologie und Metabolisierung von Vitamin B12, den Symptomen eines Vitamin-B12-Mangels sowie zur Diagnostik, Prävention und Therapie wissen sollten, erfahren Sie in dieser CME-Fortbildung.
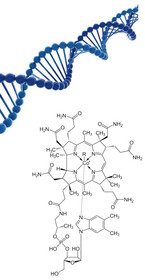
Vitamin B12 (Cobalamin) ist eine Sammelbezeichnung für unterschiedlich substituierte, wasserlösliche Corrinoide. Sie bestehen aus vier Pyrrolringen mit einem zentralen Kobalt-Atom (Abb.1). Die freie Valenz am Kobalt-Atom kann durch eine HO-Gruppe (Hydroxycobalamin), durch NO2 (Nitrocobalamin), durch CN (Cyanocobalamin), durch CH3 (Methylcobalamin) oder 5-Desoxyadenosin (Adenosylcobalamin) substituiert sein. In menschlichen Körperzellen kommen nur Methyl- und Adenosylcobalamin vor, die als Coenzyme für Methylierungsprozesse fungieren [1].
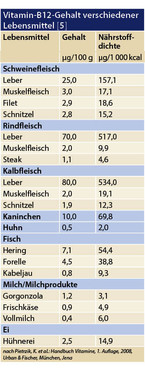
Cobalamin wird ausschließlich von Mikroorganismen gebildet und zählt damit zu den essentiellen Vitaminen, die Menschen mit der Nahrung zuführen müssen. Der Tagesbedarf beträgt für Jugendliche ab 13 Jahren und Erwachsene 3 µg pro Tag (Schwangere 3,5 µg/Tag, Stillende 4 µg/Tag) [2] und ist für die Mehrheit einfach zu decken. Vor allem in tierischen Produkten wie Leber, Fleisch, Milch und Eiern ist Vitamin B12 vorhanden (Tabelle 1).
Über eine für westliche Industrienationen typische Ernährung werden täglich etwa 3 – 30 µg Vitamin B12 aufgenommen [3]. Insgesamt ist deshalb ein alimentärer Mangel an Cobalamin (Gesamt-Vitamin B12 < 200 ng/l bzw. < 150 pmol/l Serum) in der Bevölkerung mit normaler Mischernährung selten. Laut einer aktuellen US-Analyse der Daten von Teilnehmern der NHANES-Studie ab 50 Jahren (ohne Anämie, ohne Makrozytose) hatten rund 4 % einen Vitamin-B12-Mangel [4]. Gefährdet sind allerdings Vegetarier und insbesondere Veganer, denen die Substitution von Vitamin B12 empfohlen wird. Zu beachten ist dabei, dass sich auch bei chronischer Unterversorgung wegen der großen Vitamin-B12-Reservespeicher in unserem Körper (insgesamt 2 – 5 mg, davon 60 % in der Leber) ein Mangel erst allmählich entwickelt und mit einem Auftreten von klinischen Symptomen erst mit einer Verzögerung von fünf bis zehn Jahren zu rechnen ist [3].
Resorption im Darm verläuft sowohl aktiv als auch passiv
Vitamin B12 ist in der Nahrung an Proteine gebunden und wird im Magen unter Einwirkung von Pepsin und Salzsäure aus der Proteinbindung freigesetzt. Die Resorption im Darm verläuft sowohl aktiv als auch passiv über Diffusion. Zunächst wird Cobalamin im Magen an von der Magenschleimhaut sezernierte Glykoproteine gebunden, im sauren Milieu des Magens zum größten Teil an das Transportprotein Haptocorrin, zum geringeren Teil an den Intrinsic Factor (IF). Im Duodenum wird Cobalamin durch Pankreasenzyme aus der Verbindung mit dem Transportprotein freigesetzt. Jetzt beginnt, abhängig von der Menge an verfügbarem Vitamin B12, die passive Aufnahme durch Diffusion. Je mehr Cobalamin vorliegt, desto stärker ist die Diffusion. Rund 1 – 5 % des freien Cobalamins werden durch die passive Diffusion über die Darmschleimhaut resorbiert [3, 5].
Gleichzeitig wird Cobalamin im Dünndarm mit seinem alkalischen pH-Wert an IF gebunden. Im distalen Abschnitt des Ileums wird dieser Komplex aktiv durch Bindung an die Cubilin-Rezeptoren der Mukosazellen aufgenommen. Abhängig von der Dichte der Rezeptoren werden täglich maximal 1,5 µg Cobalamin über diesen Weg aufgenommen [5]. Dies bedeutet, dass bei hoher Verfügbarkeit von Vitamin B12, zum Beispiel im Rahmen einer oralen Substitutionstherapie, mehr Cobalamin passiv als aktiv resorbiert wird.
Ans Blut und in die Körperzellen wird Vitamin B12 in Bindung an das Transportprotein Transcobalamin II übertragen. In den Lysosomen wird Transcobalamin II abgebaut. Das freigesetzte Cobalamin wird im Cytoplasma in Methylcobalamin, in den Mitochondrien in Adenosylcobalamin umgewandelt [1, 5].
Cofaktor von Methylierungsprozessen
Methylcobalamin ist Cofaktor der Methionin-Synthase und dient der Umwandlung von Homocystein zu Methionin, das für die Biosynthese von Folsäure benötigt wird. Bei einem Mangel an Methylcobalamin häuft sich Homocystein an, das in hohen Konzentrationen mit einem erhöhten kardiovaskulären Risiko assoziiert ist. Außerdem akkumuliert das Derivat Methyl-Tetrahydrofolat (Me-THF), so dass ein funktioneller Folatmangel entsteht. Ein Mangel an Vitamin B12 und an Folsäure beeinträchtigt die Bildung von Purinbasen und Thymidin, Bestandteile von Nukleosiden, die für die DNA- und RNA-Synthese benötigt werden. Infolgedessen ist die Zellvermehrung gestört [5]. Adenosylcobalamin ist Cofaktor der Methylmalonyl-CoA-Synthase und wandelt Methylmalonyl-CoA in Succinyl-CoA um, das unter anderem im Zitronensäurezyklus, der Drehscheibe des Stoffwechsels, eine wesentliche Rolle spielt. Adenosylcobalamin wird unter anderem für die Proliferation, Reifung und Regeneration von Nervenzellen benötigt [6]. Bei einem Mangel häuft sich Methylmalonsäure (MMA) an. Dadurch wird die Bildung der Myelinscheiden von Nervenzellen und die Markbildung der Hinterstränge beeinträchtigt [5].
Außerdem ist Adenosylcobalamin an der reversiblen Umwandlung von Leucin in 3-Aminoisocapronsäure (ß-Leucin) beteiligt.
Ursachen eines Vitamin-B12-Mangels
Die häufigsten Ursachen eines Vitamin-B12-Mangels sind Störungen der Resorption, die vor allem unter Älteren verbreitet sind. Insbesondere Patienten mit gastrointestinalen Erkrankungen wie atrophische Gastritis, Pankreasinsuffizienz oder Morbus Crohn (Befall des terminalen Ileums) haben ein erhöhtes Risiko für Mangelerscheinungen (Tabelle 2). In einer Studie an 180 Patienten mit Morbus Crohn wurde bei 16 % ein Vitamin-B12-Mangel und bei 22 % ein Folsäuremangel (< 3 ng/ml) nachgewiesen. Von Patienten mit Colitis ulcerosa, die als Kontrollen dienten (n = 70), waren in dieser Studie nur 3 % bzw. 4 % von einem Mangel betroffen [7].
Auch ein Magenbypass, chronischer Alkoholkonsum oder Arzneimittel können die Resorption von Cobalamin beeinträchtigen. Relevant ist zum Beispiel die Einnahme von säurehemmenden Arzneimitteln wie Protonenpumpenhemmern, H2-Rezeptor-Antagonisten und Antazida sowie die Langzeiteinnahme des Antidiabetikums Metformin [3, 8]. Zu weiteren Medikamenten, die mit Cobalamin interagieren können, zählen das Gichtmittel Colchicin, der Lipidsenker Colestyramin, Antiepileptika und Methyldopa sowie Antibiotika wie Aminoglykoside, Neomycin und Chloramphenicol (Tabelle 3) [9].
Nicht zu vergessen: Vitamin B12 kann durch eine pathogene Darmflora, in seltenen Fällen auch durch Parasiten wie Fischbandwurm, bereits im Darm zum großen Teil aufgebraucht werden.
Bei älteren Patienten wurde, abhängig von der Messmethode, bei bis zu ca. 20 % ein Vitamin-B12-Mangel nachgewiesen [3]. Am häufigsten besteht bei Älteren eine Nahrungs-Cobalamin-Malabsorption (60 – 70 %), oft in Verbindung mit einem prädisponierenden Faktor wie atrophische Gastritis oder chronische Helicobacter-pylori-Infektion. Dieses Syndrom ist durch eine Unfähigkeit der Freisetzung von Cobalamin aus Nahrungsmitteln oder einen Mangel an intestinalen Cobalamin-Transport-Proteinen wie Haptocorrin und Intrinsic Factor (IF) charakterisiert. An zweiter Stelle folgt die perniziöse Anämie (15 – 20 %), die ebenfalls mit einem Mangel an IF assoziiert ist. Sehr selten sind hingegen genetische Störungen des Vitamin-B12-Stoffwechsels (< 1 %) [3].
Vielfältige unspezifische Symptome
Die Symptome eines Vitamin-B12-Mangels sind vielfältig, unspezifisch und oft subtil. Am häufigsten sind infolge der beeinträchtigten Synthese von Purin- und Pyrimidin-Basen der Nukleinsäuren Blutbildveränderungen wie die perniziöse Anämie. Charakteristisch ist eine Blutarmut mit extrem großen roten Blutkörperchen (megaloblastäre Anämie). In schwereren Fällen können auch Leukopenie und Thrombozytopenie auftreten. Zu den klinischen Symptomen der Perniziosa zählen Blässe der Haut, Atrophie der Schleimhäute, Huntersche Glossitis mit Zungenbrennen bis zur Atrophie der Zungenschleimhaut, Schwäche, Ermüdbarkeit, Antriebsarmut und Schwindel [5].
Häufig haben Personen mit Vitamin-B12-Mangel auch neurologische und psychiatrische Symptome unterschiedlich schwerer Ausprägung, auch bei völligem Fehlen von Blutbildveränderungen. Eine neurologische Folgeerkrankung des Vitamin-B12-Mangels ist die funikuläre Spinalerkrankung (Myelose), die durch die Entmarkung von Hintersträngen und Störung der Pyramidenseitenbahnen des Rückenmarks ausgelöst wird [5, 6]. Zu den möglichen Symptomen zählen:
Neurologische Symptome:
- Parästhesien (Kribbeln bzw. Ameisenlaufen in Armen oder Beinen)
- Sensibilitätsstörungen (z. B. pelziges Taubheitsgefühl)
- Gangunsicherheit („Gehen wie auf Watte“)
- erhöhte Sturzneigung
- Störungen der Tiefensensibilität (Erkennen und Lage der Stellung z. B. der Beine sind gestört)
- Ausfall der Reflexe
- Lähmungen [5, 9]
Zerebrale/psychische Symptome:
- Verwirrtheit
- Störungen von Gedächtnis und Urteilsvermögen
- Apathie
- Depressionen
- psychotische Zustände
- Demenz
Die neurologischen und neuropsychiatrischen Symptome können hämatologischen Anomalien Monate bis Jahre vorausgehen; Blutbildveränderungen können auch ganz ausbleiben.
Durch einen Vitamin-B12-Mangel ausgelöst werden können auch Magen-Darm-Beschwerden (Dyspepsie, Übelkeit, Erbrechen, Diarrhoe) sowie gynäkologische Beschwerden wie eine Atrophie der Vaginalschleimhaut [3]. Denn das Wachstum von Oberflächenzellen ist bei Vitamin-B12-Mangel gestört. Dies kann sich klinisch zum Beispiel auch in Form von Mundwinkeleinrissen (Rhagaden) und in seltenen Fällen Braunverfärbung der Haut äußern.
Diagnostik
Eine Frühdiagnose eines Vitamin-B12-Mangels ist wichtig, da neurologische Symptome irreversibel sein können und häufig vor oder ohne hämatologische Manifestationen auftreten. Es wird immer häufiger empfohlen, alle älteren Patienten in schlechtem Ernährungszustand, Bewohner von Pflegeheimen, Patienten in psychiatrischen Kliniken sowie alle Patienten mit hämatologischen oder neuropsychiatrischen Symptomen, die mit einem Vitamin-B12-Mangel einhergehen können, auf einen solchen Mangel zu screenen [3].
Als Standardtest galt lange Zeit die Messung des Gesamt-Vitamin B12 im Serum mit einem Schwellenwert für einen Mangel < 200 ng/l (< 150 pmol/l), eventuell in Kombination mit der Messung der Homocysteinspiegel als funktioneller Indikator eines Vitamin-B12-Mangels. Allerdings ist das Gesamt-Vitamin B12 ein später, relativ unsensitiver und unspezifischer Biomarker des Vitamin-B12-Mangels, weil dabei vorwiegend die inaktive Speicherform gemessen wird. Bei einer Gesamt-Vitamin-B12-Konzentration im unteren Referenzbereich zwischen 150 bis 400 pmol/l kann ein B12-Mangel nicht sicher ausgeschlossen werden [6].
Es etabliert sich deshalb zunehmend die Messung von Holotranscobalamin (Holo-TC), das den Status des tatsächlich aktiven Vitamin B12 wiedergibt, das im Blut an Proteine gebunden ist (10 – 25 %). Erniedrigte Werte (< 35 pmol/l) sind der früheste Marker eines Vitamin-B12-Mangels und ein Hinweis darauf, dass der Körper über nicht ausreichend verwertbares Vitamin B12 verfügt und die B12-Speicher sich aufgrund der negativen Vitamin-B12-Bilanz bereits leeren. In diesem Stadium werden klinische oder hämatologische Symptome noch nicht beobachtet [6]. Für die Messung von Holo-TC steht ein automatisierter Immunoassay zur Verfügung; die Kosten des Tests sind etwa doppelt so hoch wie für Gesamt-Vitamin B12. Personen mit Holo-TC-Werten zwischen 35 und 50 pmol/l sind Risikopatienten für einen Vitamin-B12-Mangel. Erniedrigte Holo-TC-Werte in Verbindung mit erhöhter Methylmalonsäure (MMA) (> 300 nmol/l) und erhöhten Homocysteinspiegeln (> 10 µmol/l), beides funktionelle Indikatoren eines Vitamin-B12-Mangels, weisen auf einen metabolisch manifesten Vitamin-B12-Mangel hin. In diesem Stadium können bereits klinische Anzeichen vorliegen oder noch fehlen. Der Mangel kann sich aber zum Beispiel bereits negativ auf den Knochenstoffwechsel auswirken. Differentialdiagnostisch zu beachten ist, dass die MMA-Werte auch bei eingeschränkter Nierenfunktion erhöht sein können und auch ein Mangel an Folsäure und Vitamin B6 zur Hyperhomocysteinämie führen kann. Die MMA-Bestimmung erfolgt massenspektrometrisch und ist teuer.
Auch durch Urinuntersuchungen kann ein Vitamin-B12-Mangel festgestellt werden. Ein isolierter Mangel an Adenosylcobalamin führt zu Methylmalonaturie, ein Mangel an Methylcobalamin zur Homocysteinurie [5].
Therapie
Ein Vitamin-B12-Mangel, auch ein subtiler, sollte möglichst frühzeitig erkannt werden. Dann kann der Mangel durch Umstellung der Ernährung oder eine Substitutionstherapie ausgeglichen und der Entwicklung von Mangelsymptomen vorgebeugt werden. Zu den Anwendungsgebieten einer Vitamin-B12-Substitution zählen außerdem eine Hyperhomocysteinämie (in Kombination mit Folsäure), eine hyperchrome makrozytäre Megaloblastenanämie (Perniziosa, Biermer-Anämie, Addison-Anämie) und eine funikuläre Spinalerkrankung [5]. Die Empfehlungen hinsichtlich Dosierung und Anwendung der Vitamin-B12-Substitution sind bisher nicht einheitlich. Infrage kommt eine intramuskuläre oder orale Substitutionstherapie, für die unterschiedliche Cobalamine zur Verfügung stehen. Therapeutisch eingesetzt werden Cyanocobalamin und Hydroxycobalamin, die im Organismus zu den aktiven Coenzymen Methylcobalamin oder 5´-Adenosylcobalamin umgewandelt werden. Cyanocobalamin gilt als stabiler als Hydroxycobalamin [5].
Nach wie vor Standard ist die parenterale Gabe von Cobalamin, da die allgemeine Meinung vorherrscht, die Bioverfügbarkeit von oralem Cobalamin sei gering. Inzwischen belegen aber zunehmend mehr Studiendaten, dass eine hochdosierte orale Substitutionstherapie durch die IF-unabhängige passive Diffusion auch bei gestörter aktiver Resorption den Vitamin-B12-Mangel rasch ausgleichen kann, ohne dass eine parenterale Gabe notwendig wird. Ausschließlich bei Patienten mit schweren neurologischen Störungen oder mit perniziöser Anämie ist initial eine parenterale Substitutionstherapie indiziert.
Bei einer Substitutionstherapie steigen die Cobalaminspiegel im Serum dosisabhängig (Abb. 2). Als niedrigste notwendige Tagesdosen von oralem Cyanocobalamin zum Ausgleich eines milden Vitamin-B12-Mangels bei älteren Personen (Gesamt-Vitamin B12 135 – 406 pg/ml, MMA ≥ 0,26 µmol/l) erwiesen sich in einer Dosisfindungsstudie Konzentrationen oberhalb von 600 µg – mehr als das 200-Fache der empfohlenen Nahrungszufuhr von 3 µg täglich [10].
In einer Vergleichsstudie über vier Monate bei 38 Patienten mit neu diagnostiziertem Vitamin-B12-Mangel war eine Substitutionstherapie mit oralem Cyanocobalamin (2 mg täglich) einer Injektionstherapie (1 mg i.m. an den Tagen 1, 3, 7, 10, 14, 21, 30, 60, 90) mindestens ebenbürtig. Beurteilt wurden sowohl hämatologische als auch neurologische Parameter sowie die Serumwerte von Cobalamin, Methylmalonsäure und Homocystein. Bei vier von 18 Patienten unter oraler Substitutionstherapie und bei vier von 15 Patienten aus der i.m.-Gruppe wurden deutliche Verbesserungen neurologischer Symptome wie Parästhesien, Ataxie oder Gedächtnisverlust festgestellt. Alle Serummarker für einen Vitamin-B12-Mangel wurden bei allen Behandelten deutlich verbessert. Die Cobalamin- und MMA-Werte wurden bei Patienten der oralen Substitutionsgruppe sogar signifikant stärker gebessert als in der i.m.-Gruppe (Abb. 3) [11].
Auch in einem Cochrane-Review, in dem Daten von zwei randomisierten kontrollierten Studien mit insgesamt 108 Patienten mit Vitamin-B12-Mangel (≤ 240 pg/ml) ausgewertet worden sind, darunter die oben beschriebene Kuzminski-Studie, war eine Therapie mit oralem Cobalamin (1 mg und 2 mg täglich) einer intramuskulären Substitutionstherapie (1 mg) keineswegs unterlegen [12].
In der zweiten Studie wurde Cobalamin in den ersten zehn Tagen täglich angewendet, in den folgenden vier Wochen einmal pro Woche und danach monatlich. Beide Therapieformen waren zur Behandlung von Patienten mit megaloblastärer Anämie ähnlich effektiv und verbesserten neurologische Parameter wie die kognitive Funktion, sensorische Neuropathien und das Vibrationsempfinden. Auch die Serum-Cobalamin-Spiegel stiegen im Verlauf von 90 Tagen in beiden Gruppen in ähnlichem Maße an. Nebenwirkungen der Therapie wurden nicht beobachtet.Diesen Daten zufolge ist die hochdosierte orale Substitutionstherapie bei den meisten Patienten mit Vitamin-B12-Mangel eine der parenteralen Applikation gleichwertige Alternative, die von den Patienten vorgezogen werden dürfte. Weitere Vergleichsstudien wären allerdings wünschenswert, insbesondere bei Patienten mit Malabsorption.
Fazit
Ein Vitamin-B12-Mangel, vor allem ein subtiler subklinischer, ist in Risikogruppen wie Ältere und Patienten mit intestinalen Erkrankungen häufiger als bisher angenommen und sollte möglichst frühzeitig diagnostiziert werden. Am besten geeignet sind dazu Messungen von Holotranscobalamin, Methylmalonsäure und Homocystein. Bei Patienten mit manifestem Vitamin-B12-Mangel können unspezifische neurologische und psychiatrische Symptome typischen Blutbildveränderungen (perniziöse Anämie) um Jahre vorausgehen. Unter einer Substitutionstherapie normalisieren sich nicht nur in kurzer Zeit die Cobalamin-Serumspiegel, sondern auch die Symptome der Betroffenen, und Blutbildveränderungen bessern sich deutlich. Die Therapie sollte rechtzeitig erfolgen, um das Auftreten irreversibler neurologischer Symptome zu verhindern. Eine hochdosierte orale Substitutionstherapie ist bei Patienten mit symptomatischem Vitamin-B12-Mangel eine gleichwertige Alternative zur parenteralen Applikation.
Interessenkonflikte: keine deklariert
Dieser CME-Beitrag wurde unterstützt von Wörwag Pharma
Auf unserem CME-Portal www.med-etraining.de können Sie ab dem 7.5.2014 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Der Allgemeinarzt, 2014; 36 (10) Seite 51-56