Muskelschmerzen und Steifigkeit am Morgen: Das sind typische Symptome der Polymyalgia rheumatica (PMR). Die entzündlich-rheumatische Erkrankung tritt bei Menschen ab dem 50. Lebensjahr auf. Sie äußert sich durch Schulter- und Beckengürtelschmerzen und zeigt eine hohe Entzündungsaktivität: Fast immer sind die Blutsenkungsgeschwindigkeit (BSG) und das C-reaktive Protein (CRP) erhöht. Manche PMR-Patienten entwickeln im Verlauf auch eine Riesenzellarteriitis (RZA). Während die unkomplizierte PMR gut auf eine Glukokortikoidmonotherapie anspricht, ist bei der RZA in der Regel eine zusätzliche immunsuppressive Therapie erforderlich.
Leitsymptome der PMR sind akut bis subakut auftretende proximal betonte symmetrische Myalgien des Schulter- und Beckengürtels sowie eine ausgeprägte Morgensteifigkeit. Vor allem das Heben der Arme über 90 Grad wird dabei zum Problem. Alltagsbewegungen wie Haare kämmen und föhnen oder vom Stuhl beziehungsweise aus der Hocke aufstehen sind dann kaum oder nur noch erschwert möglich. Die Schmerzen haben typischerweise einen entzündlichen Charakter (Verschlechterung in Ruhe, Besserung bei Bewegung und im Tagesverlauf nach nächtlichem oder morgendlichem Schmerzhöhepunkt). Zur Diagnosestellung ist das Alter des Patienten wichtig: Bei Erstmanifestation sollte dieses bei mindestens 50 Jahren liegen. Der Erkrankungsgipfel liegt bei 70 bis 80 Jahren [8].
Etwa 20 % aller Patienten mit einer PMR entwickeln im Verlauf eine Riesenzellarteriitis (RZA). Symptome der begleitenden RZA sind temporale Cephalgien, Kauclaudicatio und eine schmerzende Kopfhaut (Befall kranieller Gefäße, Arteriitis temporalis). Darüber hinaus kann Fieber unklarer Genese mit oder ohne andere vegetative Begleitsymptome (Gewichtsverlust, Nachtschweiß) auftreten. Dies ist als Folge der systemischen Entzündung zu sehen und kann vor allem bei einer Aortitis das einzige Symptom sein. Visusstörungen – insbesondere eine Amaurosis fugax – sind als dringliche Warnsymptome für eine drohende Erblindung zu werten.
Bei Verdacht auf eine RZA sollte man umgehend eine Glukokortikoid (GC)-Therapie beginnen und schnellstmöglich die Vorstellung beim Rheumatologen beziehungsweise in einem Zentrum einleiten – bei Visusstörungen sofort als Notfall. Bei Verdacht auf eine PMR sollte der Arzt die Symptome einer RZA wegen der häufigen Koinzidenz immer mit abfragen. Die typische Symptomatik einer PMR wird in den 2012 erstellten Klassifikationskriterien der Fachgesellschaften European League against Rheumatism (EULAR) und American College of Rheumatology (ACR) zusammengefasst (Tabelle 1) [4].
Labor
Bei der Diagnosestellung einer PMR sind die Blutsenkungsgeschwindigkeit (BSG) und das C-reaktive Protein (CRP) in der Regel deutlich erhöht. Sehr hohe CRP-Werte (> 50 mg/l) sollten an eine begleitende RZA denken lassen. Dennoch kann gelegentlich eine Erhöhung der serologischen Entzündungsparameter fehlen, vor allem in sehr frühen Krankheitsstadien. Spezifische diagnoseassoziierte Seromarker wie Autoantikörper sind für die Routinediagnostik aktuell nicht verfügbar [2, 14].
Rheumafaktoren und Antikörper gegen cyclisch citrullinierte Peptide (CCP) sind bei der PMR in Abgrenzung zur rheumatoiden Arthritis negativ [4]. Auch kann eine Anämie der chronischen Entzündung (normochrom, normozytär) vorliegen. Eine Thrombozytose und eine Leukozytose können ebenfalls auftreten und sind, wie die Anämie, ein Hinweis auf eine koinzidente RZA.
Als weitere Folge der systemischen Entzündungsreaktion zeigt sich in der Serumelektrophorese eine erhöhte Alpha-1- und -2-Fraktion [7]. Die Creatinkinase ist in der Regel normwertig und sollte aus differenzialdiagnostischen Gründen bei Myalgien zur Abgrenzung einer Myositis oder anderer Muskelerkrankungen bestimmt werden.
Bildgebung
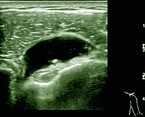
Bei der Erstdiagnose sollte zur genannten Labordiagnostik idealerweise eine Bildgebung der entzündlichen Manifestationen erfolgen. Als kostengünstige und leicht verfügbare Methode hat sich hier besonders die Arthrosonografie bewährt. Typische Manifestationen der PMR sind die bilaterale Bursitis subdeltoidea (Abb. 1), die Tendovaginitis der langen Bizepssehne, die Synovitis des Glenohumeralgelenks oder die Bursitis trochanterica [4, 10].
Muskuloskelettale Manifestationen einer PMR lassen sich auch mittels MRT nachweisen [10], was in Anbetracht der hohen diagnostischen Wertigkeit der Arthrosonografie in der Regel jedoch entbehrlich ist.
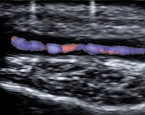
Bei Verdacht auf eine koinzident vorliegende RZA kann mit Farbduplexsonografie der A. temporalis (Abb. 2) bzw. der A. axillaris die Diagnose einer Arteriitis gesichert werden [18, 19]. Hier empfiehlt es sich, den Patienten über eine spezielle Notfallsprechstunde einer rheumatologischen Klinik vorzustellen.
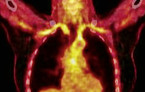
Bei unauffälliger Gefäßsonografie und weiterhin starkem Verdacht auf eine RZA mit extrakranieller Manifestation (z. B. Aortitis) sind das MRT oder die PET-CT (Abb. 3) als sensitivste und spezifischste Methode verfügbar. Einzelne Studien weisen darauf hin, dass die PET-CT auch zur Verlaufsbeurteilung der Entzündungsaktivität der Aorta geeignet sein könnte [12, 15, 17]. Auf eine Biopsie der A. temporalis kann man dank Ultraschalldiagnostik und PET-CT heute auch nach den aktuellen EULAR-Empfehlungen in den allermeisten Fällen verzichten [5].
Differenzialdiagnosen
Der Arzt sollte bei der Differenzialdiagnose – vor allem wegen des höheren Alters der Patienten – auch an eine Paraneoplasie und an degenerative Beschwerden des Bewegungsapparats (z. B. Periarthritis humeroscapularis) denken. Bei fehlender Remission sollte immer eine Malignomsuche mit Röntgen-Thorax, Abdomensonografie, Serumelektrophorese, gynäkologischer beziehungsweise urologischer Vorstellung und Koloskopie erfolgen. Spricht der Patient nicht auf GC an, können dafür auch primäre metabolische oder dystrophische Muskelerkrankungen sowie neurodegenerative Erkrankungen verantwortlich sein. Oft zeigt sich bei diesen Krankheitsbildern eine erhöhte CK [13].
Die neurologische Vorstellung mit Elektromyografie (EMG) und Nervenleitgeschwindigkeitsmessung (NLG) ist hier richtungsweisend. Die Muskelbiopsie sollte nur mit gezielter Fragestellung erfolgen – hinsichtlich der meisten Myopathien ist sie beweisend [13]. Bei deutlich erhöhten Entzündungswerten muss der Arzt auch infektiologische Ursachen in Betracht ziehen. Eine bakterielle Endokarditis sollte mittels Blutkulturen und transösophagealer Echokardiografie (TEE) ausgeschlossen werden.
Der M. Whipple ist eine zwar seltene, doch unter Immunsuppressiva oft auftretende Infektion mit unbehandelt letalem Ausgang. Typische Frühsymptome sind Myalgien und Arthritiden, die sich unter der immunsuppressiven Therapie verschlechtern [11, 16]. Bei Myalgien mit erhöhten Entzündungswerten sind selbstredend andere immunogene Erkrankungen wie die Polymyositis, die "Late Onset Rheumatoid Arthritis" (LORA), der systemische Lupus erythematodes (SLE) und verschiedene Kleingefäßvaskulitiden denkbar. Die wichtigsten Differenzialdiagnosen der Polymyalgia rheumatica zeigt Tabelle 2.
Bei fehlender Remission der Entzündungsserologie und typischer Klinik sollte man bei der PMR, wie schon beschrieben, auch immer an das koinzidente Vorliegen einer RZA denken. Deren Warnsymptome sind in Tabelle 3 dargestellt. Die rheumatologische Vorstellung ist zur Erstdiagnose der PMR empfehlenswert, sollte jedoch spätestens bei fehlender Remission unter niedrigdosierter GC-Monotherapie (12,5 – 20 mg Prednisolonäquivalent!) oder bei Verdacht auf eine RZA zur weiteren Diagnostik und Therapieeinleitung erfolgen.
Therapie
Zur Therapie der PMR empfehlen die rheumatologischen Fachgesellschaften derzeit eine GC-Monotherapie [6]. Als Initialdosis sind meist 12,5 – 20 mg Prednisolonäquivalent p.o. pro Tag als einmalige Tagesdosis am Morgen gegen die Beschwerden ausreichend. Ein promptes Ansprechen der Klinik ist zudem typisch für die Erkrankung und diagnostisch wegweisend. Danach sollte eine sukzessive Dosisreduktion auf 10 mg innerhalb von vier bis acht Wochen, dann um 1 mg alle vier Wochen erfolgen.
Eine Gesamttherapiedauer von mindestens einem Jahr empfiehlt sich, um Rezidive zu vermeiden. Bei einem Rezidiv sollte man die Erhöhung auf die letzte effektive Dosis mit anschließend erneuter Reduktion wie bei der Initialtherapie anstreben. Bei fehlender Remission oder erhöhtem Glukokortikoidbedarf ist der Rheumatologe hinzuzuziehen. Im Verlauf können dann andere Immunsuppressiva wie Methotrexat zum Einsatz kommen [1, 9, 14]. Da die PMR in aller Regel gut zu behandeln ist, sollte der Arzt, wie erwähnt, bei fehlender klinischer und serologischer Remission stets die Diagnose nochmals überdenken.
Die Therapie der RZA sollte immer ein Facharzt für Rheumatologie begleiten. Im Gegensatz zur unkomplizierten PMR sind zu Beginn deutlich höhere Prednisolondosierungen erforderlich (1 mg/kgKG, bei Visusstörung drei Tage 250 – 500 mg/d). Bei der RZA besteht unter Glukokortikoidmonotherapie ein hohes Rezidivrisiko (70 %!) und ein höherer Glukokortikoidbedarf mit entsprechenden Folgeschäden. In der Regel wird deshalb zeitnah eine glukokortikoideinsparende Therapie, z. B. mit Methotrexat oder Tocilizumab, eingeleitet.
Aufgrund des Risikos einer glukokortikoidinduzierten Osteoporose sollte eine Evaluation des Osteoporoserisikos nach den DVO-Empfehlungen erfolgen [3], eine Prophylaxe mit Vitamin D (1.000 IE/d) verordnet und gegebenenfalls eine spezifische Therapie, z. B. mit Bisphosphonaten, begonnen werden.
Interessenkonflikte: Dr. med. Nina Kempiners: Keine Interessenskonflikte. Prof. Dr. Bernhard Hellmich: Vortragshonorare: Abbvie, Celgene, BMS, Chugai, MSD, Novartis, Pfizer, Roche. Beratungstätigkeit/Advisory Boards: Celgene, Chugai, Roche
- Polymyalgia Rheumatica: Je älter, desto häufiger
- Neuromuskuläre Erkrankungen: Leitsymptom: Muskelschwäche
- Verdacht auf "Rheuma": Diagnostik und Erstmaßnahmen durch den Hausarzt
- Rheumatoide Arthritis: Frühe Diagnose rettet Knochen
- Schmerzen und Krämpfe in der Muskulatur: Welche Diagnostik ist sinnvoll?
Erschienen in: Der Allgemeinarzt, 2018; 40 (17) Seite 50-55