Die Diagnose der Herzinsuffizienz erfordert das Vorliegen von Symptomen und ggf. klinischen Zeichen sowie den objektiven Nachweis einer kardialen Funktionsstörung mittels Echokardiografie. Die Standard-Therapie bei Patienten mit Herzinsuffizienz und verminderter linksventrikulärer Auswurffraktion umfasst ACE-Hemmer, Betablocker und Mineralokortikoidrezeptor-Antagonisten. Der Angiotensin-Rezeptor-Neprilysin-Inhibitor Sacubitril/Valsartan, der If-Kanal-Inhibitor Ivabradin, die kardiale Resynchronisationstherapie sowie die Implantation eines Kardioverter-Defibrillators sind weitere Medikamente bzw. Maßnahmen, die bei geeigneten Patienten die Prognose verbessern.
Die Herzinsuffizienz ist charakterisiert durch eine Störung der Füllung und/oder der Auswurfleistung des Herzens. Die häufigste Ursache ist die koronare Herzkrankheit, gefolgt von der hypertensiven Herzkrankheit, Klappenerkrankungen und Kardiomyopathien. Die Prognose ist schlechter als bei vielen malignen Erkrankungen. Zumindest für die chronische Herzinsuffizienz mit reduzierter linksventrikulärer Auswurffraktion steht heute aber eine differenzierte Therapie zur Verfügung, welche die Prognose verbessert. Diagnostik und Therapie der chronischen HFrEF werden im vorliegenden Artikel basierend auf den neuesten internationalen Richtlinien [3] zusammengefasst.
Diagnostik
Die Diagnostik der Herzinsuffizienz soll das Syndrom erfassen und von anderen Krankheitsbildern abgrenzen sowie die zugrunde liegenden Mechanismen aufdecken, um eine angemessene Therapie einleiten zu können. Für die Diagnose sind zum einen Symptome und/oder klinische Zeichen und zum anderen der objektive Nachweis einer kardialen Dysfunktion erforderlich. Typische Symptome sind Belastungsdyspnoe, eingeteilt gemäß der New York Heart Association (NYHA), Leistungsintoleranz, nächtliche Dyspnoe, Orthopnoe und Ödeme.
EKG, Thorax-Röntgenbild sowie die Bestimmung des BNP oder des N-terminal-pro-BNP (NT-proBNP) sind die ergänzenden, auch in der Praxis durchführbaren Basisuntersuchungen. Auf eine detaillierte Diskussion der Wertigkeit dieser Untersuchungen wird aus Platzgründen verzichtet, diese kann aber anderswo gefunden werden [1]. Falls die Basisuntersuchungen normal ausfallen, wird eine Herzinsuffizienz unwahrscheinlich, insbesondere wenn sich aus diesen Untersuchungen andere mögliche Ursachen der Beschwerden ergeben (Lungenpathologie, Anämie etc.). Falls die Basisuntersuchungen Hinweise auf eine Herzinsuffizienz ergeben, muss als nächster Schritt zwingend eine Echokardiografie erfolgen, da diese den zugrunde liegenden Mechanismus aufzeigt, was für die Therapie entscheidend ist. Falls ein Klappenvitium oder eine eingeschränkte LVEF vorliegt, ist die Situation relativ klar. Falls die LVEF normal ist, sollten je nach Befund weiterführende Untersuchungen erfolgen (Koronarangiografie, kardiales MRI) mit der Frage nach einer in der Echokardiografie nicht offensichtlichen kausalen Therapiemöglichkeit.
Prinzipien der Therapie
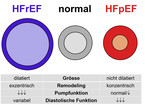
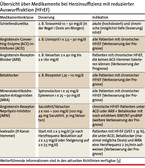
Grundsätzlich muss man sich immer die Frage stellen, ob ein kausaler Therapieansatz möglich ist. Dies betrifft beispielsweise die schwere Aortenklappenstenose (Aortenklappenersatz), die schwere Mitralinsuffizienz (Mitralklappenrekonstruktion) oder die schwere koronare Herzkrankheit (aortokoronare Bypass-Operation). Falls dies nicht der Fall ist, besteht die Therapie aus Medikamenten und "Devices", wobei es zwischen Patienten mit reduzierter linksventrikulärer Auswurffraktion (HFrEF) und Patienten mit erhaltener Auswurffraktion (HFpEF) zu unterscheiden gilt. Patienten mit HFrEF (jünger, häufiger zugrunde liegende koronare Herzkrankheit) und HFpEF (älter, häufiger zugrunde liegende hypertensive Herzkrankheit) unterscheiden sich demografisch und bezüglich kardialer Morphologie (Abb. 1) grundlegend. Wir werden nachfolgend die gut fundierte Therapie von Patienten mit HFrEF diskutieren (Tabelle 1 und Abb. 2). Für eine Übersicht bezüglich der Datenlage im Bereich HFpEF verweisen wir aus Platzgründen auf einen anderen Artikel [2].
ACE-Hemmer/Angiotensin-Rezeptor-Blocker
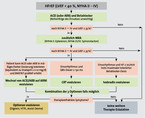
Angiotensin-Converting-Enzyme-Inhibitoren (ACEI) stellen neben Betablockern und Mineralokortikoid-Rezeptor-Antagonisten (MRA) einen der drei Grundpfeiler der HFrEF-Therapie dar (Abb. 2). Diese drei Medikamentengruppen wirken den ungünstigen hochregulierten, zur Krankheitsprogression führenden Systemen (Renin-Angiotensin-Aldosteron-System und sympathisches Nervensystem) entgegen und führen zu einem "reversen Remodeling" (einer "Rückbildung" der pathologischen linksventrikulären Dilatation/Dysfunktion, vgl. Abb. 1). Jeder Patient mit HFrEF muss grundsätzlich mit einem ACEI behandelt werden. Ein Angiotensin-Rezeptor-Blocker (ARB) soll nie primär, sondern nur bei echter ACEI-Unverträglichkeit eingesetzt werden. Die ACEI müssen niedrig dosiert begonnen und langsam gesteigert werden, dies unter Kontrolle von Klinik, Kreatinin und Kalium. Patienten ohne vorbestehende Hypertonie werden oft hypoton unter ACEI, was per se nicht zu Absetzen/Dosisreduktion führen soll. Symptomatische Hypotonie tritt oft auf, wenn die Patienten zu stark mit Schleifendiuretika vorbehandelt sind. Entsprechend müssen die Schleifendiuretika beim Erreichen eines euvolämen Zustands reduziert werden. Ein Anstieg des Kreatinins bis 50 % kann bei klinisch gutem Verlauf toleriert werden.
Betablocker
Betablocker stellen den zweiten obligaten Grundpfeiler der HFrEF-Therapie dar. Wichtig ist es, dass die Betablocker im stabilen Zustand (d. h. nicht im Rahmen der akuten Dekompensation) niedrig dosiert begonnen und ebenfalls langsam aufdosiert werden. Auf diese Weise kann die Verträglichkeit der Betablocker bei HFrEF deutlich verbessert werden. Symptomatisch profitieren die Patienten mit HFrEF in der Regel nicht/kaum vom Betablocker. Der prognostische Nutzen (Überleben) ist aber extensiv belegt, weshalb das Etablieren eines Betablockers (Bisoprolol, Metoprolol-Tartrat, Carvedilol, Nebivolol) in einer möglichst hohen Dosierung bei allen HFrEF-Patienten angestrebt werden muss unter Berücksichtigung von Kontraindikationen (Asthma bronchiale, höhergradiger AV-Block).
Mineralokortikoidrezeptor-Antagonisten
Für das gesamte Symptomspektrum (NYHA III/IV: Spironolacton, NYHA II: Eplerenon) ist ein prognostischer Benefit der MRA nachgewiesen, weshalb alle HFrEF-Patienten, die nach Etablieren eines ACEI und eines Betablockers noch symptomatisch sind, mit einem MRA behandelt werden sollen (Abb. 2). Zu berücksichtigen sind der Verlauf von Kreatinin und Kalium, da unter ACEI/MRA Hyperkaliämien nicht selten sind. Die Kombination ACEI + ARB + MRA ist aus diesem Grund kontraindiziert.
Weitere Optionen
Wenn Patienten unter ACEI, Betablocker und MRA in optimalen Dosierungen symptomatisch bleiben (auch wenn "nur" NYHA II), muss die Therapie zur Verbesserung der Prognose nach Möglichkeit ausgebaut werden (Abb. 2). Die primären drei Optionen sind der Angiotensin-Rezeptor-Neprilysin-Inhibitor (ARNI) Sacubitril/Valsartan, der If-Kanal-Hemmer Ivabradin und die kardiale Resynchronisationstherapie (CRT) oder eine Kombination dieser Möglichkeiten.
ARNI: Sacubitril/Valsartan (Entresto®) ist der erste und bislang einzige klinisch geprüfte und zugelassene ARNI, also eine Kombination eines Angiotensin-Rezeptor-Blockers mit einem Neprilysin-Inhibitor (hemmt den Abbau von BNP und erhöht somit die Verfügbarkeit dieses endogenen Hormons mit natriuretischem/vasodilatierendem Effekt). Sacubitril/Valsartan ist dem Standard-ACEI Enalapril überlegen bezüglich harter klinischer Endpunkte (Überleben). Somit muss die Umstellung eines ACEI oder ARBs auf Sacubitril/Valsartan erwogen werden, falls BNP oder NT-proBNP mindestens noch leicht erhöht ist (Abb. 2). Bei der Umstellung von ACEI auf ARNI ist aufgrund des Risikos eines Angioödems ein mindestens 36-stündiges ACEI-freies Intervall zu beachten (gilt nicht für Umstellung von ARB auf ARNI). Das Medikament ist zudem relativ stark blutdrucksenkend und entsprechend nur empfohlen für Patienten, die unter einem ACEI oder ARB in einer Dosis äquivalent zu Enalapril 2 x 10 mg einen systolischen Blutdruck von mindestens 100 mmHg aufweisen. Zu beachten ist zudem, dass sich das BNP unter Therapie mit einem ARNI nicht mehr als Verlaufsparameter der Herzinsuffizienz eignet (falsch hohe Werte aufgrund der Hemmung des BNP-Abbaus).
Ivabradin: Ivabradin senkt selektiv die Sinusfrequenz und führt so partiell ähnlich wie ein Betablocker zu einem günstigen "reversen Remodeling". Ivabradin kann so bei Patienten mit Herzfrequenz ≥ 70/min unter ACEI/ARB, MRA und Betablocker in der maximalen tolerierten Dosis das Risiko von Re-Hospitalisationen vermindern. Bei Patienten mit Vorhofflimmern kann Ivabradin nicht eingesetzt werden (kein Effekt).
CRT: Bei Patienten mit breitem QRS-Komplex (Tabelle 1) optimiert CRT ("biventrikulärer Schrittmacher") den linksventrikulären Kontraktionsablauf und führt zu einem "reversen Remodeling".
Implantierbarer Kardioverter-Defibrillator (ICD): Alle HFrEF-Patienten, die nach mindestens dreimonatiger "optimaler Therapie" (nicht genau definiert; sinnvoll ist die Basis-Therapie mit ACEI, Betablocker und MRA) eine bleibend tiefe LVEF ≤ 35 % haben, haben grundsätzlich eine Indikation für eine primärprophylaktische Implantation eines ICD (mit/ohne CRT je nach Situation, s. o.). Patienten in gutem funktionellen Status, mit überlebtem plötzlichen Herztod oder anhaltenden symptomatischen Kammertachykardien haben eine sekundärprophylaktische Indikation unabhängig von der LVEF.
Der in der Fallvignette beschriebene Patient könnte im Idealfall "nur" mit einem ACEI und einem Betablocker (idealerweise mit wenig/keinem Diuretikum) und je nach Verlauf mit einem MRA behandelt werden. Falls er symptomatisch bleibt, wäre er angesichts des Linksschenkelblocks ein guter Kandidat für CRT, während Umstellung von ACEI auf ARNI und Ivabradin weitere Optionen im Verlauf wären.
Interessenkonflikte: M.Maeder: Advisory Board-Tätigkeit für Novartis [Hersteller von Entresto (Sacubitril/Valsartan)]
Erschienen in: Der Allgemeinarzt, 2017; 39 (22) Seite 22-26