Der lumbale Bandscheibenvorfall mit begleitenden radikulären Symptomen lässt sich meist ambulant behandeln. Die größte Herausforderung ist dabei eine adäquate Diagnostik und die Korrelation von klinischem Befund und Röntgenbild. Die primäre Behandlung ist, sofern keine Blasen-/Mastdarmstörungen oder schwere Lähmungen vorliegen, überwiegend konservativ. Ziel ist die Reduktion radikulärer Beschwerden sowie die soziale und berufliche Integration des Patienten nach maximal drei Monaten.
Rückenschmerzen gehören in Umfragen regelmäßig zu den Top-Ten-Diagnosen, wenn es um den Grund für eine hausärztliche Konsultation geht. Der lumbale Bandscheibenvorfall (LBSV) ist hier eine spezifische Unterform des Rückenschmerzes, dessen Prävalenz mit zunehmendem Alter steigt und einen Höhepunkt zwischen dem 30. und 50. Lebensjahr erreicht. Männer sind davon doppelt so häufig betroffen wie Frauen. Das Bewegungssegment (Bandscheibe und angrenzende Wirbelkörper) L4/5 und L5/S1 ist dabei mit über 80 % am weitesten verbreitet. Im Zentrum der Pathophysiologie stehen die Bandscheibendegeneration – entweder über Endplattenveränderungen (meist obere LWS) oder über Fissuren des Bandscheibenanulus, die durch erhöhte Belastung häufig im unteren LWS-Bereich zustande kommen [1]. Da Bandscheibendegenerationen sehr häufig vorkommen und schon bei über der Hälfte der 40-Jährigen nachweisbar sind – im Alter von 80 dann bei mehr als 90 % der Patienten –, ist eine der zentralen Fragen der Behandlung: Gibt es eine Korrelation zwischen den Beschwerden und dem radiologischen Befund [2]?
Ist jeder Bandscheibenvorfall klinisch relevant?
Seit Einführung des MRT zeigen verschiedene Untersuchungen an schmerzfreien Patienten, dass bis zu deren 50. Lebensjahr bei knapp 30 % und bei mehr als 60 % der über 60-Jährigen ein asymptomatischer lumbaler Bandscheibenvorfall vorliegt [3, 4]. Spannend ist auch, dass in einer Metaanalyse in ungefähr zwei Drittel der Fälle eine Resorption des LBSV im weiteren Verlauf auftrat, wobei dies wohl bei freien Teilen ohne Kontakt zur Bandscheibe (Sequester) häufiger auftritt [5]. Das heißt: Allein die radiologische Diagnose eines LBSV erlaubt keinerlei Aussage über die klinische Relevanz. Im Umkehrschluss bedeutet dies, dass eine MRT-Untersuchung nur mit konkreter Fragestellung ein sinnvolles Ergebnis liefert. Dementsprechend kommt der klinischen Symptomatik, Anamnese und Untersuchung eine zentrale Rolle zu.
Was macht ein LBSV?
Die klassische Beschwerdesymptomatik und das Leitsymptom des LBSV ist ein ausstrahlender radikulärer Schmerz in Gesäß und/oder Bein [6].
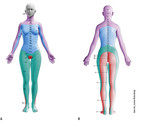
Die Kenntnis der dermatomalen Zuordnung ist deshalb so wichtig (Abb. 1 ). Das gilt auch für die Anwendung spezifischer Tests, u. a. des Lasègue-Tests zur Auslösung radikulärer Schmerzen für die unteren Wurzeln L4–S1 oder des umgekehrten Lasègue für die oberen Wurzeln [7].
Anamnestisch geht dem akuten ausstrahlenden Schmerz häufig ein Prodromalstadium mit überwiegenden Rückenschmerzen voran, das teilweise einige Wochen dauern kann. Dies erklärt sich durch Einrisse im innervierten Anulus fibrosus, die zum Teil auch im MRT als High-Intensity-Zone erkennbar sind. Eine Irritation des hinteren Längsbandes oder die Ausschüttung von inflammatorisch wirksamen Substanzen kann zusätzlich zur Lumbago führen. Die Inflammation löst neben dem mechanischen Druck auch die radikuläre Symptomatik aus. Diese kann mit sensomotorischen Defiziten von reinen Kribbeldysästhesien über Sensibilitätsstörungen bis zu Lähmungen einhergehen. Hier sollte man auf Reflexveränderungen achten, die in bis zur Hälfte der Fälle auftreten und nur bei subtiler Untersuchung zu finden sind.
Da die LBSV meist im unteren LWS-Bereich vorkommen, ist die Kenntnis der Kennmuskulatur der Wurzeln L3–S1 notwendig (Tabelle 1).
Eine Quantifizierung der motorischen Kraft ist für die Therapieentscheidung und Verlaufsdokumentation sehr sinnvoll (Tabelle 2). Elektrophysiologische Untersuchungen sind in aller Regel nicht nötig [8]. Als Sonderformen der Ausfälle gelten das Konus- beziehungsweise das Kauda-Syndrom, bei dem es durch Vorfälle im thorakolumbalen Übergang (Th12–L2) oder im Bereich der Kaudafasern zu Ausfällen, vor allem auch der Blasen-/Mastdarmfunktion kommt. Aufgrund häufiger Überlappungen spricht man klinisch unpräzise auch vom Konus-Kauda-Syndrom. Da diese in 1 – 10 % der Fälle vorkommende Symptomatik eine Notfallindikation zur operativen Entlastung ist, kommt hier der Abklärung möglicher Störungen eine bedeutende Rolle zu [9].
Was ist abzuklären?
Sollte nach Anamnese und klinisch-neurologischer Untersuchung der Verdacht auf einen BSV mit radikulärer Symptomatik vorliegen, muss der Arzt, wie generell bei Rückenbeschwerden, Hinweise auf schwere Erkrankungen (Red Flags)prüfen (Tabelle 3). Radikulopathien aufgrund anderer Ursachen, wie etwa aufgrund eines Traumas oder einer Infektion, lassen sich so abgrenzen. Sollten diese vorliegen, muss – wie bei weiter bestehendem V. a. LBSV mit sensomotorischem Defizit – eine weiterführende Diagnostik erfolgen. Bei reinem radikulären Schmerzsyndrom ohne Defizit und ohne Hinweis auf eine schwere Erkrankung kann kurzfristig unter enger klinischer Kontrolle ein konservativer Therapieversuch erfolgen. Bei bestehenden Beschwerden sollte man auch eine weiterführende Diagnostik zur Diagnosesicherung und Einleitung einer spezifischen Therapie durchführen.
Welche Bildgebung ist sinnvoll?
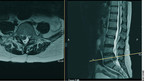
Bei V. a. LBSV und Indikation zur Bildgebung ist mittlerweile klar, dass die Kernspintomographie (MRT) ohne Kontrastmittel wegen ihrer exzellenten Weichteildarstellung als Goldstandard gilt (Abb. 2). Lediglich bei Kon-
traindikationen oder speziellen Fragestellungen zur knöchernen Situation sollte eine Computertomographie (CT) erfolgen. Künftig ist damit zu rechnen, dass zumindest die häufige Kontraindikation von Schrittmachern durch MRT-fähige Implantate, die zunehmend Verwendung finden, deutlich zurückgeht. Das Röntgen bietet den Vorteil einer Aufnahme im Stehen mit Aussagemöglichkeit zu Deformitäten und Instabilitäten und Erkennen von Segmentationsstörungen. Der reine Befund eines LBSV in der Bildgebung ist nicht ausreichend, denn diese muss unbedingt auf Konklusivität zwischen dem klinischen Befund (Radikulopathie) und dem Bildbefund (Höhe/Lage des BSV) hin geprüft werden. Schwierigkeiten können hier u. a. Segmentationsstörungen (vier- oder sechsgliedrige LWS) und die Lage des BSV (intraspinal, intraforaminal, extraforaminal) machen.
Prognose und Therapieziel
Bei einem Großteil der Patienten bessern sich die Beschwerden unter konservativer Therapie. Allerdings ist in bis zu 40 % der Fälle ein prolongierter Verlauf mit hohem Schmerzniveau zu beobachten – auch nach einigen Wochen konservativer Behandlung. Die operative Versorgung hat den Vorteil einer höheren Erfolgsrate und einer schnelleren Erholung [10], so dass sich nach sechs Wochen bei refraktären Verläufen eine relative Op.-Indikation ergibt. Auch wenn die Zeitspanne keine hohe Evidenz zeigt, gibt es doch genügend Hinweise, dass eine länger andauernde Therapie ohne ausreichenden Erfolg zu vermehrter Chronifizierung mit sozioökonomischen Folgen und eingeschränkten klinischen Ergebnissen führt. Neben der klinischen Symptomatik muss deshalb auch der zeitliche Verlauf berücksichtigt werden. Ziel sollte sein, eine schmerzarme beziehungsweise -freie Situation bezüglich radikulärer Symptomatik sowie die soziale und berufliche Integration innerhalb von längstens drei Monaten zu erreichen. Eine deutliche Reduktion sollte bis zur sechsten Woche eingetreten sein.
Op. oder konservative Therapie?
Sofern ein Konus-Kauda-Syndrom, eine Blasen-/Mastdarmstörung oder eine motorische Schwäche vom Kraftgrad ≤ 3 für relevante Muskelgruppen vorliegen, sollte der Arzt mit dem Patienten die Operation besprechen. Hintergrund ist die schnellere und häufiger eintretende nervale Erholung bei rascher Dekompression [11, 12]. Ansonsten ist primär, außer bei explizitem Patientenwunsch, die konservative Therapie die erste Wahl.
Konservative Therapie
Mit konservativen Verfahren ist derzeit keine direkte Rückbildung des LBSV möglich. Ziel der verschiedenen Therapieformen ist deshalb die Linderung von Schmerz, Bewegungseinschränkung und nervalem Ausfall. Jede Therapie sollte mit der Beratung des Patienten beginnen. Dies trifft besonders auf den LBSV zu, da die Prognose bei fehlenden psychosozialen Problemen sehr gut ist, demgegenüber die häufig vorherrschende Patientenmeinung aber meist ein düsteres Bild zeigt. Der Arzt sollte auch immer zum Erhalt der Aktivität ermuntern, da Bewegung den Krankheitsverlauf positiv beeinflusst. Eine kurze Phase der Bettruhe scheint zwar möglich, diese führt jedoch zu keinem besseren Verlauf bei gleichzeitig fehlender Aktivität. Eine Pharmakotherapie ist natürlich aufgrund der teilweise starken Schmerzen und zur Unterstützung der Beweglichkeit sinnvoll.
Bei starken Beschwerden muss das WHO-Schema nicht unbedingt streng und stufenweise befolgt werden. Paracetamol wird aufgrund der eingeschränkten Wirkung nur in Ausnahmefällen empfohlen, so dass NSAR mit besserer analgetischer Wirkung häufig – sofern vom Nebenwirkungsprofil möglich – zum Einsatz kommen. Opiate kann man kurzzeitig mit klarem Einnahmeschema verordnen. Myotrope Substanzen sind möglich, werden aber inzwischen deutlich restriktiver verordnet. Koanalgetika, vor allem gegen neuropathische Schmerzen, können eingesetzt werden. Auf orale Steroide sollte man bei sehr eingeschränktem Benefit und wegen der Nebenwirkungen verzichten [13]. Hier sei auch auf die Leitlinie zur konservativen, operativen und rehabilitativen Versorgung bei Bandscheibenvorfällen mit radikulärer Symptomatik verwiesen [14].
Bei eingeschränktem Ansprechen auf orale Analgetika kann unterstützend eine Injektionstherapie (epi-, perineural) erfolgen, die häufig zur Schmerzreduktion führt. Möglicherweise werden jedoch das Langzeitergebnis und die Op.-Raten nicht besser [15]. Infiltrationen sind eine zusätzliche Säule bei nicht ausreichendem Ansprechen der oralen Pharmakotherapie und sollten immer additiv zu weiteren Therapien, unbedingt in limitierter Anzahl und über einen begrenzten Zeitraum, erfolgen. Bei Infiltrationen gilt nicht das Prinzip: Viel hilft viel! Grundpfeiler einer konservativen Therapie, neben der Pharmakotherapie, sind physiotherapeutische Maßnahmen. Weil klare Studienergebnisse fehlen und es eine große Anzahl an unterschiedlichen Methoden gibt, existieren auch keine konkreten Empfehlungen. Die Basis bildet meist die klassische Krankengymnastik. Unter der Vorstellung einer lokalen Muskeldetonisierung lassen sich Massagen (eher segmentfern), Wärmetherapie oder Elektrotherapie anwenden, bei jedoch sehr begrenzter Evidenzlage. Akupunktur und manuelle Therapie sind bei Radikulopathie in der Akutphase nicht empfohlen. Für eine Orthesenbehandlung lässt sich keine allgemeine Indikation stellen, sie sollte auf Einzelfälle beschränkt bleiben.
Wenn‘s nicht besser wird
Wie bei der primären Therapieentscheidung ergibt sich bei Blasen-/Mastdarmstörungen oder relevanten Lähmungen, die unter konservativer Therapie neu auftreten, eine absolute Op.-Indikation. Ansonsten wird die konservative Therapie ambulant vorgenommen.
Sollten hier nicht beherrschbare Schmerzen auftreten, ist eine stationäre Therapie zur intensivierten analgetischen, aber häufig auch interventionellen Schmerztherapie möglich. Bei weiter ausbleibendem Erfolg ergibt sich wegen der in Studien nachgewiesenen schnelleren Schmerzreduktion, wie oben beschrieben, eine relative Op.-Indikation.
Interessenkonflikte: Der Autor hat keine deklariert
Erschienen in: Der Allgemeinarzt, 2019; 41 (20) Seite 44-48