Diagnostik und Therapie der Koronaren Herzkrankheit (KHK) haben sich in den letzten Jahren kontinuierlich verbessert. Die nicht-invasive Ischämiediagnostik, aber auch die invasive Druckdraht-Messung werden immer bedeutsamer. Mit diesen Verfahren lassen sich hämodynamisch relevante Stenosen detektieren und unnötige Revaskularisierungen verhindern. Der technische Fortschritt rückt zudem die interventionelle Versorgung der KHK weiter in den Fokus – als gute Alternative zur konventionellen Bypassversorgung. Trotzdem gilt es natürlich auch weiterhin, kardiovaskuläre Risikofaktoren zu reduzieren.
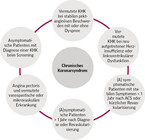
Kardiovaskuläre Erkrankungen sind weltweit und auch in Deutschland weiter die häufigste Todesursache. Bei der KHK zeigt sich hier seit einigen Jahren aber ein deutlicher Rückgang (Mortalität, Morbidität) [1] – durch verbesserte Diagnostik und Behandlungsmöglichkeiten (vgl. Kasuistik) [2]. Die KHK ist eine chronische Erkrankung mit stabilen, asymptomatischen und symptomatischen Phasen, die durch ein akutes Koronarsyndrom unterbrochen werden können. In den neuen Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) von 2019 wird zur Abgrenzung vom akuten Koronarsyndrom der Begriff des "Chronischen Koronarsyndroms" eingeführt, wodurch die KHK einen dynamischen atherosklerotischen Prozess darstellt. Hier werden sechs Szenarien unterschieden – mit unterschiedlichen Therapiezielen (vgl. Abb. 1).
Diagnostische Möglichkeiten
Bei Verdacht auf eine KHK sollte zunächst die Beschwerdesymptomatik genau erfragt und das kardiovaskuläre Risikoprofil evaluiert werden. Hier sollte man einige Basisuntersuchungen vornehmen: Blutentnahme, Ruhe- und Belastungs-EKG und eine transthorakale Echokardiographie (vgl. Tabelle 1). Im Anschluss lässt sich anhand der Prätestwahrscheinlichkeit (PTW) entscheiden, ob eine weitere nicht-invasive Diagnostik sinnvoll ist [4]. Bei einer PTW > 15 % sind stets weitere Untersuchungen empfohlen. Bei 5 – 15 % müssen etwa auch kardiovaskuläre Risikofaktoren, EKG-Veränderungen und linksventrikuläre Dysfunktion (höhere Wahrscheinlichkeit für eine KHK) berücksichtigt werden [3].
Eine Übersichtstabelle der Prätestwahrscheinlichkeiten zeigen die Leitlinien "2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes" [3].
Im Rahmen der nicht-invasiven Diagnostik gibt es heute ein breites Spektrum: Die Gefäßmorphologie lässt sich genauer darstellen und funktionelle Stress-Tests sind möglich, um das Ausmaß der Ischämie zu evaluieren. Das Koronar-CT ist ein Verfahren, das die Darstellung der Gefäßmorphologie ermöglicht, aber nicht auf die hämodynamische Relevanz von Koronarstenosen schließen lässt. Vor allem bei einer geringen Wahrscheinlichkeit für eine KHK ist das CT ein gutes Verfahren, um die Erkrankung auszuschließen [5, 6]. Bei hoher Wahrscheinlichkeit für eine KHK oder einer bereits bekannten KHK sind funktionelle Tests zur Evaluation einer relevanten Ischämie sinnvoll, etwa die Myokardszintigraphie oder das Stress-MRT. Studien zeigen, dass mit einer Ischämie > 10 % eine Prognoseverschlechterung einhergeht und eine Therapie empfohlen ist [7].
Ein weiteres, aber invasives Verfahren zum Nachweis hämodynamisch relevanter Stenosen ist die invasive Druckdraht-Messung. Hier gibt es Verfahren wie die FFR- oder i/rFR-Messung, die sich methodisch geringfügig unterscheiden [8]. Die FFR-Messung zeigt das Verhältnis zwischen aktuellem und theoretisch möglichem Blutfluss im Gefäß an [9]. Ab einem Verhältnis von < 0,80 spricht man von hämodynamisch relevanten Stenosen [10]. So lässt sich entscheiden, wer von einer Revaskularisierung profitiert. Relativ neu ist die Messung der koronaren Blutflussreserve im Kardio-CT (CT-FFR). Bislang ist diese Methode noch nicht überall verfügbar, auch deren Qualität ist noch nicht gesichert. Künftig ist es sicher eine gute Option, die Anzahl unnötiger invasiver Untersuchungen oder Revaskularisierungen und die damit verbundenen Risiken zu reduzieren [11].
Die Therapien – Blick in die Zukunft
Eine wichtige Säule der Therapie einer KHK ist die Änderung des Lebensstils: mediterrane Ernährung, Ausdauertraining an mindestens fünf Tagen pro Woche (30 – 60 Minuten) und die Nikotinkarenz. Damit lassen sich das kardiovaskuläre Risiko und das Mortalitätsrisiko schon signifikant reduzieren [3, 12]. Die medikamentöse Therapie soll pektanginöse Beschwerden reduzieren und das Fortschreiten der Erkrankung verhindern. Bei der antianginösen Therapie sollte man in erster Linie Betablocker und Kalziumkanal-Antagonisten einsetzen [13]. Bei Kontraindikationen oder Therapieresistenz lässt sich die Therapie etwa um langwirksame Nitrate oder Ranolazin erweitern [3].
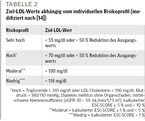
Zur Sekundärprophylaxe sollte man dauerhaft ASS verabreichen [14]. Zudem spielt die adäquate Lipidsenkung eine wichtige Rolle. In den neuen Leitlinien wird sogar eine noch intensivere Senkung des LDL-Werts als zuvor empfohlen. Dabei orientiert sich der angestrebte LDL-Zielwert am individuellen Risikoprofil, das in ein sehr hohes, hohes, moderates und niedriges Risiko unterteilt wird. Zu einem sehr hohen Risikoprofil zählen Patient:innen mit bekannter kardiovaskulärer Erkrankung, Diabetes mellitus und Organschäden, schwerer Niereninsuffizienz (eGFR < 30 ml/min/1,73 m2) oder einem kalkulierten ESC-SCORE ≥ 10 %. Bei diesen Patient:innen sollte man aktuell einen Ziel-LDL-Wert von < 55 mg/dl beziehungsweise eine Reduktion um 50 % des Ausgangswerts anstreben (Tabelle 2) [15]. Um dieses Ziel zu erreichen, sind in erster Linie Statine empfohlen, die allgemein sehr gut vertragen werden [16]. Sollte jedoch eine Monotherapie mit einem potenten Statin – etwa Atorvastatin – auch nach Ausdosierung nicht ausreichen, ist die Therapie am besten um Ezetimib zu erweitern [3, 15]. Neuere Studien konnten zudem eine sehr effektive Lipidsenkung durch Proprotein Convertase Subtilisin-Kexin Type 9 (PCSK9)-Inhibitoren zeigen, verbunden mit einer signifikanten Reduktion des kardiovaskulären Risikos [17]. Bei nicht ausreichender Lipidsenkung kann man bei Patient:innen mit einem sehr hohen Risiko deshalb die Hinzunahme eines PCSK9-Inhibitors diskutieren. Zum aktuellen Zeitpunkt liegen dazu allerdings keine Langzeitdaten vor. Es ist also noch unklar, welche Nebenwirkungen ein derart niedriger LDL-Wert haben könnte, etwa bezüglich des kognitiven und des neurologischen Outcomes. Die Genetik ist bei Entstehung und Fortschreiten der KHK ebenfalls wichtig. Weitere Untersuchungen in diese Richtung werden künftig sicher zu einer individuellen und optimalen Therapie führen [18].
Revaskularisierung
Das Ziel einer Revaskularisierung ist entweder die Prognoseverbesserung (akutes Koronarsyndrom, filiforme Engstellen) oder die Beschwerdelinderung. Eine Prognose-verbessernde Indikation liegt etwa bei Hauptstammstenosen oder Mehrgefäß-KHK mit eingeschränkter linksventrikulärer Pumpfunktion vor. Bei hämodynamisch relevanten Stenosen und fortbestehender Beschwerdesymptomatik – trotz optimaler medikamentöser Therapie – ist eine Revaskularisierung ebenfalls indiziert [19]. Bei der Wahl der adäquaten Therapiestrategie – interventionelle oder operative Versorgung der Stenosen – muss vor allem das Op.-Risiko bedacht werden. Unterstützend kann man den Euro- und den STS-Score hinzuziehen. Auch die Gefäßmorphologie ist wichtig, hier ist der SYNTAX-Score hilfreich – je höher der Score, desto komplexer die KHK. Die ESC-Leitlinien stellen hier gegenüber, welche Kriterien eher das eine oder das andere Verfahren befürworten (Tabelle 3).
Nach interventioneller Versorgung mit Implantation eines Drug-eluting Stents wird eine duale Thrombozytenaggregationshemmung (DAPT) empfohlen. Bei chronischem Koronarsyndrom sollte man zu ASS auch Clopidogrel über sechs Monate verabreichen, bei erhöhtem Blutungsrisiko kann man die Dauer auf drei Monate beziehungsweise einen Monat reduzieren [20]. Bei akutem Koronarsyndrom sollte man jedoch bevorzugt Ticagrelor oder Prasugrel einsetzen [21, 22]. Die ISAR-REACT-5-Studie konnte im direkten Vergleich jetzt sogar eine Überlegenheit von Prasugrel gegenüber Ticagrelor zeigen [23].
Sollte die Patient:in Ticagrelor auch gut vertragen, lässt sich die Therapie nach dem Schema der PEGASUS-TIMI 54-Studie in reduzierter Dosierung auf 36 Monate ausdehnen [24 – 26].
Bei Vorhofflimmern und Indikation zur Antikoagulation sollte die Ärzt:in weiter die Therapie mit NOAK (Neue orale Antikoagulanzien) in Kombination mit Clopidogrel fortsetzen: Je nach Studie Apixaban und Clopidogrel für sechs Monate (AUGUSTUS-Schema) oder Rivaroxaban und Clopidogrel für 12 Monate (PIONEER-AF PCI-Schema) [27, 28]. Eine Kombination von P2Y12-Inhibitor und VKA (Vitamin-K-Antagonist) empfiehlt sich wegen des erhöhten Blutungsrisikos im Vergleich zur Kombi mit NOAK nicht. Erstere ist Patient:innen mit schwerer Nierenfunktionsstörung vorbehalten, die keine NOAK-Therapie erhalten dürfen [3]. Eine Triple-Therapie mit ASS sollte periprozedural erfolgen (1 bis 4 Wochen), die sich bei hohem Thromboserisiko auf bis zu sechs Monate verlängern lässt [3]. Ticagrelor und Prasugrel sollte man bei Indikation zur therapeutischen Antikoagulation nicht geben [3].
- Basisuntersuchungen bei V. a. KHK sind Labor, Ruhe- und Belastungs-EKG und Echokardiographie.
- Das Koronar-CT ist vor allem bei geringer KHK-Wahrscheinlichkeit sinnvoll, um diese auszuschließen.
- Bei hoher KHK-Wahrscheinlichkeit sind funktionelle Tests sinnvoller, um den Ischämiegrad zu evaluieren.
- Die medikamentöse Therapie der KHK besteht in erster Linie aus Betablockern und Kalziumantagonisten.
- Eine Revaskularisierung (interventionell oder operativ) dient der Prognoseverbesserung oder der Beschwerdelinderung, wenn Medikamente nicht ausreichen. Dabei ist ein individuelles Therapiekonzept gefragt.
Letztlich muss die Ärzt:in für jede Patient:in das Thrombose- und Blutungsrisiko abschätzen und ein individuelles Therapiekonzept erstellen.
Interessenkonflikte: Die Autoren haben keine deklariert.
Erschienen in: doctors|today, 2021; 1 (1) Seite 20-23