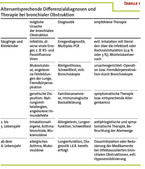
Die Inhalationstherapie kann sowohl bei Krankheiten der oberen als auch der unteren Atemwege erfolgreich eingesetzt werden. Vor Beginn einer Inhalationstherapie sind altersentsprechende Differenzialdiagnosen zu beachten. Entscheidend für den Therapieerfolg sind eine richtige Technik/Handhabung und eine gute Compliance des Patienten. Die Auswahl des geeigneten Inhalationssystems erfolgt daher zuerst nach dem Alter, danach sind das Feinpartikelspektrum des Inhalators und individuelle Parameter des Patienten (u. a. Gesundheitszustand, Vorlieben) zu berücksichtigen. Die zur Verfügung stehenden Systeme sind Dosieraerosole, Trockenpulverinhalatoren und Feuchtvernebler.
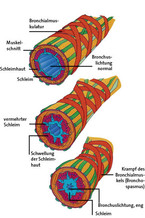
Die Inhalationstherapie wird regelmäßig bei Kindern mit bronchialen obstruktiven Erkrankungen der unteren Atemwege (z. B. Asthma, Bronchitis, immotile Zilien, Mukoviszidose, Pneumonie) eingesetzt. Typische klinische Symptome sind das Giemen oder der Husten. Kennzeichnend für die allergische und die infektassoziierte bronchiale Obstruktion sind darüber hinaus im Wesentlichen drei krankhafte Veränderungen in den Atemwegen: die Hypersekretion, das Schleimhautödem und ein Zusammenziehen der glatten Bronchialmuskulatur (Abb. 1). Vor Initiierung einer Inhalationstherapie sollte sich der Therapeut bei der Diagnose sicher sein, wobei altersentsprechend unterschiedliche Differentialdiagnosen zu bedenken sind (Tabelle 1).
Kindliche Bronchien brauchen winzige Aerosole
Für die Inhalationstherapie von Kindern und Jugendlichen sollte unter anderem berücksichtigt werden, dass ihre Atemwege einen deutlich geringeren Durchmesser haben als diejenigen von Erwachsenen [6]. Durch Entzündungen, Schleimbildung und ein Zusammenziehen der glatten Bronchialmuskulatur können sie sich noch weiter verengen (Abb. 1), sodass die Größe der vom Inhalator generierten Wirkstoffteilchen (das sogenannte Feinpartikelspektrum) eine wichtige Rolle spielt. Folglich brauchen Kinder mit Erkrankungen der unteren Atemwege ein Feinpartikelspektrum mit besonders geringen Durchmessern. Bei zu großen Wirkstoffteilchen bleibt ein großer Teil der Dosis bereits im Mund- und Rachenraum hängen und kann dort dann auch ungewollte Nebenwirkungen hervorrufen [1]. Grundsätzlich sollten für Kinder möglichst viele der inhalierten Teilchen einen Durchmesser von ≤ 3 µm haben (zum Vergleich: ein rotes Blutkörperchen hat einen Durchmesser von 6 – 7 µm). Aber auch bei altersgerechtem Partikelspektrum steigt mit zunehmendem Alter die Wirkstoffmenge an, die bei der Inhalation in die Lunge gelangt, allerdings ohne dass sich die wirksame Dosis im Verhältnis zum Körpergewicht ändert [14]. Daher wird für Kleinkinder eine deutlich höhere Individualdosis pro kg Körpergewicht verordnet als für Jugendliche [13].
Das geeignete Inhalationssystem
Zur Inhalation stehen im Wesentlichen drei verschiedene Systeme zur Verfügung: Dosieraerosole (engl. pressurized metered dose inhaler, pMDI), Trockenpulverinhalatoren (engl. dry powder inhaler, DPI) und Feuchtvernebler (engl. nebulizer). Darüber hinaus werden ständig neue Systeme entwickelt, darunter auch Inhalatoren mit Kontrollfunktion [11, 12]. Jedes System hat seine Vor- und Nachteile, wobei die Auswahl des Inhalationssystems zuerst nach dem Alter erfolgen sollte (Tabelle 2) – vor allem Bedienung und Teilchengröße müssen altersgerecht sein. Darüber hinaus sind aber auch individuelle Parameter wie etwa der Gesundheitszustand und die Vorlieben des Patienten sowie die Kostenerstattung durch die GKV zu berücksichtigen.
Die jüngsten Patienten sollten vorzugsweise mit Düsen- oder Ultraschallverneblern versorgt werden, die auch einfach zu bedienen sind. Bis zum zweiten Lebensjahr ist dabei die sogenannte Maskeninhalation vorteilhaft, denn Säuglinge können einen Vernebler über den Mund nicht richtig benutzen. Die Maske muss 100 %ig dicht über Mund und Nase des Patienten schließen, denn schon ein kleines Leck reduziert die inhalierte Wirkstoffmenge drastisch bis auf nahezu null [9].
Ab dem dritten Lebensjahr sollte die Inhalation am besten nur noch über den Mund erfolgen, da so die Teilchen direkt, ohne den Umweg über die Nase, in die Bronchien gelangen können. Die Mundinhalation ist etwa zehnmal effektiver als eine Inhalation mit Maske. Wichtig ist – sofern möglich – langsam und gleichmäßig zu inhalieren (Ruheatmung, max. 30 l/min). Daher wird der Einatmungsfluss (engl. peak inspiratory flow, PIF) bei manchen Modellen durch einen automatischen Kontrollmechanismus begrenzt. Zudem kann man bei Druckluftverneblern durch Einsätze mit verschiedenen Prallplatten das Partikelspektrum und somit die Teilchengröße variieren.
Dosieraerosole mit Vorsatzkammer können bei Kindern ab drei Jahren erfolgreich eingesetzt werden, wenn der Patient einen langsamen, gleichbleibenden PIF von 15 – 60 l/min erzeugen kann. Vorsatzkammern erleichtern dabei die Koordination von Auslösen und Einatmen, ein oft kritischer Punkt bei jungen Patienten. Im Vergleich zu Verneblern sind Dosieraerosole handlich klein und können mit deutlich geringerem Zeitaufwand benutzt werden; auch die Größe der Aerosolteilchen variiert nicht so stark wie bei Verneblern. Unter den treibgasgetriebenen, FCKW-freien Dosieraerosolen sind für Kinder vor allem sogenannte Lösungsaerosole zu empfehlen. Sie erzeugen insgesamt kleinere Wirkstoffteilchen, die leichter ihren Weg bis in die Bronchien finden. Die Maskeninhalation mit Dosieraerosolen kann bis zum zweiten Lebensjahr genau wie mit Verneblern erfolgen, indem eine Maske auf die Vorsatzkammer gesetzt wird. Um Aerosolverluste durch elektrostatische Kräfte zu reduzieren, sollte die Vorsatzkammer mit Spülmittel vorbehandelt werden oder eine spezielle Beschichtung aufweisen (Abb. 2).
Eine Weiterentwicklung stellt der Autohaler® dar, ein Dosieraerosol, bei dem der Sprühstoß durch den Atemzug ausgelöst wird. Der Autohaler® ist somit auch ohne Vorsatzkammer für Kinder nutzbar. Ebenfalls kein übliches Dosieraerosol ist der Respimat® Soft Mist Inhaler (Abb. 3). Zwar wird in diesem Fall die Aerosolwolke wie bei anderen MDIs per Knopfdruck ausgelöst, aber die Koordination zum ruhigen, zeitgerechten Einatmen ist durch die langsam und lang ausströmende Aerosolwolke (mit 0,8 m/s über 1,5 s) deutlich erleichtert. Zusammen mit dem hohen Anteil an Feinpartikeln (< 5 µm) verbessert dies die Deposition des Wirkstoffs in der Lunge, sodass die Dosis im Vergleich zu anderen Devices verringert werden kann – bei gleicher Effektivität [2, 4]. Mit Vorsatzkammer und ggf. mit Maske kann der Respimat® auch bei Kleinkindern erfolgreich eingesetzt werden.
Trockenpulverinhalatoren sind ebenfalls im Hosentaschenformat erhältlich, eignen sich jedoch nur für ältere Kinder, denn meist kann erst ab dem Schulalter der für die Desagglomeration des Wirkstoffs vom Trägermolekül Laktose notwendige PIF von mindestens 30 l/min (besser 60 l/min) generiert werden. Bei DPIs wird also die Freisetzung des Arzneistoffs erst durch den Einatmungsfluss ausgelöst, was unter anderem die Koordination erleichtert: Anders als zum Beispiel bei pMDIs kann zu frühes oder zu spätes Auslösen hier nicht die inhalierte Wirkstoffmenge reduzieren. Bei Patienten mit Laktoseintoleranz bestehen oft Bedenken bzgl. DPIs, da der Wirkstoff fast immer an Laktose gebunden ist; aufgrund der geringen Dosen sind jedoch keine klinischen Beschwerden zu erwarten.
Behandlung der oberen Atemwege
Immer wieder stellen sich Kleinkinder mit trockenem Husten, Heiserkeit und inspiratorischem Stridor vor. Dies sind typische Symptome für ein Krupp-Syndrom. Schätzungen zufolge sind jährlich etwa 5 % der Kinder im Alter zwischen drei und 36 Monaten betroffen [3, 5]. Neben der Applikation systemischer Steroide verspricht hier eine Behandlung mit inhalativem Adrenalin (Epinephrin, z. B. InfectoKrupp Inhal®) gute Erfolge [15], vorausgesetzt man wählt das geeignete System. Denn für die Therapie der oberen Atemwege können die Aerosole deutlich größer sein als z. B. bei der inhalativen Behandlung einer Bronchitis. Ein Partikelspektrum zwischen 7 und 9 µm ist hier günstig, sodass z. B. der neue Pari XLent® zum Einsatz kommen kann (Abb. 5). Für andere Erkrankungen der oberen Atemwege (z. B. Rhinitis, Sinusitis, Laryngitis, Pharyngitis) stehen ebenfalls spezielle Inhalationssysteme zur Verfügung, z. B. der Pari Sinus® bei Sinusitis (Abb. 6).
Gute Kooperation und richtige Technik = erfolgreiche Therapie
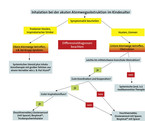
Ein Entscheidungsbaum zur Auswahl des geeigneten Inhalationssystems ist in Abb. 4 dargestellt. Generell stellt die Kooperation und die Compliance des Patienten/der Familie den wichtigsten Faktor für eine erfolgreiche Inhalationstherapie dar [7]. Darüber hinaus sollte die Inhalationstechnik zuerst gut geschult und dann regelmäßig geprüft werden [10], denn nur etwa ein Drittel der Kinder kann den korrekten Gebrauch von Inhalationssystemen allein nach mündlichen Erklärungen umsetzen. So wird für Dosieraerosole in der Regel ein ruhiges und tiefes Atemmanöver empfohlen, während bei Pulverinhalatoren ein von Beginn an kräftiges Atemmanöver notwendig ist. Eine falsche Einatmungstechnik kann dazu führen, dass die verabreichten Arzneimittel nicht in die Lunge gelangen, sondern durch Impaktion extrathorakal deponiert werden. Dann ist auf jeden Fall die systemische Wirkung der Medikamentendosis zu gering, um die Beschwerden zu kontrollieren.
Nicht empfehlenswert ist die gleichzeitige Verwendung unterschiedlicher Inhalationsgeräte für die Erhaltungs- und Notfalltherapie, da Patienten oft nicht in der Lage sind, die grundverschiedenen Inhalationsmanöver der Geräte korrekt durchzuführen [8]. Somit ist ein mangelnder Therapieerfolg häufig auf eine falsche Inhalationstechnik zurückzuführen. Aber auch die Richtigkeit der Diagnose, die Art des Arzneimittels oder eine zu geringe Dosierung sind zu bedenken. Stellt sich nach vier bis acht Wochen der Behandlung keine Besserung ein, sollten zuerst der Patient bzw. die Eltern befragt werden, ob regelmäßig und korrekt inhaliert wird. Dabei sollte die Inhalation auch demonstriert und gegebenenfalls eine Nachschulung durchgeführt werden.
Interessenkonflikte: Prof. Kamin hat mit den Unternehmen Teva, Boehringer Ingelheim und Pari in den letzten fünf Jahren Forschungsprojekte durchgeführt und erhielt von den Unternehmen auch Honorare für wissenschaftliche Vorträge. Dr. Erdnüß hat keine Interessenkonflikte deklariert.
Erschienen in: Der Allgemeinarzt, 2014; 35 (14) Seite 52-58