LDL-Cholesterin (LDL-C) gilt als etablierter Risikofaktor für atherosklerotische kardiovaskuläre Erkrankungen, die weltweit die häufigste Ursache für Tod und Behinderung sind. Die Basis der Prävention ist und bleibt der Lebensstil. Medikamentös lässt sich das LDL-Cholesterin durch Statine, Ezetimib und seit Kurzem durch PCSK9-Inhibitoren senken. Der Hausarzt sollte Hochrisikopatienten frühzeitig erkennen und deren Therapietreue fördern.
Bei der "Hypercholesterinämie" kommt es zu einer Erhöhung des Serumcholesterins. Um das kardiovaskuläre Risiko zu beurteilen und als Therapieziel ist das Cholesterin der LDL-Partikel entscheidend. LDL-Cholesterin (LDL-C) ist ein kausaler Risikofaktor für kardiovaskuläre Erkrankungen wie Herzinfarkt und Schlaganfall. Die Verhinderung solcher Ereignisse durch ein niedrigeres LDL-C ist gut belegt, wobei man positive Effekte proportional zur absoluten Senkung des LDL-C erreicht (vgl. Kasuistik) [6].
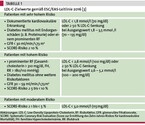
Abhängig vom kardiovaskulären Risiko werden LDL-C-Zielwerte sowohl in europäischen als auch US-amerikanischen Leitlinien empfohlen (vgl. Tabelle 1) [2, 10]. Das Prinzip der Zielwerte: Je höher das Risiko, desto mehr Ereignisse lassen sich durch eine möglichst starke LDL-C-Senkung verhindern. So sollen gemäß der europäischen Leitlinie von 2016 [2] Patienten mit dem höchsten kardiovaskulären Risiko einen LDL-C-Zielwert < 1,8 mmol/l (70 mg/dl) erreichen. Zu dieser Gruppe gehören Patienten mit manifester kardiovaskulärer Erkrankung (koronare Herzkrankheit, Schlaganfall, periphere arterielle Verschlusskrankheit), Diabetes mellitus mit Endorganschaden oder starken Risikofaktoren, mit schwerer chronischer Niereninsuffizienz oder einem Zehn-Jahres-Risiko für kardiovaskuläre Mortalität > 10 %. Bei hohem Risiko, das sich u. a. über ausgeprägte kardiovaskuläre Risikofaktoren ohne manifeste atherosklerotische Erkrankung definiert, sollte man ein LDL-C < 2,6 mmol/l (100 mg/dl) anstreben. Ein Zehn-Jahres-Risiko für kardiovaskuläre Mortalität von ≥ 1 bis < 5 % wird als moderates Risiko eingestuft. Das LDL-C sollte bei < 3,0 mmol/l (115 mg/dl) liegen.
Seit 2017 empfehlen die amerikanischen endokrinologischen Fachgesellschaften niedrigere Zielwerte bei extremem kardiovaskulärem Risiko. Dazu gehören Patienten mit progredienter kardiovaskulärer Erkrankung trotz gesenktem LDL-C, mit familiärer Hypercholesterinämie oder fortgeschrittener Niereninsuffizienz mit manifester kardiovaskulärer Erkrankung. Für diese Patienten ist ein LDL-C-Zielwert von < 1,4 mmol/l (55 mg/dl) empfohlen [12]. Gestützt wird dies durch die Studien mit Ezetimib und PCSK9-Inhibitoren, bei denen LDL-C-Werte von 0,6 – 1,4 mmol/l (23 – 54 mg/dl) erreicht wurden, jeweils verbunden mit einer Reduktion kardiovaskulärer Ereignisse [1, 27, 28]. Die Überarbeitung der europäischen Fachgesellschaften vom September 2019 kommt zu ähnlichen Empfehlungen.
Behandlung der Hypercholesterinämie
Neue Erkenntnisse aus Langzeit-Nachbeobachtungen randomisierter Studien mit Statinen [8], die Erkrankung der familiären Hypercholesterinämie und genetische Studien [5] zeigen, dass die negativen Effekte eines erhöhten LDL-C kumulativ sind. Durch eine frühzeitige LDL-C-Senkung besteht daher die Chance für eine echte Primärprävention, d. h. für die Verhinderung einer manifesten Atherosklerose. Weiter zeigen diese Daten, dass die Senkung des LDL-C langfristig, d. h. über viele Jahrzehnte, effektiv und sicher ist. Basis der Therapie ist ein gesunder Lebensstil. Ein Nikotin-Stopp und körperliche Aktivität sind entscheidende Säulen, um das kardiovaskuläre Risiko, unabhängig vom Serumcholesterin, zu reduzieren. Da ein wesentlicher Anteil des LDL-C aus der körpereigenen Produktion stammt und die LDL-C-Serumkonzentration hepatisch reguliert ist, lässt sich eine Senkung bei deutlich erhöhten Werten auf die Zielwerte allein durch Lebensstiländerungen oft nicht erreichen. Vor allem die Ernährung wird für das kardiovaskuläre Risiko und speziell für das LDL-C häufig überschätzt.
Erste Wahl zur pharmakologischen Senkung des LDL-Cholesterins sind Statine. Geht das LDL-C damit nicht ausreichend zurück, kann man Ezetimib, einen Cholesterinabsorptionshemmer, ergänzen [2]. Kürzlich zeigte sich eine dritte Substanzgruppe als effektiv in der LDL-C-Senkung und der Verhinderung kardiovaskulärer Ereignisse: die PCSK9-Inhibitoren. Diese monoklonalen Antikörper führen auch unter Lipidsenkern zu einem Rückgang des LDL-C um etwa 60 % [16]. PCSK9-Inhibitoren müssen initial von Fachärzten (Kardiologie, Nephrologie, Endokrinologie, Angiologie) oder in Lipidambulanzen verordnet werden, der Hausarzt kann sie dann weiter verschreiben. PCSK9-Inhibitoren sind nach einem Beschluss des Gemeinsamen Bundesausschusses (G-BA; vgl. z. B. unter [9] für Evolocumab) von den Kassen nur bei Patienten mit manifester atherosklerotischer Erkrankung und zusätzlichen Risiken erstattungsfähig, bei denen sich trotz Lipidsenkung über zwölf Monate keine LDL-C-Kontrolle erreichen ließ. Eine gute Dokumentation ist hier wichtig. In sehr speziellen Fällen ist bei medikamentös nicht erreichten LDL-C-Zielwerten eine Lipoprotein-Apherese indiziert. Das Stufenschema zur lipidsenkenden Therapie zeigt Abb. 1.
Probleme bei Hypercholesterinämie
Indikationsstellung
Die LDL-C-Zielwerte richten sich nach dem individuellen Risiko, z. B. dem Zehn-Jahres-Risiko für kardiovaskuläre Mortalität. Vor allem bei Patienten mit heterozygoter familiärer Hypercholesterinämie, die eine Prävalenz von 1:200 – 1:500 hat [22], besteht ein deutlich erhöhtes Lebenszeitrisiko für kardiovaskuläre Ereignisse, das von den Risikorechnern nicht erfasst wird. Alle Patienten mit familiärer Hypercholesterinämie profitieren von einer lipidsenkenden Therapie und kommen so der Atherosklerose zuvor [23]. Generell sollten bei der Lipidsenkung neben der Einschätzung des kardiovaskulären Risikos z. B. mittels des in Europa empfohlenen SCORE [3] auch Faktoren wie Familienanamnese oder eine Lipoprotein(a)-Erhöhung einbezogen werden. Zur Einschätzung möglicherweise bestehender atherosklerotischer Manifestationen und zur Visualisierung des Problems für Patienten bietet sich bei asymptomatischen Personen eine Sonographie der Halsgefäße mit Bestimmung der Intima-Media-Dicke und Untersuchung auf Plaques an [2].
Umsetzung der Leitlinienempfehlungen
In Europa werden die LDL-C-Zielwerte bei nur einem Drittel der Patienten erreicht [15], in einer deutschen Querschnittsstudie waren es sogar nur unter 20 % [13]. Das ist enttäuschend. Wichtig scheint es, Hochrisikopatienten zu identifizieren und bei nicht erreichten Zielwerten die Lipidsenkung anzupassen. Analysen aus Deutschland zeigen, dass man im ambulanten Bereich nur selten die Statindosierung steigert oder eine Kombinationstherapie mit Ezetimib initiiert [19]. Dies könnte erklären, weshalb in der europaweiten Erhebung 84 % der Patienten mit Statinen behandelt wurden, man aber trotzdem nur bei 32 % eine Kontrolle des LDL-C erzielte [15].
Zielwerte und Therapieadhärenz
Bei nicht erreichten LDL-C-Zielwerten unter Statintherapie empfiehlt sich die Hinzunahme von Ezetimib. Ist auch darunter keine Kontrolle des LDL-C zu erzielen, sollte man die Anbindung des Patienten an eine spezialisierte Lipid-
ambulanz in Betracht ziehen, um etwa eine PCSK9-Hemmer-Therapie zu initiieren.
- Gespräche mit dem Patienten über den Nutzen der Medikation, über mögliche Sorgen bezüglich der Nebenwirkungen
- Motivierende Gesprächsführung und proaktives Nachfragen zur Einnahmetreue
- Reduktion der Anzahl von Tabletten auf das notwendige Minimum, z. B. können ACE-Hemmer und Betablocker häufig in einer Tagesdosis genommen werden
- Verschreibung von Kombinationspräparaten, die es für viele Blutdrucksenker und Statin/Ezetimib-Kombinationen gibt
Begleiterscheinungen unter medikamentöser Therapie
Vor allem Statine werden von vielen Patienten mit somatischen Beschwerden in Verbindung gebracht, was bis zum Absetzen der Medikation führen kann. Unstrittig ist, dass die positiven Auswirkungen einer Statintherapie die möglichen Nebenwirkungen überwiegen [21]. Eine häufig berichtete vermeintliche Nebenwirkung einer Statintherapie sind Muskelschmerzen. Hier sind aufgrund der hohen Prävalenz muskuloskelettaler Beschwerden in der älteren Allgemeinbevölkerung Nocebo-Effekte zu beachten. Vaskulären Risikopatienten sollte man hier nicht die positiven Effekte der LDL-C-Senkung vorenthalten. Der Arzt sollte sich Zeit für den Patienten nehmen und ein strukturiertes Vorgehen mit Pausieren der Medikation indizieren. Gehen die Beschwerden zurück, sollte eine Reexposition erfolgen. Hier bietet es sich an, ein anderes Statin zunächst in einer niedrigen Dosis zu beginnen, die dann im Verlauf gesteigert wird. In den meisten Fällen lässt sich trotz Vorgeschichte von statinassoziierten Muskelschmerzen eine effektive Statintherapie etablieren [18]. In Problemfällen (Unverträglichkeit bei hohem Risiko und/oder hohem LDL-C) ist die Überweisung in eine Lipidambulanz zu erwägen.
Künftige Trends
In der Behandlung der Hypercholesterinämie werden zunehmend genetische Informationen eingesetzt, um Patienten zu identifizieren, die von einer lipidsenkenden Therapie besonders profitieren [11, 14]. Als alternatives Therapieziel zu LDL-C gewinnt derzeit Apolipoprotein B (ApoB), die Grundstruktur aller pathogenen Lipoproteine, an Bedeutung. Insbesondere bei Diabetes, Hypertriglyzeridämie, Adipositas und Patienten mit niedrigem LDL-C ist ApoB als Therapieziel und Marker des Therapieerfolgs möglicherweise dem LDL-C überlegen [7, 25]. Alternativ kann man auch das Nicht-HDL-Cholesterin bestimmen (Gesamt-Cholesterin minus HDL-Cholesterin), das in etwa ApoB entspricht. An neuen Medikamenten ist derzeit Bempedoinsäure in der klinischen Prüfung, eine Substanz, die im gleichen Stoffwechselweg wie die Statine die Cholesterinsynthese blockiert, jedoch spezifisch in der Leber aktiviert wird und so keine Nebenwirkungen in der Muskulatur entfalten sollte [20]. Bei den PCSK9-Hemmern ist der Wirkstoff Inclisiran in der Erprobung, der die Synthese von PCSK9 in der Leberzelle blockiert. Einer der Vorteile des Präparats: Es muss nur alle drei bis sechs Monate appliziert werden [24].
- LDL-C ist ein kausaler Risikofaktor für kardiovaskuläre Erkrankungen.
- Die medikamentöse Senkung des LDL-C mittels Statinen, Ezetimib und PCSK9-Inhibitoren führt zu einer Senkung der kardiovaskulären Ereignisrate.
- In der hausärztlichen Versorgung spielen die rechtzeitige Behandlung von Hochrisikopatienten, die Kontrolle des Therapieerfolgs (LDL-C-Zielwerte) und die Unterstützung der Einnahmetreue eine übergeordnete Rolle.
- Auf dem Boden der positiven aktuellen Studienergebnisse wurden in den kürzlich veröffentlichten Leitlinien niedrigere LDL-C-Zielwerte empfohlen als zuvor.
Interessenkonflikte: J. L. Katzmann hat in Bezug auf diese Arbeit keine Interessenkonflikte. U. Laufs hat Honorare für Vorträge von Amgen, Berlin-Chemie und Sanofi erhalten.
Erschienen in: Der Allgemeinarzt, 2020; 42 (8) Seite 40-44