Statine sind die derzeit effektivsten LDL-Cholesterin-senkenden Medikamente mit breitem klinischem Nutzen. Ihre weite Anwendung stößt allerdings an Grenzen bezüglich unerwünschter Wirkungen wie die Entwicklung eines Diabetes mellitus, die Erhöhung von Leberenzymen, aber insbesondere Statin-assoziierte Myopathien. Doch selbst bei Entwicklung einer Statinmyopathie sind Alternativen auch innerhalb der gleichen Medikamentengruppe möglich. Wie diese und andere Alternativen bei Statinmyopathie aussehen, erläutern wir in diesem Artikel.
Statine haben sowohl die Primär- als auch Sekundärprävention der arteriosklerotischen Erkrankungen, insbesondere der koronaren Herzerkrankung revolutioniert. Schon früh war klar, dass neben Leberwerterhöhungen einerseits ein besonderes Augenmerk auf die Entwicklung einer Myopathie zu legen war. Schließlich haben Metaanalysen herausgearbeitet, dass eine Statinbehandlung auch die Manifestation eines Typ-2-Diabetes fördern kann.
1. Anstieg der Transaminasen
Asymptomatische Transaminasenanstiege werden mit 0,1–3 % der Behandlungen angegeben. Diese treten dosisabhängig auf, sind klinisch kaum relevant und bilden sich nach Aussetzen der Medikation wieder zurück. Neuere Daten sehen ein Aussetzen der Medikation bei leichten Transaminasenerhöhungen nicht mehr vor, da diese lediglich eine „Leckage“ wahrscheinlich als Folge der Cholesterinverarmung der Hepatozytenmembran darstellen, die sich wieder einreguliert trotz Fortsetzen der Statingabe. Dennoch sollten vor Beginn einer Statintherapie Transaminasen bekannt sein und im Verlauf nach 4–6 Wochen noch einmal kontrolliert werden.
2. Entwicklung eines Typ-2-Diabetes
Eine Statinbehandlung erhöht das Risiko für die Manifestation eines Typ-2-Diabetes um ca. 9 % [14]. Risikopatienten sind solche mit Merkmalen eines metabolischen Syndroms wie Bluthochdruck, Hypertriglyzeridämie, erhöhtem BMI sowie niedrigem HDL-Cholesterin [16]. Auch spielte bei der Manifestation ansteigendes Körpergewicht während der Therapie eine Rolle [11]. Offenbar führen die bezüglich LDL-Cholesterinsenkung potenteren Statine häufiger zu einer Diabetesentwicklung als die weniger potenten [3]. Als möglicher Mechanismus wird unter anderem eine Verschlechterung der Insulinsensitivität unter Statinen diskutiert. Das vergleichsweise niedrige Risiko einer Diabetesentwicklung durch Statine wird durch den enormen Vorteil bezüglich kardiovaskulärer Prävention aufgehoben: 255 Patienten über 4 Jahre mit Statin behandelt lässt einen neuen Diabetesfall erwarten, verhindert aber 5,4 koronare Todesfälle pro mmol Senkung des LDL-Cholesterins (~ 40 mg).
3. Neurologische Effekte
Besonderes Augenmerk liegt hier auf hämorrhagischem Schlaganfall, kognitiver Einschränkung und peripherer Neuropathie. Für den hämorrhagischen Schlaganfall ist pro 40 mg LDL-Cholesterinabsenkung eine 21 %ige Risikoerhöhung errechnet. Das absolute Ausmaß dieser Gefährdung ist allerdings 50-fach geringer gegenüber den definitiven kardiovaskulären Vorteilen bei Hochrisikopatienten [4]. Kognitive Einschränkungen konnten unter Statinbehandlung bisher nicht nachgewiesen werden. Im Gegenteil zeigte sich kürzlich u. a. auch eine verminderte Demenzentwicklung [9]. Obwohl als mögliche Nebenwirkung einer Statinbehandlung aufgeführt, konnte in systematischen Analysen kein Signal für die Entwicklung von peripheren Neuropathien detektiert werden [6].
4. Statin-assoziierte Myopathien
Myopathien sind sicher die klinisch bedeutendste unerwünschte Wirkung der Statine. In Beobachtungsstudien und im Therapiealltag wird ihre Häufigkeit auf 10–15 % geschätzt. Hierbei existieren klare Unterschiede zwischen den einzelnen Statinen. Bei hoher Dosierung fand man für Fluvastatin 5,1 %, für Pravastatin 10,9 %, für Atorvastatin 14,9 % und für Simvastatin 18,2 % [2]. Die Definition der Myopathie variiert allerdings enorm in der Literatur. Die am häufigsten genutzte Definition der Myopathie (National Heart, Lung and Blood Institute) bezieht sich auf jegliche Muskelerkrankungen, erworben oder vererbt [12]:
Myalgie
Krämpfe, Schwäche, Schmerzen ohne CPK-Erhöhung
Myositis
Gleiche Symptome wie Myalgie mit CPK-Erhöhung
Rhabdomyolyse
Myalgie/Myositis mit Muskelschaden und CPK-Erhöhung über das 10-Fache der oberen Norm, auch mit braunem Urin
Inzwischen sind eine Reihe von Mechanismen als Ursachen der Statinmyopathien bekannt. Hiernach ist die weitaus häufigste toxische Myopathie von einer Immunmyopathie abzugrenzen. Bei der toxischen Myopathie liegen Arzneiinteraktionen, genetische Faktoren oder metabolische Veränderungen zugrunde, bei der Immunmyopathie wird eine entzündliche von einer nicht-entzündlichen unterschieden [1].
Toxische Myopathie
Obwohl diese noch nicht völlig verstanden wird, spielen offensichtlich eine Reihe von Bedingungen eine Rolle, die die Plasmastatinspiegel ansteigen lassen. Der häufigste Abbauweg erfolgt über Cytochrom P3A4. Medikamente, die mit diesem Enzym interferieren, erhöhen den Statinspiegel. Dazu zählen insbesondere Makrolid-Antibiotika, Verapamil, Marcumar®, Fibrate, Proteaseinhibitoren, Fungizide sowie Grapefruitsaft; CYP2C9 wird durch Amiodaron und Omeprazol gehemmt. Über CYP3A4 werden hauptsächlich Atorvastatin und Simvastatin metabolisiert. Fluvastatin hauptsächlich über CYP2C9, Simvastatin wird hierüber ebenfalls mit ca. 10 % abgebaut. Pravastatin erfährt seinen Abbau über Sulfatierung.
Daher sind deutliche Reduktionen in der Simvastatindosierung empfohlen bei folgenden häufigen Komedikationen [5, 13].
- Erythro-, Clarithro-, Telithromycin: Simvastatin kontraindiziert
- Amiodaron, Verapamil, Diltiazem: maximal 10 mg Simvastatin/Tag
- Amlodipin, Ranolazin: maximal 20 mg Simvastatin/Tag
Genetische Hintergründe
In der SEARCH-Studie fand sich eine strenge Assoziation der Simvastatin-assoziierten Myopathie mit einem Nukleotid-Polymorphismus auf Chromosom 12 [8]. Vereinzelt wird hier eine Genotypisierung empfohlen [17], die allerdings noch keinen Niederschlag in den Leitlinien gefunden hat. Ein Testsystem von STADA (STADA Diagnostik DNA Statine) misst neben diesem Polymorphismus noch weitere 12 Spots und wird für 269 € angeboten. Eine Erstattung durch Kostenträger erfolgt derzeit nur vereinzelt.
Metabolische Effekte
Statine vermindern inkonstant das Coenzym Q10 und induzieren damit möglicherweise mitochondriale Dysfunktionen. In Einzelfällen von Myopathie kann Q10 ersetzt werden. Eine generelle Empfehlung kann nicht gegeben werden.
Risikofaktoren für Statinmyopathie
Risikokonstellationen sind sowohl Eigenschaften der einzelnen Statine wie Lipophilie, Pharmakokinetik und ihre Dosierung, aber auch Patientencharakteristika [10, 15]:
- Hochdosis Statin
- Höheres Alter, niedriger BMI
- Exzessiver Alkoholkonsum
- Schweres körperliches Training
- Hypothyreose, Diabetes mellitus
- Niereninsuffizienz, Lebererkrankungen
- Vitamin-D-Mangel
- Medikamenten-Interaktionen
Im angloamerikanischen Schrifttum wird die initiale CPK-Bestimmung lediglich bei denjenigen empfohlen, die als Risikopatienten (s. o.) einzuordnen sind.
Management der Hyper-CPK-Ämie und der Statinmyopathie
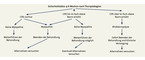
Der in Abb. 1 abgebildete Algorithmus stellt eine Synthese aus den verschiedenen internationalen Empfehlungen unter Berücksichtigung der asymptomatischen Hyper-CPK-Ämie dar, die lediglich durch eine Routine-Blutentnahme 4–6 Wochen nach Beginn einer Statinbehandlung oder Dosissteigerung auffällt. Fällt diese Kontrolle normal aus, ist keine weitere Sicherheitskontrolle mehr notwendig [1, 15]. Das Aussetzen einer Statinbehandlung hängt von den CPK-Spiegeln und der Symptomschwere ab. Wenn Statine als Ursache nicht ausgeschlossen sind und Patienten unerträgliche Symptome entwickeln oder eine Rhabdomyolyse (diese ist definiert als die Erhöhung der CPK über das 10-Fache des oberen Normwertes) vorliegt, sollte die Statintherapie beendet werden. Bei CPK-Spiegeln unterhalb des 10-fachen oberen Normwertes und bei erträglichen Myopathiesymptomen kann die Therapie fortgesetzt oder es können Alternativen genutzt werden. Daher sollten eine CPK- und Kreatininmessung erfolgen, wenn Patienten Myopathiesymptome entwickeln. Gleichzeitig gilt es, weitere Faktoren auszuschließen, wie starke muskuläre Belastung, ausgeprägten Konsum von Grapefruitsaft, und Komedikationen zu erfassen, wie Makrolid-Antibiotika, Kalziumkanalblocker, Amiodaron, aber auch Fi-brate und Azolfungizide. Schließlich ist die Schilddrüsenfunktion zu überprüfen, da auch eine subklinische Hypothyreose zur statinassoziierten Myopathie beitragen kann, ebenso ein Vitamin-D-Mangel, die zu beheben sind. Diese Therapien sind kostengünstig und häufig wirksam.
Alternative Behandlungen
Da die Statinmyopathie meist auf einem Anstieg des Statinspiegels basiert, kann zunächst das Statin gewechselt oder seine Dosis reduziert werden. Die dafür zur Verfügung stehenden Möglichkeiten sind hier zusammengestellt (vgl. Kasten). Sie betreffen einerseits den Wechsel auf Fluvastatin mit niedriger Myopathie-Inzidenz oder die Gabe von langwirksamen Statinen wie z. B. Rosuvastatin jeden 2. oder 3. Tag. Schließlich kommen auch Statine in niedriger Dosierung unter Wirkungsverstärkung mit Ezetimib zum Einsatz. Beispiele [10]:
- Fluvastatin 80 mg (ret.) täglich wurde von 97 % vorher Statin-Intoleranter vertragen mit LDL-C-Senkung um 33 %.
- 57 % Statin-Intoleranter vertrugen 0,8–8,75 mg Simvastatin täglich mit LDL-C Senkungen um 26 %.
- Von 61 Statin-Intoleranten tolerierten alle bis auf einen 5–10 mg Rosuvastatin mit LDL-C Senkung von 42 %.
- Von 51 Statin-Intoleranten (76 % mit Myopathie) tolerierten 72 % Rosuvastatin, jeden 2. Tag gegeben, mit einer mittleren Dosis von 5,6 mg, LDL-C-Senkung von 34 %.
- Einmal wöchentliche Dosierung von 5–20 mg Rosuvastatin wurde ohne Myopathierezidiv toleriert mit LDL-C-Reduktion von 29 % (6–62 %).
Nicht-Statin mit Alternativen
Hier kommt hauptsächlich Ezetimib zum Einsatz. LDL-Cholesterinreduktionen sind hier mit 15 % zu erwarten. Weitere Alternativen betreffen Gallensäurebinder inklusive des neuerlich entwickelten Colesevelam. Die gleichzeitige Applikation von Gallensäurebinder und Fibraten stellt eine weitere Alternative dar. Schließlich kommt die LDL-Apherese in Fällen progredienter koronarer Herzerkrankung bei nicht beherrschbarer LDL-Erhöhung zur Anwendung. Beispiele [10]:
- Ezetimib 10 mg als Monotherapie senkt LDL-C variabel mit 10–20 %.
- Ezetimib 10 mg täglich mit 10 mg Atorvastatin 2 x wöchentlich wurde von vorher Atorvastatin-Monotherapie-Intoleranten vertragen, sie zeigten LDL-C-Reduktionen von 37 %.
- Fluvastatin 80 mg ret. plus Ezetimib 10 mg sind gut toleriert mit LDL-C-Reduktion um 46 %, nur noch 3 % Intoleranz.
- Ezetimib 10 mg mit Colesevelam (1,875 mg) täglich senkte LDL-C um ca. 35 %.
Interessenkonflikte: Prof. Steinmetz berät Lipidsenkerfirmen und hat in der Vergangenheit Vortragshonorare von diesen Firmen erhalten.
Erschienen in: Der Allgemeinarzt, 2014; 36 (17) Seite 48-52