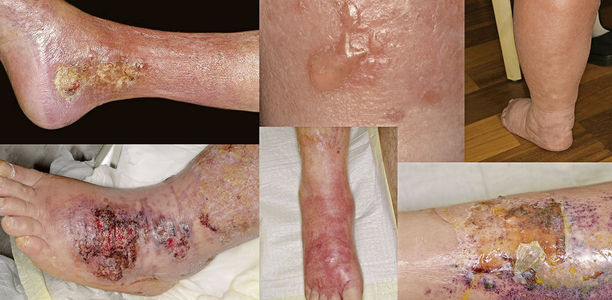
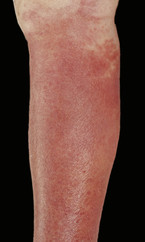
Das Erysipel, die Wundrose, ist ein auch in der Hausarztpraxis häufig anzutreffendes Krankheitsbild. Bei voller Ausprägung aller klinischen Charakteristika ist die Diagnose einfach zu stellen. Im Anfangsstadium oder bei fehlenden Allgemeinsymptomen ist die differenzialdiagnostische Abgrenzung mitunter schwierig.
Das Erysipel ist definiert als nicht-eitrige, fieberhafte und häufig mit Schüttelfrost und Reduktion des Allgemeinzustandes einhergehende bakterielle Infektion der Haut, die sich rasch lymphogen und interstitiell ausbreitet [2] (Abb. 1). Eine vorbestehende lymphatische Abflussstörung scheint, auch wenn sie bisher nicht klinisch in Erscheinung getreten ist, prädisponierend für die Entstehung eines Erysipels zu sein [4].
Typische Erreger sind Streptokokken der Gruppe A, seltener auch Staphylokokken. Auch gramnegative Erreger können in seltenen Fällen, insbesondere bei immunsupprimierten Patienten, pathogenetische Bedeutung haben [2].
Betroffen sind Menschen jeden Lebensalters, Frauen wie Männer. In größeren Studien ergibt sich ein mittleres Lebensalter von ca. 50 Jahren. Kinder und Jugendliche erkranken selten. Exakte Daten zur Inzidenz und Prävalenz fehlen, da es, wenngleich es sich um ein häufiges Krankheitsbild im klinischen Alltag handelt, nur sehr wenige Studien dazu gibt [3].
Grundsätzlich ist ein Erysipel in jeder Lokalisation möglich. In ca. 80 % der Fälle kommt es an den Extremitäten vor, davon mehrheitlich an den Unterschenkeln. Triggerfaktoren für das erste und wiederholte Auftreten eines Erysipels sind Hautverletzungen als bakterielle Eintrittspforten (→Kasten 1) und nicht entstaute Ödeme in der betroffenen Region [2].
Erysipel, chronische Stauungszustände unabhängig von ihrer Genese (z. B. bei chronischer venöser Insuffizienz) und eine Lymphabflussstörung begünstigen bzw. verschlechtern sich gegenseitig. Persistierende oder wiederkehrende Hautverletzungen als bakterielle Eintrittspforte, die rezidivierende Verläufe des Erysipels und damit eine Verschlechterung des Lymphabflusses provozieren, sollten unbedingt saniert werden. Die Patienten sollten eingehend informiert werden über diese Zusammenhänge.
Charakteristika und Diagnostik
Das klinische Bild ist geprägt von Erythem, Fieber und Lymphadenitis. Man findet typischerweise flammenartig auslaufende, aber scharf begrenzte Hautrötungen (Erytheme) unterschiedlichster Rotschattierung sowie eine Schwellung der betroffenen Region. Bei tiefreichenden Infektionen können die Grenzen unscharf werden [12]. Bei schweren Verlaufsformen können Einblutungen, Blasenbildungen und Nekrosen vorkommen (Abb. 1). Die regional zugehörigen Lymphknoten sind geschwollen und imponieren bei der Palpation ggf. schmerzhaft.
- Mazerationen der Zwischenzehen/Zwischenfingerräume bei unzureichender Hygiene
- Ekzeme z. B. im Rahmen einer Tinea pedum, Psoriasis oder beim Atopischen Ekzem
- Insektenstiche
- Bagatellverletzungen (Kratzartefakte, Schürfungen)
- Chronische Wunden
Die Patienten beklagen meist, v. a. initial, eine deutliche Abgeschlagenheit, Frösteln, Schüttelfrost und Fieber. Im Labor zeigt sich eine Erhöhung von Leukozyten, BSG, CRP und ASL-Titer. Die Allgemeinsymptome können reduziert sein bei immunsupprimierten Patienten, älteren Personen oder rezidivierenden Verläufen.
Die Diagnose wird typischerweise klinisch, ggf. unter Zuhilfenahme der Laborparameter, gestellt. Einen spezifischen Test oder Score gibt es bisher nicht, was zu Fehldiagnosen führen kann [3]. Differenzialdiagnostisch abzugrenzen sind andere Erkrankungen, die mit lokalen Rötungen und Schwellungen einhergehen (Tabelle 1). Die Kontrolle der D-Dimere ist meist nicht geeignet zur differenzialdiagnostischen Abklärung zwischen Thrombose und Erysipel, da sie sowohl bei der Thrombose als auch bei entzündlichen Prozessen erhöht sein können.
Komplikationen
Bei rasch einsetzender antibiotischer Therapie ist das Erysipel therapeutisch gut anzugehen. Bei verzögertem Therapiebeginn, Patienten mit Immunsuppression oder Immunmodulation sowie Keimverschleppung (→ fehlende Ruhigstellung, Manipulationen) können Komplikationen entstehen. In Studien fanden sich als Risikofaktoren für Komplikationen Alter > 50 Jahre, weibliches Geschlecht, Herzerkrankungen, Nikotinabusus, Einnahme von Antibiotika und NSAR vor der stationären Aufnahme sowie eine beschleunigte BSG [11]. Möglich sind:- Blasenbildung mit exsudativer Entzündungsreaktion
- Einblutungen
- Fortschreiten der Bakterienaussaat →Phlegmone, nekrotisierende Fasziitis, Sepsis
- Endokarditis, Myokarditis
- Glomerulonephritis
- Post-Streptokokken-Erkrankungen
- Chronisches Lymphödem
Akuttherapie
Entsprechend der Ursache des Erysipels steht die systemische, kalkulierte Antibiose im Vordergrund. Zwar gibt es viele verschiedene Schemata, jedoch ist keines in randomisierten, kontrollierten klinischen Studien untersucht [12].
Da Streptokokken ausnahmslos hoch empfindlich gegen Penicilline sind, sind diese Therapie der ersten Wahl. Alternativ können Erythromycin oder Clindamycin zur Anwendung kommen, weisen aber Resistenzen von 10 – 20 % auf [12] (Tabelle 2). Die Antibiose sollte bei primärer Infektion 7 bis 10 Tage lang erfolgen, bei Rezidiven über ca. 10 – 20 Tage. Begleitend sind lokal kühlende Umschläge sinnvoll. Die betroffene Lokalisation sollte v. a. bei schweren Verläufen geschont und ggf. hochgelagert werden. Ist das Erysipel am Bein lokalisiert und wird der Patient immobilisiert, ist je nach Risikogruppe des Patienten eine ergänzende Thromboseprophylaxe erforderlich, wenngleich das Risiko einer tiefen Beinvenenthrombose beim Erysipel insgesamt als gering anzusehen ist [5]. Symptomatisch sollten Schmerztherapeutika und fiebersenkende Maßnahmen zur Anwendung kommen.
Die Akuttherapie kann beim unkomplizierten Erysipel ambulant und oral erfolgen. Bei schweren Verläufen oder Komplikationen ist eine stationäre Aufnahme mit intravenöser Systemantibiose des Patienten ratsam (Tabelle 3).
Sanierung der Eintrittspforte
Zu den entsprechenden Maßnahmen gehören:- optimierte Hygiene, ggf. auch Anwendung von Antiseptika, auch in schwer zugänglichen Lokalisationen, z. B. Bauchfalten, Leistenfalten, Zehenzwischenräumen
- ggf. Einlage von trockenen Kompressen in feuchten Hautfalten zur Verhinderung von Mazerationen
- rückfettende, regelmäßige Hautpflege
- bei Tinea pedum als Eintrittspforte sollte diese je nach Schweregrad mit lokalen und/oder systemischen Antimykotika behandelt werden
- regelmäßige medizinische Fußpflege bei Risikopatienten (z. B. Diabetes mellitus, Lymphödem)
- Vermeidung von Verletzungen z. B. bei der Gartenarbeit oder der Fußpflege
Rezidivprophylaxe
Als Risikofaktoren für ein Erysipel-Rezidiv gelten Lymphödeme, chronische venöse Insuffizienz, pAVK, Übergewicht und tiefe Beinvenenthrombose [6, 7, 10]. Wann immer möglich, sollten diese Risikofaktoren kausal behandelt werden. Kommt es dennoch zu rezidivierenden Verläufen eines Erysipels, so muss insbesondere die Frage nach potenziellen Triggerfaktoren gestellt werden:- Sind tatsächlich alle Eintrittspforten saniert?
- Besteht ein fortbestehendes Ödem oder eine Lymphabflussstörung in der betroffenen Region?
Ist mindestens eine dieser Fragen mit Ja zu beantworten, so sollte neben der Akuttherapie des Erysipel-Rezidivs zwingend der bestehende Triggerfaktor ausgeschaltet werden. Daneben empfehlen sich als additive Therapiemaßnahmen zur Rezidivprophylaxe Gewichtsnormalisierung und bei Ödemen das Tragen von medizinischen Kompressionsstrümpfen.
Bei häufigen Rezidiven trotz Ausschaltung aller Triggerfaktoren kann eine Prophylaxe mit systemischen Antibiotika sinnvoll sein [3]. Es gibt Studien mit verschiedenen Schemata mit einer Dauer von 6, 12 oder 18 Monaten [1, 2, 3, 8], Tabelle 2. Die existierende Evidenz beschränkt sich auf Patienten mit mindestens zwei Erysipel-Episoden des Beines innerhalb von drei Jahren.
In Deutschland finden sich im klinischen Alltag folgende Vorgehensweisen:- Intervalltherapie: alle drei Monate Penicillin G i.v. (10 Mio. IE über 10 Tage) [1]
- Dauertherapie: Penicillin V p.o., 250 mg/Tag p.o. 1 – 2 x/Tag über 6 Monate [2]
- Dauertherapie: Benzylpenicillin-Benzathin i.m. (1,2 – 2,4 Mio. IE alle 14 Tage) [2]
Alternativ oder ergänzend zur Dauer- oder Intervalltherapie können entsprechend erfahrene und aufgeklärte Patienten eine Notfallantibiose zur Akuttherapie erhalten, die sie mit dem Auftreten der bekannten Symptome (Rötung, Überwärmung, Fieber) auch eigenständig beginnen können, wenn eine unmittelbare ärztliche Vorstellung z. B. auf Reisen, an den Wochenenden oder Feiertagen nicht oder nur schwer möglich ist. Auf diese Weise kann das Risiko für einen schwerwiegenden, komplizierten und langwierigen Verlauf, bedingt durch einen verzögerten Behandlungsbeginn, für den Patienten vermieden und eine weitgehend uneingeschränkte Lebensführung ermöglicht werden.
Bewährt hat sich in unserer Einrichtung folgendes Vorgehen bei Erysipel-Rezidiven:- Ausreichend lange und ausreichend dosierte Systemantibiose im Akutfall (z. B. 21 Tage)
- Konsequente Entstauung und Kompressionstherapie bei Einsetzen der klinischen Besserung
- Beseitigung von Triggerfaktoren (z. B. chronische Stauung bei chronischer venöser Insuffizienz)
- Sanierung von Eintrittspforten (z. B. Tinea pedum)
- Frühzeitiger Therapiebeginn mit kalkulierter Systemantibiose bei erneutem Rezidiv
- Bei einem zweiten Rezidiv trotz konsequenter Beachtung der vorher genannten Punkte prophylaktische Systemantibiose.
Interessenkonflikte: Die Autorin hat keine deklariert
Erschienen in: Der Allgemeinarzt, 2018; 40 (4) Seite 37-40