Die diabetische Neuropathie zählt zu den häufigsten mikrovaskulären Störungen bei Diabetikern und wird oft erst spät diagnostiziert. Rund jeder dritte Diabetiker erkrankt an der Nervenfunktionsstörung. Verminderte Reizwahrnehmung, Kribbeln und Ameisenlaufen in den Füßen sowie neuropathische Schmerzen sind typische Symptome. Die Früherkennung ist eine wichtige Voraussetzung, um die Progression der Nervenschädigung aufhalten zu können und schwerwiegende Komplikationen wie ein diabetisches Fußsyndrom zu vermeiden.
Diabetes mellitus ist in den Industrieländern die wichtigste Ursache für die Entwicklung einer Neuropathie. Am häufigsten ist die distale sensomotorische Polyneuropathie (DSPN), die nach axonaler Nervenschädigung bereits in einem frühen Diabetesstadium auftreten kann. Aber auch die Markscheide betreffende, demyelinisierende Neuropathien können, meist im späteren Stadium, zur DSPN führen [1]. Häufige Symptome sind symmetrische Gefühlsstörungen in Füßen und Zehen (strumpfförmig), oft zusätzlich auch in den Händen (handschuhförmig). Selten kommt es zu fokalen und multifokalen Neuropathien, die es differenzialdiagnostisch zu berücksichtigen gilt (darunter auch Engpass-Syndrome wie Karpal- und Tarsaltunnelsyndrom).
Manifestationen und Symptome
Typische Symptome einer DSPN sind Minderwahrnehmung von sensiblen Reizen, z. B. Vibrations-, Druck- und Temperaturempfindung, vor allem in den unteren Extremitäten, Reflexabschwächung und motorische Symptome wie leichte Lähmungen und Muskelkrämpfe. In fortgeschritteneren Stadien kommen oft als brennend empfundene Schmerzen hinzu, die in Verbindung mit einer Allodynie (Wahrnehmung von normalerweise nicht schmerzhaften Reizen als Schmerzen) häufig zu Schlafstörungen führen. Neben der peripheren kann auch eine autonome diabetische Neuropathie in unterschiedlichen Organsystemen auftreten (Tabelle 1). Zum Beispiel kann eine Schädigung der Nerven am Herz-Kreislauf-System (autonome kardiale Neuropathie) zu Reizleitungsstörungen und verminderter Herzfrequenzvariabilität führen oder eine Schädigung der Nerven im Gastrointestinaltrakt mit Motilitätsstörungen oder dyspeptischen Symptomen einhergehen. Koinzidenzen beider Formen diabetischer Neuropathien bestehen bei bis zu 50 % der Betroffenen [2].
Häufigkeit und Risikofaktoren
Die Prävalenz einer DSPN wird laut Literaturdaten bei Typ-1- und -2-Diabetikern im Mittel auf rund 30 % geschätzt [2]. Aktuelle Daten der PROTECT-Studie [4] im Rahmen der nationalen Aufklärungsinitiative "Diabetes! Hören Sie auf Ihre Füße?" deuten allerdings darauf hin, dass diese Zahl vermutlich noch zu niedrig gegriffen ist. Bei etwa der Hälfte der Untersuchten, darunter sogar viele Nichtdiabetiker, wurde eine DSPN nachgewiesen und die meisten von ihnen wussten noch gar nichts von ihrer Nervenerkrankung. Zu den Risikofaktoren für eine DSPN zählen neben Diabetes mellitus, Diabetesdauer und schlechter Blutzuckerkontrolle auch ungünstige Ernährung, Vitamin-B1-Mangel, körperliche Inaktivität, Übergewicht, Alkohol- oder Tabakmissbrauch, hoher Blutdruck und Begleiterkrankungen mit negativem Einfluss auf das Nervensystem (z. B. Nierenerkrankungen oder indirekt neurotoxische Medikation).
Diagnostik
Um eine Neuropathie zu objektivieren, werden Temperaturempfinden (mittels Tip Therm®, Abb. 1) sowie Druck- bzw. Berührungsempfinden (10 g Monofilament, Abb. 2) und Vibrationswahrnehmung (128 Hz-Stimmgabel) der Füße überprüft. Von einer möglichen leichten distalen DSPN ist auszugehen, wenn einer der drei Tests auffällig ist, bei zwei von drei auffälligen Tests liegt wahrscheinlich eine mäßige und bei drei positiven Tests eine schwere DSPN vor [3].
Ausgewertet wurden in der PROTECT-Studie bisher die Ergebnisse von insgesamt 1850 Teilnehmern, darunter 943 Typ-2-Diabetiker, 126 Typ-1-Diabetiker und 781 Nicht-Diabetiker [4]. Eine DSPN wurde bei 55 % der Typ-2-Diabetiker, 44 % der Typ-1-Diabetiker und 48 % der Nichtdiabetiker festgestellt. Zu dem hohen Anteil unter Nichtdiabetikern haben vermutlich bisher nicht diagnostizierte Glukosestoffwechselstörungen beigetragen. Bei 35 % von ihnen wurde bei der HbA1c-Messung ein Prädiabetes, bei fast 4 % sogar ein manifester Diabetes nachgewiesen.
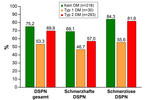
Obwohl rund zwei Drittel der Personen mit nachgewiesener DSPN Brennen und/oder Schmerzen in den Füßen angaben, wussten die meisten nichts von ihrer Neuropathie. Unter den Teilnehmern mit bekanntem Typ-2-Diabetes betrug der Anteil rund 70 %, unter Nichtdiabetikern 75 % (Abb. 3).
Rund ein Viertel bis 30 % der Betroffenen hatten eine schmerzlose DSPN, rund 15 % eine atypische DSPN mit Schmerzen nur beim Gehen. Parästhesien bzw. Taubheitsgefühl an den Füßen waren die häufigsten Symptome, Schmerzen nahmen in der Regel mit dem Schweregrad der Neuropathie zu. Bei Typ-2-Diabetikern korrelierte zudem eine schmerzhafte DSPN mit einem höheren Body-Mass-Index (BMI), während eine schmerzlose DSPN gehäuft mit niedrigerem BMI einherging. Darüber hinaus wurde bei Typ-2-Diabetikern die schmerzhafte und bei Nichtdiabetikern die schmerzlose DSPN mit einer peripheren arteriellen Verschlusskrankheit (pAVK) assoziiert.
Jährliches Neuropathie-Screening
Diese Daten machen deutlich, dass die Aufklärung über Neuropathie verbessert und die Empfehlungen zum regelmäßigen Neuropathie-Screening unbedingt befolgt werden sollten. Ein Screening auf sensomotorische und/oder autonome diabetische Neuropathie wird bei Typ-2-Diabetikern zum Zeitpunkt der Diagnosestellung und bei Patienten mit Typ-1-Diabetes spätestens 5 Jahre nach Diagnosestellung empfohlen [2]. Das Screening sollte eine ausführliche Anamnese, eine Inspektion der Füße, die Abklärung einer pAVK und einfache neurologische Tests wie die Prüfung des Achillessehnenreflexes sowie von Vibrations-, Druck- und Berührungsempfinden der Füße umfassen (beidseits!). Sind die Ergebnisse negativ, sollte einmal jährlich ein Neuropathie-Screening erfolgen. Bei einem Verdacht auf das Vorliegen einer Neuropathie wird eine Basisdiagnostik mit einer umfassenderen klinischen Untersuchung von Beinen und Füßen sowie einfachen neurologischen Tests empfohlen (Neuropathie-Symptom-Score, NSS, Neuropathie-Defizit-Score, NDS). Als Minimalkriterien für die Diagnose gelten:
- mäßig ausgeprägte neurologische Defizite (NDS 6-8 Punkte) mit oder ohne Beschwerden
oder
- leichte neurologische Defizite (NDS 3-5 Punkte) mit mäßig ausgeprägten Beschwerden (NSS 4-6 Punkte) [2].
Die Motorik wird getestet durch die Kontrolle der Spreizfähigkeit der Zehen, die Widerstandsprüfung der Streckung (Zehengang) sowie Beugung von Zehen (Krallen) und Füßen sowie die Testung des Fersengangs. Kann die Verdachtsdiagnose Neuropathie so nicht gesichert werden und gibt es keine andere Erklärung für die Symptomatik (z. B. pAVK), sollten die Patienten an einen Spezialisten überwiesen werden, der weiterführende Untersuchungen (Elektroneurographie und/oder quantitative sensorische Testung) vornehmen kann.
Durch adäquate Behandlung, am besten im Frühstadium einer diabetischen Neuropathie, können das Fortschreiten der Erkrankung und damit auch mögliche schwere Folgekomplikationen verhindert werden. Besonders gefürchtet sind diabetische Fußulzera, die durch eine Neuropathie an den Füßen begünstigt werden. Jährlich erfolgen in Deutschland mehr als 29.000 Amputationen bei Diabetikern, die auf das diabetische Fußsyndrom zurückzuführen sind [5].
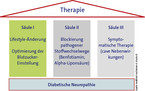
Therapie ruht auf 3 Säulen
Bei der Therapie der diabetischen Polyneuropathie hat sich ein 3-Säulen-Schema etabliert (Abb. 4):
- Optimierung der Blutzuckereinstellung, Kontrolle weiterer kardiovaskulärer Risikofaktoren wie Hypertonie und Hyperlipidämie und Lebensstilinterventionen. Empfohlen werden ein Verzicht auf Alkohol und Nikotin sowie viel körperliche Bewegung. Der günstige Einfluss einer optimierten Blutzuckereinstellung auf den DSPN-Verlauf konnte bisher allerdings nur für Typ-1-Diabetiker eindeutig belegt werden. In der DCCT-Studie z. B. reduzierte eine normnahe Diabeteseinstellung das Auftreten einer klinischen Neuropathie um 69 % (p = 0,006) nach 5 Jahren im Vergleich zur Kontrollgruppe [6]. Die Progression der Neuropathie konnte um 57 % gebremst werden. Hierfür war nicht die Therapieform, sondern der erreichte HbA1c-Wert entscheidend. Die Studiendaten bei Typ-2-Diabetikern zur neuroprotektiven Wirkung einer guten Blutzuckereinstellung sind nicht eindeutig.
- Blockierung pathogener Stoffwechselwege, die durch Hyperglykämie aktiviert werden. Einen hohen Stellenwert hat dabei die Gabe von Benfotiamin. Das fettlösliche Prodrug von Thiamin (Vitamin B1) hemmt pathogene Stoffwechselwege, die zur Entstehung von Neuropathien und Gefäßschäden beitragen wie den Hexosaminstoffwechsel, die verstärkte AGE (Advanced Glycation End-Products)-Bildung und die Aktivierung der Proteinkinase C [7]. Als weiterer pathogenetisch begründbarer therapeutischer Ansatz gilt die antioxidative Therapie mit Alpha-Liponsäure (Thioctsäure).
- Symptomatische schmerzlindernde Therapie. Bewährt haben sich bei neuropathischen Schmerzen vor allem Antikonvulsiva, Antidepressiva, langwirkende Opioide und topische Präparate wie Lidocain oder Capsaicin. Die Kombination von 2 oder 3 Wirkstoffen kann sinnvoll sein.
Empfehlenswert ist die Kombination von nicht-medikamentösen Maßnahmen mit einer pathogenetisch begründeten Basistherapie plus symptomatischer Schmerzbehandlung.
Ausgleich eines Vitamin-B1-Mangels
Ein ausreichend hoher Vitamin-B1-Status ist bei der Therapie einer diabetischen Neuropathie von hoher Bedeutung. Durch eine Supplementation der Thiamin-Vorstufe Benfotiamin können bereits vorhandene schmerzhafte und sensorische Neuropathie-Symptome gelindert werden. Bei Diabetikern ist eine ausreichende Versorgung mit Vitamin B1, das zum Schutz des Nervensystems beiträgt, häufig nicht gewährleistet. Denn der Vitamin-B1-Bedarf erhöht sich im Zustand der Hyperglykämie. Gefördert wird der Vitamin-B1-Mangel bei Diabetikern zudem durch die erhöhte Thiamin-Exkretion über die Niere [8, 9]. In einer britischen Studie waren die Thiamin-Plasmaspiegel bei Typ-1- und Typ-2-Diabetikern um rund drei Viertel niedriger als bei gesunden Kontrollpersonen (im Schnitt 15,3 bzw. 16,3 nmol/l vs. 64,1 nmol/l) (Abb. 5) [8]. Auch reichliche Zufuhr von Alkohol, Kaffee, schwarzem und grünem Tee, von Sulfiten (z. B. Trockenobst) oder von rohem Fisch (enthält Thiaminase) kann die Resorption von Vitamin B1 vermindern bzw. das Vitamin deaktivieren. Weitere Risikofaktoren für einen ausgeprägten Vitamin-B1-Mangel sind Darmerkrankungen und bariatrische Operationen.
Der Tagesbedarf an Vitamin B1 liegt nach Angaben der Deutschen Gesellschaft für Ernährung [10] bei Erwachsenen zwischen 1,1 mg/Tag (≥ 65-Jährige) und 1,3 mg/Tag (19- bis 25-Jährige, Schwangere, Stillende) und kann in der Regel über natürliche Quellen (Getreide, Hülsenfrüchte, Fleisch, Gemüse) gut gedeckt werden. Nach Zahlen der Nationalen Verzehrsstudie 2 liegt der Median der Vitamin-B1-Zufuhr in Deutschland bei Männern bei 1,6 mg/Tag und bei Frauen bei 1,2 mg/Tag [11]. Allerdings erreichen rund jeder fünfte Mann und jede dritte Frau die empfohlene tägliche Zufuhr von Vitamin B1 nicht. Dieser Anteil ist bei den Männern in allen Altersgruppen etwa gleich hoch. Bei den Frauen steigt der Anteil derjenigen, die den Referenzwert für Vitamin B1 nicht erreichen, von 25 % im Alter von 14 bis 18 Jahren auf 40 % im Alter von 65 bis 80 Jahren [8].
Folgen des Vitamin-B1-Mangels
Die Symptomentwicklung verläuft bei einem Vitamin-B1-Mangel schleichend, die Speicherung von Vitamin B1 im Körper (ca. 20 – 40 mg, vor allem in Hirn, Leber, Muskel, Niere) reicht nur für zirka 3 Wochen aus. Zu den Folgen eines anhaltenden Vitamin-B1-Mangels zählen – neben dem Vollbild Beri-Beri bei schwerem Mangel und weiteren internistischen Symptomen (Kardiomyopathie, Tachykardie, Magen-Darm-Störungen) – Schäden im peripheren und zentralen Nervensystem. Neue Studien belegen auch die wichtige Rolle von Vitamin B1 im Hirnstoffwechsel [12] und weisen auf einen Zusammenhang zwischen dem Nachweis inaktiver Thiamin-Metabolite im Blut und Morbus Alzheimer hin [13].
Im Körper wird Vitamin B1 in Thiamin-Diphosphat umgewandelt, die biologisch aktive Form des Vitamins. Studien zufolge wirkt Vitamin B1 nicht nur einer Neuropathie entgegen. Mit hochdosiertem Thiamin wurde in einer Studie bei Diabetikern mit Mikroalbuminurie die Proteinausscheidung verringert [14] und mit der Thiamin-Vorstufe Benfotiamin im experimentellen Setting eine diabetische Retinopathie verhindert [7]. Zudem gibt es erste Hinweise für einen Schutzeffekt von Vitamin B1 vor Demenz. In einer kleinen Pilotstudie bei Patienten mit Alzheimer-Demenz besserte sich unter der Gabe von Benfotiamin die Kognition.
Therapeutische Effekte
Zum Ausgleich eines Vitamin-B1-Mangels und zur Vorbeugung/Therapie von damit assoziierten Neuropathien ist das fettlösliche Prodrug Benfotiamin besser geeignet als wasserlösliche Thiamin-Salze. Denn während das Prodrug leicht passiv über Diffusion aufgenommen werden kann, muss Thiamin bei oraler Anwendung aktiv resorbiert werden. Neue Messungen belegen, dass bei Gabe von Benfotiamin im Blut und vor allem intrazellulär höhere Konzentrationen von Thiamin-Diphosphat erzielt werden als bei Anwendung von wasserlöslichen Thiamin-Salzen [15, 16].
Die Wirksamkeit von Benfotiamin bei Patienten mit diabetischer Polyneuropathie wurde in Studien belegt. In einer sechswöchigen Plazebo-kontrollierten Studie bei 165 Patienten mit DSPN war der Neuropathie-Symptomen-Score bei Studienende in der Per-Protokoll-Analyse bei Patienten unter hochdosiertem Benfotiamin (Wirkstoff in milgamma® protekt, 600 mg täglich) signifikant verringert. Unter den Beschwerden der Patienten verringerte sich das Symptom Schmerzen am stärksten. Die Verbesserungen waren ausgeprägter bei hochdosierter Therapie (600 mg vs. 300 mg täglich) und nahmen mit zunehmender Studiendauer zu [17]. Ähnliche Ergebnisse wurden in einer weiteren Plazebo-kontrollierten Studie über 3 Wochen bei insgesamt 40 Diabetikern mit Polyneuropathie erzielt, die mit täglich 400 mg Benfotiamin behandelt wurden [18]. Benfotiamin ist sehr gut verträglich. Aufgrund des Ausgleichs eines bei Diabetikern häufig auftretenden Vitamin-B1-Mangels und der positiven Beeinflussung der diabetischen Neuropathie bietet Benfotiamin Diabetikern einen umfangreichen Schutz.
Körpereigene Substanz Alpha-Liponsäure
Ein weiterer Ansatz einer pathogenetisch begründeten Therapie ist die Gabe von Alpha-Liponsäure, Co-Enzym bei oxidativer Decarboxylierung von Alpha-Ketosäuren. Alpha-Liponsäure ist Bestandteil des Pyruvatdehydrogenase-Komplexes, sodass eine enge Beziehung zu Thiamin, zum Glukosestoffwechsel und zum Energiehaushalt der Zellen besteht. Sowohl die antioxidativen Eigenschaften als auch die Optimierung der Energieversorgung von Nervenzellen erklären die in verschiedenen klinischen Studien nachgewiesene positive Wirkung von Alpha-Liponsäure bei der diabetischen Polyneuropathie. Sowohl für die intravenöse als auch orale Applikation von Alpha-Liponsäure wurde eine Reduktion neuropathischer Symptome nachgewiesen [19, 20].
Benfotiamin und Alpha-Liponsäure ergänzen sich in ihren Wirkmechanismen [21], sodass durch eine Kombination dieser beiden Substanzen eine Optimierung der Wirksamkeit bei diabetischer Polyneuropathie zu erwarten ist. In einer vierwöchigen Studie bei Typ-1-Diabetikern wurden mit der Kombinationstherapie (2 x 300 mg Benfotiamin, 2 x 600 mg Alpha-Liponsäure täglich) Marker Hyperglykämie-induzierter Stoffwechselwege verringert [22].
Individuelle Schmerztherapie
Bei Diabetikern mit Polyneuropathien und neuropathischen Schmerzen ist eine individuelle Schmerztherapie nötig, mit der möglichst früh begonnen werden sollte. Die Kontrolle neuropathischer Schmerzen ist eine Herausforderung. Als realistisches Ziel der Therapie gilt eine Schmerzreduktion um 30 bis 50 % auf der visuellen Analogskala [2]. Substanzen mit renalen und kardiovaskulären Langzeitrisiken wie NSAR und Coxibe sind bei der Therapie neuropathischer Schmerzen zu vermeiden. Am häufigsten eingesetzt werden Antikonvulsiva wie Pregabalin, Serotonin-Noradrenalin-Wiederaufnahmehemmer wie Duloxetin und Venlafaxin, trizyklische Antidepressiva sowie atypische Opioide wie Tramadol. Stärkste neuropathische Schmerzen können den Einsatz starker Opioide wie Oxycodon erfordern. Alternativen zur systemischen Schmerztherapie sind Capsaicin bzw. Lidocain, eventuell Botulinumtoxin. Der Algorithmus der medikamentösen Schmerztherapie wird derzeit überarbeitet.
Die Wirksamkeit der Pharmakotherapie sollte bei adäquater Dosis frühestens nach zwei Wochen beurteilt werden. Bei Wirkungslosigkeit sollte die Therapie abgesetzt werden. Sorgfältig beachtet werden sollte bei der systemischen Therapie der DSPN das hohe Risiko für Nebenwirkungen, Arzneimittelinteraktionen und die Abhängigkeitsgefahr. Zudem gibt es nicht selten Compliance-Probleme. Deshalb sollten ergänzende Therapien wie verhaltensmedizinische Interventionen, etwa zur Stressreduktion, oder alternative Verfahren wie Elektrotherapie oder Akupunktur nicht außer Acht gelassen werden.
Interessenkonflikte: Prof. Stracke hält Vorträge für Wörwag Pharma
Auf unserem CME-Portal www.med-etraining.de können Sie ab dem 04.10.2017 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Der Allgemeinarzt, 2017; 39 (15) Seite 56-61