Heute werden 90 % aller malignen Melanome in einem prognostisch günstigen frühen Stadium diagnostizert. Das könnte an einer besseren Aufklärung der Bevölkerung liegen und/oder an besseren diagnostischen Hilfsmitteln wie der Dermatoskopie. Im folgenden Beitrag sollen verschiedene Arten melanozytärer Hautveränderungen und maligner Melanome betrachtet und die Möglichkeiten der Früherkennung beleuchtet werden.
Das maligne Melanom ist ein bösartiger Tumor, welcher von den Melanozyten seinen Ursprung nimmt und primär die Haut betrifft. Daneben kann ein Melanom im Auge, an den Hirnhäuten und an der Schleimhaut entstehen. Während die meisten Melanome eine starke Pigmentierung haben, gibt es einen geringen Teil, der amelanotisch, d. h. nicht pigmentiert und damit viel schwieriger zu diagnostizieren ist. Melanome verursachen 90 % der Mortalität aller Hautkrebsarten [12].
Die Inzidenz des malignen Melanoms ist seit Jahrzehnten weltweit steigend, vor allem an Orten, wo hellhäutige, kaukasische Menschen einer hohen Sonneneinstrahlung ausgesetzt sind [8, 9, 17, 18]. In Mitteleuropa liegt die Inzidenz aktuell bei 10 - 20 pro 100 000 Einwohner/Jahr, in Australien, wo weltweit die höchste Neuerkrankungsrate beobachtet wird, bei 50 - 60/100 000/Jahr. Individuen mit einer hohen Anzahl an melanozytären Nävi und/oder atypischen (dysplastischen) Nävi haben ein erhöhtes Risiko, am malignen Melanom zu erkranken [3, 10, 14, 15]. Etwa 5 - 10 % der Melanome können auf genetische Ursachen mit polygener Vererbung zurückgeführt werden. Der wichtigste exogene Faktor ist die UV-Strahlung [6, 7, 24].
Gewöhnliche melanozytäre Nävi
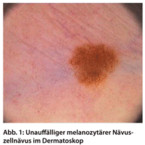
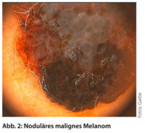
Die Gesamtzahl melanozytärer Nävi stellt den bedeutendsten Risikofaktor für die Entstehung eines Melanoms dar. Sie fungieren dabei als Indikator des Mutationsstatus des melanozytären Systems. Gewöhnliche melanozytäre Nävi (Abb. 1) messen in der Regel 2 - 5 mm, sind homogen hell- bis dunkelbraun pigmentiert, symmetrisch und regelmäßig begrenzt. Trotz etwas differenter Definitionen, Untersuchungsmethoden und verschiedener Populationen haben alle Studien zur Zahl melanozytärer Nävi übereinstimmend gezeigt, dass eine nahezu lineare, hochsignifikante Korrelation zwischen der Anzahl melanozytärer Nävi und dem Risiko für ein malignes Melanom (Abb. 2) besteht [11].
Atypische (dysplastische) melanozytäre Nävi
Atypische (histopathologisch dysplastische) melanozytäre Nävi werden bei ca. 5 % der Bevölkerung gefunden und sind auf den ersten Blick auffällig. Folgende klinische Merkmale sind für atypische melanozytäre Nävi charakterisitisch (drei Merkmale sollen erfüllt sein):
- Asymmetrie
- Begrenzung unregelmäßig
- Begrenzung unscharf
- Pigmentierung variierend in der Läsion
- Nebeneinander einer flachen und papulösen Komponente (oder nur flach)
Zahlreiche Untersuchungen konnten für atypische melanozytäre Nävi ebenfalls ein erhöhtes Melanomrisiko aufzeigen. Das relative Risiko stieg in allen Untersuchungen mit der Zahl der atypischen Nävi kontinuierlich an. Das jeweils höchste relative Risiko reichte vom 2,4-Fachen für mehr als einen atypischen melanozytären Nävus bis zum 32-Fachen für zehn oder mehr atypische melanozytäre Nävi. Das relative Risiko bei Personen mit einem dysplastischen Nävussyndrom reicht je nach Definition bis zum 500-Fachen.
Prognose und Stadien
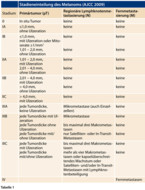
Ungefähr 90 % der Melanome werden als primäre Tumoren ohne Metastasierung diagnostiziert. Die Zehn-Jahres-Überlebensrate liegt bei solchen Tumoren bei 75 - 85 %. Melanome können lymphogen oder hämatogen metastasieren. Das Zehn-Jahres-Überleben beträgt 30 - 70 % bei Patienten mit Mikrometastasen, 30 - 50 % für Patienten mit Satelliten- oder In-Transit-Metastasen und 20 - 40 % für solche mit Makrometastasen in den regionären Lymphknoten. Bei Fernmetastasen überleben Patienten ohne Behandlung im Schnitt nur sechs bis neun Monate.
Vorgehen der Früherkennung
In der Früherkennung des Melanoms sind in den letzten zwei Jahrzehnten erhebliche Fortschritte gemacht worden. Heute wird beim größten Teil der Patienten die Diagnose bereits bei dünnen Melanomen (< 1,0 mm) und somit einer günstigen Prognose gestellt.
Hilfreich zur Melanomdiagnostik ist die ABCDE-Regel, treffen mindestens drei Punkte zu, sollte ein Hautarzt aufgesucht werden:
- A = Asymmetrie des Aufbaus
- B = Unscharfe und unregelmäßige Begrenzung
- C = Colorit inhomogen
- D = Durchmesser > 5 mm
- E = Evolution (Veränderung in den letzten drei Monaten)
Entsprechend gilt für Nagelveränderungen:
- A = Fortgeschrittenes Alter des Patienten
- B = Zunehmende Breite der Nagelpigmentierung (> 3 mm)
- C = Colorit inhomogen
- D = Ausdehnung vom Nagel auf den Nagelwall (Hutchinson-Zeichen)
- E = Evolution (Veränderung in den letzten drei Monaten)
- F = 1. und 2. Finger/Zehe und/oder Melanomerkrankung in der Familie.
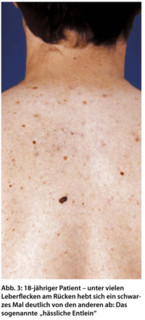
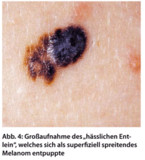
Die Bevölkerung soll zu risikoarmem Verhalten hin aufgeklärt werden. Als besonders wichtig gilt die Aufklärung von Risikogruppen (ältere Menschen, Personen mit multiplen melanozytären Nävi, Hauttyp I/II). Die Rolle der Eigenuntersuchung und Beobachtung von auffälligen Muttermalen wurde in Kampagnen oft unterstrichen [4, 19].
Differenzialdiagnosen
Als Differenzialdiagnosen kommen u. a. atypische (dysplastische) melanozytäre Tumoren, pigmentierte Basalzellkarzinome, Warzen, eine pigmentierte aktinische Keratose, thrombosierte Hämangiome, ein Glomustumor oder Hämorrhagien in Frage.
Dermatoskopie
Die Dermatoskopie (Auflichtmikroskopie, Abb. 5) ist eine nichtinvasive Untersuchungstechnik beim Melanom, die bei dem geübten Anwender eine bis zu 35 % höhere Sensitivität im Vergleich zur klinischen Untersuchung besitzt [1, 16]. Ebenfalls hilft die Dermatoskopie, benigne melanozytäre Hauttumoren richtig zu diagnostizieren und verhindert dadurch unnötige Exzisionen. Es werden die typischen Zeichen wie Asymmetrie, Begrenzung, Colorit, Durchmesser, noduläres Wachstum und Regressionszonen problemlos erkannt. Durch richtige Technik und Erfahrungswerte lässt sich die Sensitivität auf 89 % und die Spezifität auf 79 % steigern [16]. Bei Patienten mit sehr vielen Nävi und/oder atypischen Nävi empfiehlt sich eine digitale Fotodokumentation zur objektiven Verlaufskontrolle.

Erschienen in: Der Allgemeinarzt, 2010; 32 (11) Seite 46-48