Chronische Durchfälle mit entzündlichen Veränderungen im Darm sind beim Hausarzt häufig. Bei einer solchen Diarrhoe mit Blut im Stuhl, Bauchkrämpfen und Drangsymptomatik denkt der Arzt meist an eine infektiöse Ursache oder an eine chronisch-entzündliche Darmerkrankung (CED). Es gibt aber eine ganze Reihe von Differenzialdiagnosen, die nicht so einfach voneinander zu unterscheiden sind.
Jedes Jahr gibt es in Deutschland etwa 65 Millionen Episoden einer akuten Diarrhoe [4]. Beim Allgemeinarzt rangieren Durchfallerkrankungen an neunter Stelle [5]. Nach einer Evaluation des Baylor Medical Center in Dallas machen das Reizdarmsyndrom, gehäufte Stuhlgänge (mehr als drei pro Tag ohne spezifische Krankheit und ohne Leidensdruck), die anale Inkontinenz sowie die mikroskopische Kolitis (!) den Löwenanteil chronischer Durchfälle aus [1, 2, 3]. Chronische Durchfälle sind entweder malabsorptiv/osmotisch (z. B. Zöliakie, Pankreasinsuffizienz) oder sekretorisch/exsudativ (z. B. chronisch-entzündliche Darmerkrankungen, Nahrungsmittelallergien) bedingt. Als dritte Gruppe gibt es noch die funktionelle Diarrhoe, z. B. bei Reizdarmsyndrom [2, 18].
Dieser Beitrag beleuchtet die sekretorisch/exsudative Diarrhoe, die zu entzündlichen Durchfällen führt. Man unterscheidet dabei nicht-infektiöse von infektiösen Darmerkrankungen (Übersicht 1). Typische Symptome der entzündlichen Diarrhoe sind in Übersicht 2 aufgeführt.
- Chronische-entzündliche Darmerkrankungen (Morbus Crohn, Colitis ulcerosa)
- Mikroskopische (kollagene und lymphozytäre) Kolitis
- Ischämische Kolitis
- Medikamentös bedingte Kolitis: u. a. NSAR, Antibiotika, Ciclosporin, Methyldopa
- Radiogene (Strahlen-) Enterokolitis
- Divertikel-assoziierte Kolitis
- Mechanische Kolitis, z. B. Mukosaprolaps (Abb. 8)
- Diversionskolitis
- Chologene Diarrhoe
- u. a. Clostridium difficile, Lambliasis, Amöbiasis, Tuberkulose, Wurmerkrankungen, opportunistische Erreger bei HIV/Immunsuppression (CMV, HSV, Mikrosporidien)
- Anhaltende Durchfälle (vier Wochen)
- Blut-, Schleim-, Eiterbeimengung
- Schmerzen
- Urge-Symptomatik
- Fieber
- Erhöhte fäkale Entzündungsmarker (z. B. Calprotectin)
Die echte Diarrhoe ist charakterisiert durch mehr als drei tägliche Stuhlentleerungen von verminderter oder flüssiger Konsistenz (Stuhlwassergehalt über 80 %) oder ein Stuhlgewicht von mehr als 200 g pro Tag über mindestens vier Wochen. Am Anfang muss die echte Diarrhoe von Sonderformen wie Pseudodiarrhoe, paradoxer Diarrhoe und fäkaler Inkontinenz abgegrenzt werden [2, 5].
Als Marker einer intestinalen Entzündung wird Calprotectin im Stuhl immer bedeutsamer. Erhöhte Werte können bei allen entzündlichen Darmerkrankungen auftreten. Übersicht 3 zeigt die Ursachen ohne Vorliegen einer CED. Calprotectin ist ein unspezifischer Biomarker, eignet sich aber auch, um eine organisch-entzündliche Genese von funktionellen Störungen abzugrenzen [6, 7]. Basisparameter wie Nieren- und Leberwerte sollte man zudem kontrollieren und an mikrobiologische Stuhltests auf pathogene Keime (u. a. Salmonellen) und Parasiten (u. a. Wurmeier) denken. Bei Proktitis sollte ein rektaler Abstrich erfolgen (PCR etwa auf Chlamydien, Abb. 9). Bildgebende Verfahren sind zudem hilfreich (Abb. 2 und 3).
- Lambliasis
- Virale Gastroenteritis
- Dysentery (Ruhr)
- Helicobacter-pylori-Gastroenteritis
- Kolorektales Karzinom
- Magenkarzinom
- MALT-Lymphom
- NSAR
- PPI
- Erosive Refluxösophagitis
- Zystische Fibrose
Mikroskopische (kollagene und lymphozytäre) Kolitis
Bei wässrigen, unblutigen Durchfällen über vier Wochen muss man auch bei unauffälliger Mukosa Biopsien entnehmen, da man die mikro-skopische Kolitis nur so feststellen kann. Ältere Patienten über 60 sind am häufigsten betroffen, die Ursachen noch unklar. Neben dem Leitsymptom der wässrigen Diarrhoe können sich u. a. nächtliche Durchfälle und abdominelle Schmerzen zeigen. Es gibt aber kein erhöhtes Risiko für kolorektale Karzinome. Medikamentös ist die Effektivität nur für orales Budesonid (9 mg/Tag über acht Wochen) nachgewiesen. Die Remission liegt bei etwa 80 %. Nach Absetzen zeigt sich bei 60 % der Patienten die Symptomatik wieder. Eine Behandlung mit 6 mg pro Tag für ein halbes Jahr lässt sich anschließen. Auch sind Quellmittel (Flohsamenschalen, Chiasamen), Antidiarrhoika (Loperamid, Racecadotril), Gallensäurebinder (Cholestyramin) und eine Ernährungstherapie gut [8 – 14].
Ischämische Kolitis
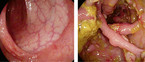
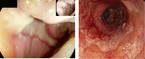
Durchblutungsstörungen des Kolons findet man überwiegend bei älteren Patienten mit Komorbiditäten. Meist liegt eine passagere Reduktion der intestinalen Perfusion vor, die spontan fortschreitet. Nicht-okklusive Mesenterialischämien oder okklusive Gefäßerkrankungen (Mesenterialarterienembolie) können auftreten. Es zeigt sich eine blande Symptomatik über krampfartige abdominelle Schmerzen bis zu blutigen Diarrhoen. Das gesamte Kolon kann betroffen sein. Eine periphere arterielle Verschlusskrankheit oder eine Niereninsuffizienz sollten hellhörig machen. Die Diagnostik umfasst Laborchemie (Laktat, pH-Wert, Kreatinkinase) und Bildgebung (z. B. Endoskopie). Die Therapie liegt in der Beseitigung der Perfusionsstörung (guter Blutdruck ohne Hypotonie), Volumengabe und gegebenenfalls Resektion des gangränösen Darmsegments. Bei leichteren Formen wartet man in der Regel ab, bis die Entzündungen aufhören [8, 15]. Die Symptome sind unspezifisch (u. a. Strikturen und Gangrän des Kolons, Abb. 4).
Medikamentös bedingte Kolitis
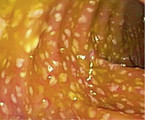
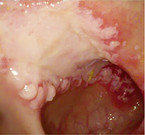
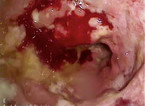
Nur wenige Medikamente führen zu entzündlichem Durchfall, wie nicht-steroidale Antirheumatika (NSAR)/ASS (Abb. 5) und Antibiotika. Setzt man sie ab, heilen die Läsionen meist nach etwa drei Wochen. Narbige Stenosierungen sind längerfristig möglich. Meist lösen NSAR-haltige Suppositorien mukosale Läsionen und Ulzerationen oder Strikturen in der anorektalen Region aus und sind eine Differenzialdiagnose zur Proctitis ulcerosa [16, 17]. Bei der antibiotikaassoziierten Diarrhoe (AAD)/Kolitis gibt es Subtypen: Die häufige einfache Form mit weichem, voluminösem Stuhl (typisch z. B. unter Ampicillin) ist Folge einer veränderten Mikrobiota. Die Durchfälle hören meist nach Absetzen des Antibiotikums auf. Prophylaktisch kann man die Antibiose z. B. mit einem Hefepräparat (Saccharomyces boulardii) kombinieren.
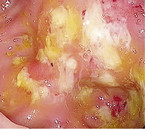
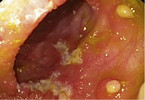
Die Clostridium-difficile-assoziierte Diarrhoe (CDAD) erklärt wohl bis zu 20 % der antibiotikaassoziierten Diarrhoen. Oft zeigen sich gelblich-schleimige Beläge (Abb. 6). Die Diagnose bestätigt sich durch positiven Toxin-Nachweis (Toxin A/B) im Stuhl. Ein kultureller Nachweis ist meist nicht nötig, sollte bei wiederholten Rezidiven und nosokomialen Ausbrüchen aber erfolgen. Eine lebensbedrohliche Form dieser CDAD ist die pseudomembranöse Kolitis. Bei Verdacht ist die Toxinbestimmung essenziell. Da es auch hier falsch negative Befunde gibt, testet man am besten wiederholt. Bei leichter bis moderater Form kann man Metronidazol dreimal 400 mg/Tag per os für mindestens zehn Tage geben. Bei schwerer Ausprägung sollte man mit Vancomycin viermal 125 – 250 mg/Tag per os für mindestens zehn Tage behandeln (ggf. mit Einläufen). Beim Rezidiv lässt sich Fidaxomicin zweimal 200 mg/Tag per os einsetzen. Bei rezidivierender oder therapierefraktärer Clostridium-difficile-Infektion ist eine Stuhltransplantation möglich.
Eine Sonderform der antibiotikaassoziierten Kolitis ist die segmentär-hämorrhagische Kolitis, die vor allem nach Penicillin und Penicillinderivaten meist bei jungen Patienten auftritt. Es zeigt sich eine zur gesunden Umgebung gut abgrenzbare ausgeprägte Wandverdickung des Kolons. Die Erkrankung ist selbstlimitierend nach Absetzen des auslösenden Antibiotikums [5, 18 – 22].
Aktinische oder radiogene (Strahlen-) Enterokolitis
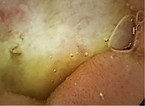
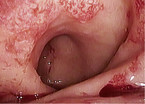
Die Strahlenenterokolitis kann nach jeder Strahlentherapie im kleinen Becken als Folge einer Schleimhautschädigung auftreten (Abb. 7). Wegen des Bestrahlungsfelds entwickelt sich meist eine Proktitis. Ab einer Bestrahlung mit 50 Gy treten sehr häufig Strahlenschäden auf. Die akute Form entwickelt sich innerhalb von drei Wochen nach Ende der Radiatio und ist nach drei bis sechs Monaten meist selbstlimitierend. Die chronische Form mit Fibrose und Neovaskularisation tritt verzögert nach Monaten oder sogar Jahren auf. Hauptsymptome sind chronisch wässrige Blutungen, die eine fäkale Inkontinenz vortäuschen können. Es zeigen sich Mukosaatrophie, Teleangiektasien (Abb. 7) und eine vermehrte Verletzlichkeit. Möglich sind auch Strikturen und Fisteln. Als symptomatische Maßnahmen gelten Stuhlregulierung, Antidiarrhoika (Loperamid, Kohle, Tinctura opii) oder Cholestyramin, aber auch antiinflammatorische Topika wie Mesalazin oder Budesonid. Aufgrund der schlechten Abheilung von Läsionen an der geschädigten Schleimhaut sollte man Biopsien nur zum Ausschluss eines Malignoms entnehmen [8, 23, 24, 26].
Segmentale Kolitis mit Divertikulose (SCAD)
Ob man die SCAD zu den chronisch-entzündlichen Darmerkrankungen zählen soll, ist nicht geklärt. Die entzündlichen Alterationen finden sich als fleckige Rötungen und aphthöse Läsionen zwischen den Divertikeln unter Aussparung der Divertikelöffnung. Die Prävalenz der SCAD liegt zwischen 1,15 und 11,4 %. Die häufigsten Symptome sind die Diarrhoe, gefolgt von rektalem Blutabgang und Bauchschmerzen. Die Therapie verläuft ähnlich wie bei chronisch-entzündlichen Darmerkrankungen, die Erkrankung meist mild. Die Basisbehandlung besteht aus ballaststoffreicher Ernährung und Quellmitteln (z. B. Chiasamen). Auch Antibiotika (Ciprofloxacin, Metronidazol) und Mesalazinpräparate waren in kleinen Studien erfolgreich. Eine immunsuppressive Therapie mit systemischen Kortikoiden, Azathioprin oder eine Resektion des divertikeltragenden Segments benötigen die wenigsten [25 – 29].
Interessenkonflikte: Der Autor hat keine deklariert
Erschienen in: Der Allgemeinarzt, 2019; 41 (2) Seite 20-23