Die chronisch venöse Insuffizienz (CVI) hat teilweise schwere Venenveränderungen wie defekte Venenklappen zur Folge. Je älter der Patient, desto höher sein Risiko für diese chronische Erkrankung der Beinvenen, die sich vor allem in venösen Abflussbehinderungen und Mikrozirkulationsstörungen zeigt. Während im Frühstadium noch Maßnahmen wie Gehtraining, Lymphdrainage und Kompression greifen, ist die Behandlung im fortgeschrittenen Stadium langwierig. Sie erfordert oft minimal-invasive Eingriffe wie Venenstripping oder sogar eine Operation.
Die chronisch venöse Insuffizienz (CVI) ist eine Insuffizienz der Venen, die durch venöse Hypertonie in der unteren Extremität bedingt ist [1]. Diese Volkskrankheit kann die Lebensqualität deutlich einschränken. In Deutschland leiden etwa jeder sechste Mann und jede fünfte Frau zwischen 18 und 79 Jahren daran [2]. Bei 3,3 % ist schon ein fortgeschrittenes Stadium festzustellen und 0,7 % haben venöse Ulcera [2].
Eine weitere ältere randomisierte Reihenuntersuchung aus Deutschland zeigt: 5 % der Bevölkerung sind wegen ausgeprägter, durch die CVI bedingter Beschwerden in ihrer Berufsausübung beeinträchtigt. 45 % der Betroffenen sind seit mehr als sechs Wochen arbeitsunfähig. 55 % der Patienten mussten den Arbeitsplatz wechseln, eine Umschulung machen oder ihren Beruf aufgeben [3]. Eine verbesserte Dia-gnostik und Therapie führen heute erfreulicherweise zu einem Rückgang der Morbidität [2, 4].
Die Varikose und ihre Formen
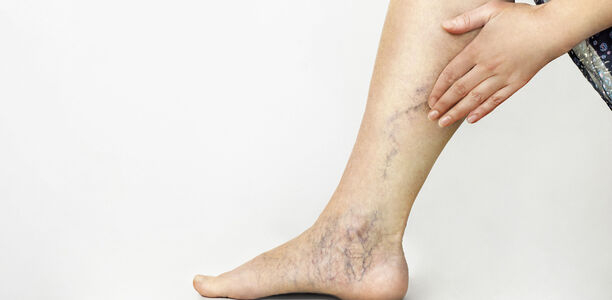
Die CVI basiert häufig auf einer Varikose, also auf Krampfadern. Die primäre Varikose zeigt ein intaktes tiefes Venensystem. Sie entsteht hauptsächlich durch eine vornehmlich familiär bedingte Veneninsuffizienz der oberflächlichen Venen im Bein. Die Krampfadern sind sackförmig oder zylindrisch erweiterte, oberflächliche Venen, die zu einer Insuffizienz der Venenklappen und damit zur venösen Hypertonie führen können. Im Verlauf zeigen diese oft eine charakteristische und sichtbare Schlängelung oder Knäuelbildung (Abb. 1).
Die Insuffizienz des tiefen Venensystems führt aufgrund der ausgeprägteren venösen Hypertonie meist zu schwereren CVI-Stadien und auch zu einer sekundären Varikose. Ursachen sind oft eine Stenose, ein Verschluss oder postthrombotische Veränderungen im tiefen Venensystem (Abb. 2).
Anatomisch unterscheidet man die Stammvarikose, d. h. eine Insuffizienz der V. saphena magna und/oder parva, die Perforansvarikose, eine Insuffizienz der Perforansvenen, und die retikuläre Varikose und Besenreiservarikose, eine oberflächlich sichtbare Venenzeichnung, die vorwiegend kosmetisch beeinträchtigend ist.
Die Stammvarikosen werden zunächst abhängig von der Suffizienz der Venenkrosse, d. h. dem Bereich der Einmündung der V. saphena magna und der V. saphena parva, in komplett (insuffizient) oder inkomplett (suffizient) unterteilt. Die weitere Einteilung nach Hach beschreibt den distalen Insuffizienzpunkt der Stammvarikose [5]. Die CVI wird unter anderem durch die Einteilungen nach Widmer, modifiziert nach Marshall und CEAP klassifiziert (Tabelle 1) [3, 6, 7]. International nutzt man standardmäßig das CEAP-System, das klinische (C), ätiologische (E), anatomische (A) und pathophysiologische (P) Gesichtspunkte einer Venenerkrankung in einem Code abbildet [7]. Diese umfangreiche Einteilung hilft auch, die komplexen individuellen Befunde einer Venenerkrankung besser klassifizieren und miteinander vergleichen zu können [7]. Im klinischen Alltag wird häufig lediglich die Klinik (C) bestimmt (Tabelle 2).
Risikofaktoren
Als Risikofaktoren für Venenerkrankungen ließen sich Geschlecht, Alter, Genetik, Adipositas, genetischer Hintergrund, Schwangerschaft und eine stattgehabte Thrombose ausmachen
[2, 4, 8]. Adipöse, ältere sowie schwangere Frauen haben ein deutlich höheres Risiko für eine chronisch venöse Insuffizienz [2, 4, 8]. Die familiäre Häufung konnte in einigen Studien ebenfalls als Risikofaktor für chronisch venöse Insuffizienzen identifiziert werden [8]. Andere Erhebungen zeigten dies lediglich für eine Varikose [2, 4].
Diagnostik
Nach einer CVI sollte man fahnden bei Patienten mit typischen Beinbeschwerden, Phlebitiden, Verdacht auf eine tiefe Beinvenenthrombose, trophischen Störungen und bei florierendem oder abgeheiltem Ulcus cruris venosum, d. h. einer offenen Stelle. Anamnestisch lassen sich folgende Beschwerden in der unteren Extremität festmachen: Schmerz, Krämpfe, Schwere oder Schwäche in den Beinen, Parästhesien und Pruritus. Mit dem CIVIQ-20-Score kann man zudem verlässlich die Auswirkung einer CVI auf den Alltag und die Lebensqualität des Patienten erheben [9], die zum Teil erheblich eingeschränkt ist.
Der Arzt sollte inspektorisch und palpatorisch Bein- und Fußschwellungen mit und ohne Einschluss der Zehen diagnostizieren, eine vermehrte Venenzeichnung wie die Varikose oder Besenreiser, Corona phlebectatica oder Atrophie blanche, Hyperpigmentierung, offene oder abgeheilte Wunden. So kann teilweise schon eine Stadieneinteilung erfolgen. Palpatorisch sind (nicht) eindrückbare Beinödeme, Faszienlücken und Venenverhärtungen zu eruieren. Differenzialdiagnostisch sollte man die arteriellen Pulse zum Ausschluss einer peripheren arteriellen Verschlusskrankheit tasten.
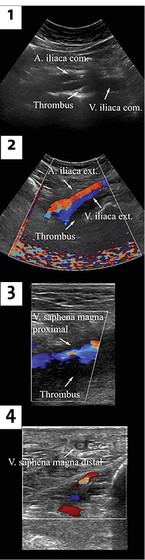
Im nächsten Schritt und um die CVI zu beurteilen, ist als Goldstandard die farbkodierte Duplexsonographie der epi-, trans- und subfaszialen Venen durchzuführen (Abb. 3). Dabei werden die Durchgängigkeit des tiefen Venensystems, die Lokalisation von (in)suffizienten tiefen Venen, Perforansvenen oder oberflächlichen Venen, die Mündungsklappeninsuffizienz und der Durchmesser der Venen bestimmt. Zudem kann man postthrombotisch veränderte Gefäße durch die Septenbildung, die verringerten Gefäßlumina, die verdickten Wände und eine verminderte oder eine Pendel-Perfusion diagnostizieren. Auch lassen sich Stenosen oder Verschlüsse feststellen. So kann der Arzt – zusammen mit der Klinik – die Diagnose und das Stadium einer CVI sicher feststellen.
Zur weiterführenden Diagnostik ist die Phlebographie bei einseitiger oder rezidivierender Varikose nach einem Eingriff, bei tiefer Beinvenenthrombose der V. iliacae oder V. cava inf. in der Vorgeschichte oder bei fehlendem Schallfenster, v. a. im Beckenbereich, zu empfehlen (Abb. 3). Alternativ kann eine Schnittbildgebung mit venöser Phase durchgeführt werden, sofern die Expertise besteht. Denn nicht selten stellt ein Abflusshindernis in Form einer Stenose, einer postthrombotisch veränderten Vene oder eines thrombotischen Verschlusses die Ursache dar, die heutzutage effektiv zu behandeln ist.
Therapie
Die Behandlung der CVI – vor allem auf Grundlage einer Varikose – wird unterschiedlich gehandhabt. In Deutschland hat die Behandlung nach der Deutschen Gesellschaft für Phlebologie folgende Ziele: Beseitigung bzw. Besserung der subjektiven Beschwerden, von Ödemen und trophischen Störungen sowie die Verhinderung der Verschlimmerung des CVI-Grades [1]. Hierzu zählen vor allem die Kompressionstherapie und physikalische Maßnahmen wie die Mobilisierung und das Gehtraining, aber auch die manuelle Lymphdrainage und die apparative intermittierende Kompression. Der Patient sollte zudem abnehmen und Wärme vermeiden. Nach Ausschöpfung der konservativen Maßnahmen sind invasive Optionen zu überlegen. Neben dem klassischen Varizenstripping gibt es zunehmend Alternativen wie die Varizenablation mit Radiofrequenzablation, die Lasertherapie und die Sklerosierung.In einer vergleichenden Studie wurden die minimal-invasiven Therapien mit dem Venenstripping prospektiv über drei Jahre verglichen [10]. 500 Patienten wurden in vier Gruppen aufgeteilt: Op., Radiofrequenzablation, Lasertherapie und Sklerosierung. Nach drei Jahren ergaben sich keine Unterschiede zwischen den Gruppen bei Effektivität und klinischer Verbesserung. Allerdings zeigten sich in der Sklerosierungsgruppe vermehrte Rezidive und Re-Eingriffe im Vergleich zu den anderen Behandlungsarmen.
Während die minimal-invasiven Eingriffe ambulant gemacht werden und die Patienten umgehend wieder mobil sind, ist mit der Operation unter Narkose ein stationärer Aufenthalt verbunden und die Rekonvaleszenzzeit deutlich länger. Komplikationen sind Hämatome, Phlebitiden, Parästhesien, Hyperpigmentation und Rezidiv. Als Kontraindikationen gelten eine akute tiefe Beinvenenthrombose, ein chronischer Beckenvenenverschluss und eine Infektion an der Punktionsstelle.
Bei chronischen Beckenvenenverschlüssen ist der interventionelle Eingriff mit Ballondilatation und Stentimplantation bei einer deutlichen Symptomatik ab dem Stadium C 3 angezeigt (Tabelle 2). Diese Behandlung in erfahrenen Zentren ist effektiv, kann die Beschwerdesymptomatik deutlich bessern und ein Ulcus cruris schnell zur Abheilung bringen. Nach der Beseitigung von Stenosen durch eine Dilatation und der Implantation von speziellen venösen Stents zeigten sich 5-Jahres-Offenheitsraten von bis zu 100 % bei Symptomfreiheit und in etwa 80 % kein erneutes Auftreten eines Ulcus cruris [11].
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2018; 40 (15) Seite 22-25