Aneurysmatische Erweiterungen der Bauchaorta prägen nicht nur den Arbeitsalltag von Gefäßspezialisten. Fast 95 % der in Deutschland praktizierenden Hausärzte betreuen einer aktuellen Umfrage zufolge Patienten mit abdominellem Aortenaneurysma (AAA). Da die Ruptur eines Aneurysmas mit einer hohen Letalität verbunden ist, ist es wichtig, den Befund regelmäßig zu kontrollieren und ggf. eine Operation frühzeitig zu planen.
Die Prävalenz des AAA variiert deutlich je nach Alter und Geschlecht des Patienten sowie der Größe des Befundes. Kleine AAA ab 3 cm Querdurchmesser haben eine Gesamtprävalenz von 4 – 8 % bei über 65-jährigen Männern und 0,5 – 1,5 % bei gleichaltrigen Frauen [3].
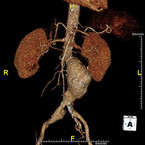
Der durchschnittliche Durchmesser der abdominalen Aorta beträgt geschlechts- und altersabhängig etwa 1,7 – 2 cm [14]. Ab einem maximalen Querdurchmesser von 3 cm spricht man von einem Aortenaneurysma (Abb. 1), während kleinere Erweiterungen zwischen 2,5 und 3 cm als Aortenektasie bezeichnet werden. Das in diesem Artikel behandelte Aneurysma verum (echtes Aneurysma) umfasst dabei alle drei Wandschichten. Bezüglich der Ätiologie ist das atherosklerotische AAA mit Abstand am häufigsten. Mit über 60 % gilt der abdominale Abschnitt als häufigste Lokalisation aller Aortenaneurysmata. Das rupturierte Aneurysma (rAAA) ist gegenüber dem intakten Aneurysma (iAAA) sehr viel seltener und hat eine hohe Letalität. Etwa ein Drittel der Patienten mit einem rAAA verstirbt bereits auf dem Weg in das Krankenhaus [8] und die Krankenhausletalität des rAAA beträgt in Deutschland verfahrensabhängig zwischen 20 % (EVAR) und 40 % (OAR) [18]. Demgegenüber liegt die Krankenhausletalität des iAAA nur bei 1,3 % (EVAR) bzw. 3,6 % (OAR) [17].
Pathophysiologie und Risikofaktoren
Zahlreiche Autoren sehen ein komplexes Zusammenwirken von inflammatorischen, proteolytischen und biomechanischen Prozessen in der Aortenwand, die deren strukturelle Integrität in der Folge einschränken und eine Aneurysmaexpansion ermöglichen. Umfangreiche Kohortenstudien konnten eine ganze Reihe an Risikofaktoren identifizieren, wobei das Rauchen mit einer Odds-Ratio von 5,07 mit deutlichem Abstand an erster Stelle liegt. Zu den weiteren Risikofaktoren zählen eine positive Familienanamnese, das Lebensalter und die Atherosklerose [9]. Aus den verschiedenen Risikofaktoren leiten sich auch die Empfehlungen zur konservativ-medikamentösen Therapie kleiner AAA ab. So sind neben der strikten Nikotinkarenz die Einleitung einer Statintherapie [5, 16] und die konsequente antihypertensive Therapie, z. B. mit einem Betablocker, von besonderer Bedeutung, um die Aneurysmaexpansion zu verzögern und das kardiovaskuläre Gesamtrisiko zu senken.
Symptome und Diagnostik des AAA
Nicht selten wird das AAA erst durch eine drohende bzw. stattgehabte Ruptur erkannt oder tritt als Zufallsbefund im Rahmen einer Routine- oder Screeninguntersuchung in Erscheinung. In der Regel bleibt das AAA bis zur Ruptur vollkommen symptomfrei. Verschiedene Beschwerden können jedoch auf das Vorliegen eines AAA hindeuten und sollten Anlass zu einer genaueren Untersuchung geben. Je nach Größe des AAA führt die Kompression umliegender Gewebestrukturen zu mehr oder weniger unspezifischen Beschwerden oder Schmerzen. Gelegentlich wird auch ein Pulsationsempfinden oder eine Obstipationsneigung beschrieben. Das rAAA äußert sich indes typischerweise durch die Symptomtrias aus Rücken- oder Abdominalschmerzen, Hypotension und einer pulsatilen abdominalen Raumforderung, wobei das Vollbild nur bei 25 – 50 % der Patienten auftritt [12, 15].
Die klinische Untersuchung hat mit einer Sensitivität von nur 29 % bei kleinen AAA eine untergeordnete Bedeutung [10] und muss daher durch verschiedene apparative Verfahren ergänzt werden. Aufgrund der hohen Auflösung, der Möglichkeit einer dreidimensionalen Therapieplanung und der flächendeckenden Verfügbarkeit gilt die kontrastmittelgestützte Spiral-Computertomographie (SCTA) mit einer Sensitivität von bis zu 100 % und einer Spezifität von bis zu 96 % weiterhin als Goldstandard in der Therapieplanung, insbesondere vor EVAR-Eingriffen. Aufgrund der Assoziation des AAA mit thorakalen Aneurysmen sollte dabei die gesamte Aorta evaluiert werden. Relevante Einschränkungen stellen die – zumindest vorübergehende – kontrastmittelassoziierte Nephropathie bei bis zu 50 % der Nierenvorerkrankten, eine Kontrastmittelallergie und eine Hyperthyreose dar. Daher sollten Risikopatienten (Bestimmung von Serum-Kreatinin, TSH, Allergiepass) rechtzeitig identifiziert und Gegenmaßnahmen (Vorbewässerung, Allergie-Prophylaxe, Thyreostatika) ergriffen werden.
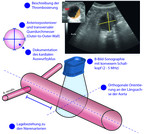
Für Primär- und Screeninguntersuchungen stellt die farbkodierte Duplexsonographie (CDUS) mit einer untersucherabhängigen Sensitivität und Spezifität bis zu 100 % das wichtigste diagnostische Verfahren dar. Einer repräsentativen Hausarztumfrage zufolge verfügen 70 % der Hausärzte über ein Ultraschallgerät und könnten die abdominelle Aorta somit untersuchen [7]. Die standardisierte Ultraschalluntersuchung des AAA sollte in der B-Bild-Sonographie streng orthogonal an der Stelle des maximalen Querdurchmessers erfolgen und eine Messung in anteriorposteriorer und transversaler Richtung beinhalten (vgl. Abb. 2). Die Lagebeziehung zu den Nierenarterienabgängen (infrarenal vs. juxtarenal vs. suprarenal) sollte ebenso dokumentiert werden wie die zeitliche Beziehung zum kardialen Auswurfzyklus (systolisch vs. diastolisch) und eine mögliche Thrombosierung. Die Autoren empfehlen eine Messung von Außendurchmesser zu Außendurchmesser (Outer-to-Outer-Wall).
Screening und Überwachung
Kontroverse internationale Diskussionen und die Ergebnisse randomisierter kontrollierter Studien haben dazu geführt, dass in England, den USA und in Schweden bereits Screeningprogramme zur Früherkennung des AAA etabliert wurden. In Deutschland steht eine Entscheidung über die Einführung eines Ultraschall-Screenings derweil noch aus; eine vorläufige Nutzenbewertung zum Ultraschall-Screening auf Bauchaortenaneurysmen des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) wurde vor kurzem veröffentlicht. Belegt ist demnach der Nutzen eines Ultraschall-Screenings auf AAA für Männer, während sich bisher keine Evidenz für einen Nutzen des Screenings für Frauen ergab. Die Empfehlungen zum Ultraschall-Screening und zur Verlaufskontrolle kleiner AAA gemäß den europäischen Fachgesellschaften sind Abb. 3 zu entnehmen.
Therapie des AAA
Von besonderer Bedeutung ist die rechtzeitige Erkennung und elektive Versorgung behandlungsbedürftiger Befunde im intakten Zustand (iAAA), da die Gesamtletalität nach einer Ruptur des AAA (rAAA) deutlich schlechter ausfällt. Grundsätzlich stehen für eine invasive Behandlung des AAA offen-chirurgische Verfahren (OAR; offen-chirurgische Aneurysmareparatur) und endovaskuläre Verfahren (EVAR; endovaskuläre Aneurysmareparatur) zur Verfügung, wobei die EVAR mittlerweile über 73 % der elektiven Prozeduren ausmacht [1].
Die Indikation zur invasiven Therapie ergibt sich grundsätzlich aus einer Gegenüberstellung des individuellen Rupturrisikos im Spontanverlauf gegen das Operationsrisiko. Übersteigt das Rupturrisiko im Spontanverlauf das individuelle Operationsrisiko, wird in der Regel die Indikation zur invasiven Therapie gestellt. Dies ist nach den aktuellen Leitlinien bei einem Querdurchmesser ab 5,2 cm (Frauen) bzw. spätestens ab 5,5 cm (Männer), bei rascher Größenprogredienz über 1 cm pro Jahr oder bei einer klinischen Symptomatik der Fall.
Zur präoperativen Risikostratifizierung vor elektiver Versorgung empfiehlt sich die Erhebung eines Risikoscores. Zur Verfügung steht hierfür unter anderem der sogenannte BAR-Score (www.britishaneurysmrepairscore.com), in den insgesamt elf Risikofaktoren eingehen. Bei Hinweisen auf ein erhöhtes kardiales oder anderes organspezifisches Risiko sollte stets eine rechtzeitige fachärztliche Begutachtung und ggf. Optimierung der eingeschränkten Organfunktion erfolgen.
Neben der offen-chirurgischen Therapie, die weiterhin zu den Hochrisikoeingriffen zählt, steht für die invasive Therapie des AAA die EVAR zur Verfügung, die neuesten Leitlinien zufolge nicht mehr als Hochrisikoeingriff gewertet werden muss. Während die perioperative Letalität der elektiven EVAR noch signifikant niedriger ausfällt (1,6 % bei EVAR vs. 2,7 % bei OAR) [11], hebt sich dieser Vorteil im Langzeitverlauf nach spätestens drei Jahren auf [6]. Für die Wahl eines der beiden Verfahren ist eine grundsätzlich gewissenhafte Begutachtung aller Begleitumstände erforderlich, um etwaige Kontraindikationen oder erschwerende Faktoren zu identifizieren. Nicht zuletzt sollte auch der Wunsch des Patienten und die Expertise des behandelnden Zentrums in die Therapieentscheidung einfließen, da diese signifikant mit dem Behandlungsergebnis assoziiert ist [2].
Postoperative Nachbetreuung
Abhängig von dem gewählten Therapieverfahren steht auch im postoperativen Verlauf die konsequente Optimierung der Risikofaktoren (Nikotinkarenz, Blutdruckeinstellung, Statintherapie) im Vordergrund. Aufgrund der thrombogenen Fremdmaterialien ist grundsätzlich die Etablierung einer lebenslangen Thrombozytenaggregationshemmung (z. B. mit ASS 100 mg) erforderlich. Für die oft ausgesprochene Empfehlung zu körperlicher Schonung und dem Vermeiden schwerer Lasten gibt es dagegen keine Evidenz, weshalb eine derartige Empfehlung nicht, auch nicht präoperativ, ausgesprochen werden sollte. Da es nach EVAR im Früh- und Spätverlauf zu sogenannten Endoleckagen mit Restperfusion des Aneurysmasacks und persistierender Rupturgefahr kommen kann, sind lebenslange bildgebende Verlaufskontrollen erforderlich. In der Regel findet eine computertomographische oder duplexsonographische Bildgebung mit Kontrastmittel vor der stationären Entlassung, nach drei bis sechs Monaten und im jährlichen Intervall statt. Besondere Beachtung verdienen die Typ-I-(proximale Abdichtungsstelle) und Typ-III-Endoleckagen (Defekt), da hier das residuale Rupturrisiko am größten ist.
- Das AAA hat mit einer geschlechts-, alters- und größenspezifischen Prävalenz von 4 – 8 % bei Männern und 0,5 – 1,5 % bei Frauen auch für die hausärztliche Versorgung eine besondere Relevanz: 95 % der hausärztlichen Kollegen versorgen AAA-Patienten.
- Für die invasive Therapie des AAA stehen konservative, offen-chirurgische und endovaskuläre Therapieverfahren zur Verfügung. Der EVAR-Anteil macht mittlerweile bis zu 73 % der elektiven Therapien aus.
- Für Männer über 65 Jahre besteht die Empfehlung zu einer einmaligen Ultraschalluntersuchung der abdominalen Aorta. Bei Frauen über 65 Jahre mit positiver Nikotinanamnese liegt bisher keine ausreichende Evidenz vor, eine Ultraschalluntersuchung kann aber erwogen werden.
- Für kleine AAA zwischen 3,0 und 5,0 cm ist eine engmaschige Ultraschalluntersuchung zu empfehlen. Die gefäßchirurgische Begutachtung und Therapieplanung sollte ab 5,2 cm (Frauen) bzw. ab 5,0 – 5,5 cm (Männer) erfolgen.
- Eine Indikation zur raschen gefäßchirurgischen Begutachtung und Therapieplanung besteht bei symptomatischem AAA oder rascher Größenprogredienz (> 1 cm / Jahr).
- Alle AAA-Patienten sollten eine strikte Nikotinkarenz einhalten, ein Statin und eine antihypertensive Therapie erhalten, um das operative und kardiovaskuläre Gesamtrisiko zu senken.
- Nach OAR und EVAR ist die lebenslange Thrombozytenaggregationshemmung (z. B. ASS 100 mg) erforderlich. Für eine körperliche Schonung gibt es keine Evidenz.
- Aufgrund der Gefahr von Endoleckagen sind nach EVAR lebenslange bildgebende Verlaufskontrollen erforderlich.
Interessenkonflikte: Der Autor hat keine deklariert.
Erschienen in: Der Allgemeinarzt, 2015; 37 (13) Seite 30-35