Patienten mit rheumatologischen Systemerkrankungen haben ein erhöhtes Risiko, an einer Infektion zu erkranken. Dies ist zum einen durch die Grunderkrankung selbst, zum anderen durch die Behandlung mit Immunsuppressiva bedingt. Da Infektionen die Mortalität von Rheumapatienten wesentlich mitbestimmen, gilt es, diese frühzeitig zu erkennen und zu behandeln, besser jedoch, sie zu verhindern.
Im Vergleich zur Normalbevölkerung ist das Infektionsrisiko bei Patienten mit verschiedenen rheumatologischen Systemerkrankungen erhöht. Patienten mit einer rheumatoiden Arthritis besitzen z. B. ein etwa eineinhalbfach bis doppelt erhöhtes Infektionsrisiko [1, 2]. Dieses Risiko ist sowohl durch die Grunderkrankung selbst als auch durch deren immunsuppressive Therapie bedingt. Gerade nach Einleitung einer immunsuppressiven Therapie ist daher besonders auf Infektionen zu achten und sind geeignete Strategien wie Impfungen oder prophylaktische Maßnahmen zu erwägen [6 - 10].
Infektionen als Todesursache
Infektiöse Komplikationen verursachen eine erhebliche Komorbidität. So muss beispielsweise etwa die Hälfte aller Patienten mit rheumatoider Arthritis damit rechnen, innerhalb von zwölf Jahren wegen einer schwerwiegenden Infektion hospitalisiert zu werden [1, 5, 6, 13]. Bei Patienten mit systemischem Lupus erythematodes sind etwa 20 % der Todesfälle auf Infektionen zurückzuführen, dies sind nahezu ebenso viele Patienten, wie an der Grunderkrankung selbst versterben [3 - 5].
Infektionsrisiko unter Kortikosteroiden
Bakterien sind die mit Abstand bedeutsamsten Krankheitserreger bei Rheumapatienten und verursachen ca. 80 - 90 % aller Infektionen, am häufigsten werden Haut- und Weichteilinfektionen, Infektionen der oberen und unteren Atemwege und Harnwegsinfekte beobachtet. Patienten mit rheumatoider Arthritis sind außerdem einem besonders hohen Risiko für Gelenk- und Knocheninfektionen ausgesetzt [1, 11, 12].
Das Risiko für die Entwicklung relevanter Infektionen ist stark abhängig von der beim Patienten eingesetzten immunsuppressiven Therapie. Eine hochdosierte Kortikosteroidtherapie respektive eine langandauernde Medikation oberhalb von 7,5 mg Prednisolonäquivalent erhöhen das Infektionsrisiko dosisabhängig. Insbesondere eine Therapie mit Dosierungen von über 10 mg Prednisolonäquivalent/Tag führt zu einem eineinhalbfach bis vierfach erhöhten Infektionsrisiko [13, 14], wohingegen eine Low-dose-Kortikosteroidapplikation nur ein gering erhöhtes Infektionsrisiko birgt [16]. Eine Kortikosteroidtherapie erhöht außerdem das Risiko, an opportunistischen Infektionen zu erkranken, um ungefähr das Eineinhalbfache, und an einer Tuberkulose zu erkranken, um ungefähr das Doppelte [14, 15].
Infektionsrisiko unter Basismedikamenten
Zur Einsparung von Kortikosteroiden werden bei Aktivität der zugrunde liegenden rheumatischen Erkrankung häufig sogenannte Basismedikamente verordnet. Insbesondere DMARDs (Disease modifying antirheumatic drugs) wie Methotrexat, Leflunomid oder Azathioprin sind ein wichtiges Standbein der Therapie rheumatischer Systemerkrankungen.
Studienergebnisse belegen, dass eine Methotrexattherapie einen selteneren Risikofaktor für schwere Infektionen darstellt [17]. Insbesondere bei Hinweisen für eine Infektion der oberen Atemwege mit persistierendem Husten und Luftnot sollte eine Assoziation zur DMARD-Therapie diskutiert werden und eine rheumatologische Vorstellung erfolgen.
Biologica
Die seit dem Jahr 2000 zugelassenen biologischen Medikamente haben die Therapiemöglichkeiten von Patienten mit rheumatologischen Erkrankungen enorm verbessert. Trotz der insgesamt guten Verträglichkeit ist eine Kenntnis des Sicherheitsprofils für den behandelnden Arzt von entscheidender Bedeutung. Bisher sind die TNF-α-Blocker Adalimumab, Certolizumab, Etanercept, Golimumab und Infliximab zur Behandlung verschiedener rheumatischer Erkrankungen zugelassen. Eine Anwendung der Substanzen im empfohlenen Dosisbereich zeigte eine leichte Erhöhung des Risikos schwerer Infektionen im Behandlungsverlauf [19]. Dieses besteht vor allem in den ersten sechs Monaten einer neu begonnenen TNF-α-Blocker-Therapie, so dass Patienten besonders in dieser Phase hinsichtlich des Auftretens von Infektionen überwacht werden sollten [18].
Für die neueren biologischen Medikamente respektive Non-TNF-α-Biologika wie Rituximab (B-Zellen depletierender Antikörper), Abatacept (gegen CD 80/86 gerichtetes Fusionsprotein) sowie Tocilizumab (Interleukin-6-Rezeptor-Antagonist) liegen bislang lediglich Daten aus kontrollierten Studien und deren Metaanalysen vor. In Analogie zu den TNF-α-Inhibitoren ist auch bei Einsatz dieser Therapeutika von einem leicht erhöhten Infektionsrisiko auszugehen [21, 22]. Dabei gibt es Hinweise dafür, dass insbesondere Abatacept ein günstiges Risikoprofil bezüglich des Auftretens schwerer Infektionen zu haben scheint [20].
Generell sollte unter allen immunsuppressiven Therapien ein engmaschiges Monitoring bei Patienten mit rheumatologischen Systemerkrankungen stattfinden. Vonseiten der rheumatologischen Fachgesellschaft ist diesbezüglich zu allen Basismedikamenten ein entsprechendes Informationsblatt mit detaillierten Empfehlungen zur Therapieüberwachung im Internet abrufbar ( http://dgrh.de/therapieueberwachen.html ).
Spezielle Infektionen unter immunsuppressiver Therapie
Der Einsatz von TNF-α-Blockern führt zu einem signifikanten Anstieg des Risikos, an einer Tuberkulose zu erkranken (Risiko je nach Klinik und TNF-α-Blocker bis 25-fach erhöht [23]), wobei das Risiko unter einer Therapie mit den Antikörpern (Adalimumab, Certolizumab, Golimumab, Infliximab) höher als bei einem Einsatz des löslichen TNF-α-Rezeptors Etanercept einzuschätzen ist [24].
Tuberkulose
Vor Beginn einer immunsuppressiven Therapie mit TNF-α-Blockern ist daher ein Tuberkulosescreening obligat, um eine latente Tuberkulose auszuschließen. Das Screening beinhaltet neben Anamnese und klinischer Untersuchung ein Röntgen des Thorax sowie einen In-vitro-Bluttest (z. B. QuantiFERON®-Test). Laut Empfehlung der Deutschen Gesellschaft für Rheumatologie (DGRh [29]) sollte bei Patienten mit Hinweisen auf eine latente Tuberkulose eine neunmonatige Prophylaxe mit Isoniazid in Kombination mit Vitamin B6 durchgeführt werden. Idealerweise beginnt diese Prophylaxe einen Monat vor Erstapplikation des TNF-α-Blockers [24].
Hepatitis B und C
Unter immunsuppressiver Therapie kann eine persistierende Hepatitis-B-Virus-Infektion aktiviert werden, was zu fulminant verlaufenden Hepatitiden mit akutem Leberversagen oder Tod führen kann [25 - 27]. Daher wird empfohlen, vor Einleitung einer immunsuppressiven Medikation ein geeignetes Screening (z. B. anti-HBs, anti-HBc, HBs-Ag) durchzuführen [28]. Von einer Therapie mit TNF-α-Blockern sollten HBV-Infizierte, bei denen Virus-DNA nachweisbar ist (aktive Hepatitis B), ausgeschlossen werden, eine Behandlung mit TNF-Blockern ist in diesen Fällen kontraindiziert [29 - 32]. Bei chronischen Verlaufsformen ist eine virostatische Therapie zu prüfen.
Die Anwendung von TNF-Blockern bei bekannter Hepatitis C scheint aufgrund der aktuellen Daten relativ sicher zu sein [33 - 34], wobei die bisherigen Erfahrungen auf kleinen Fallzahlen beruhen [35, 36]. Eine immunsuppressive Therapie sollte daher aufgrund der unzureichenden Studienlage bei Patienten mit Hepatitiden nur unter engmaschiger Kontrolle der Klinik und Paraklinik und in enger Kooperation mit einem Infektiologen oder Hepatologen erfolgen.
Pneumocystis-jiroveci-Pneumonie
Eine weiterhin gefürchtete Infektion, insbesondere bei Anwendung hochpotenter Immunsuppressiva wie Cyclophosphamid, ist die Pneumocystis-jiroveci-Pneumonie.
Die Inzidenz dieser Lungenentzündung bei immunsuppressiv behandelten Patienten mit entzündlich-rheumatischen Erkrankungen beträgt bis zu 2 % in Abhängigkeit von Erkrankung und Therapie. Die Mortalität ist hoch und liegt sogar deutlich über der bei HIV-Patienten [37]. Risikofaktoren für eine Infektion stellen Prednisolon-Tagesdosen > 20 mg sowie eine Behandlung mit Cyclophosphamid dar.
Infektionsprophylaxe
Impfungen sind generell bei Patienten mit rheumatologischen Erkrankungen sinnvoll und - unter Beachtung der bekannten Risiken - auch sicher anzuwenden [38 - 39]. Dennoch weisen nach wie vor viele Patienten nur einen unzureichenden Impfschutz auf, der sich zumeist auf einem Mangel an Information und Furcht vor Nebenwirkungen gründet [40].
Immunsuppressive Therapien mit DMARDs wie Methotrexat, Leflunomid oder Sulfasalazin beeinflussen eine Impfantwort nur geringfügig, wohingegen sich Hinweise auf eine Abschwächung der Impfantwort unter Behandlung mit TNF-Blockern, besonders in Kombination mit MTX, ergeben. Dennoch ist in den meisten Fällen davon auszugehen, dass ein ausreichender Infektionsschutz durch Impfungen auch unter Immunsuppression erreicht werden kann [39, 41].
Im Gegensatz zu Patienten, die mit TNF-Blockern behandelt werden, ist nach Therapie mit dem Biologikum Rituximab, welches eine B-Zell-Depletion bewirkt, eine deutliche Verminderung der humoralen Immunantwort festzustellen, was sich besonders in einer verminderten Immunantwort auf eine Pneumokokkenvakzine in den ersten sechs Wochen nach der Behandlung niederschlägt [42 - 43].
Gerade Patienten, die durch ihre Grunderkrankung und die erforderliche immunsuppressive Therapie ein erhöhtes Infektionsrisiko aufweisen, können von einer Impfung profitieren. Es gibt weiter keine sicheren Hinweise, dass bei Patienten in Remission durch Impfungen eine Verschlechterung der Grunderkrankung oder unerwartete Nebenwirkungen in verstärktem Umfang ausgelöst werden.
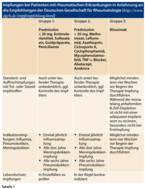
Klinische Empfehlungen und praktisches Vorgehen zu Impfungen bei Rheumapatienten sind in Tabelle 1 in Anlehnung an die Empfehlungen der Deutschen Gesellschaft für Rheumatologie dargestellt.
Eine Impfung sollte am besten vor Einleitung einer immunsuppressiven Therapie erfolgen, insbesondere bei Lebendimpfungen, die unter immunsuppressiver Medikation in der Regel kontraindiziert sind [39]. Vor einer geplanten Therapie mit Rituximab sollten Impfungen aufgrund einer verminderten Antwort nach der Therapie gleichfalls rechtzeitig (etwa vier Wochen vor der geplanten Therapie) durchgeführt werden.
Die europäische Gesellschaft für Rheumatologie publizierte im Frühjahr dieses Jahres erstmalig Empfehlungen zur Impfung bei Patienten mit entzündlich-rheumatischen Systemerkrankungen, die im Folgenden auszugsweise dargestellt sind [44]:
- Bei jeder Erstvorstellung eines Patienten sollte der Impfstatus kontrolliert werden.
- Impfungen sollten unter stabilem Krankheitsverlauf stattfinden.
- Eine Impfung mit Lebendimpfstoffen sollte bei Patienten unter Immunsuppression vermieden werden.
- Unter immunsuppressiver Therapie mit DMARDs (z. B. MTX, Leflunomid) sowie TNF-α-Blockern kann jederzeit eine Impfung mit Nicht-Lebend-Impfstoffen (Konjugate, Toxoid, Totimpfstoff) erfolgen.
- Bei Rituximab sollten Impfungen vor Therapiestart komplettiert werden.
- Eine Influenza-Impfung ist generell empfohlen.
- Eine Pneumokokken-Impfung ist generell empfohlen.
Sowohl die zugrundeliegende Erkrankung als auch die zumeist dauerhafte immunsuppressive Basistherapie bei Rheumapatienten birgt ein erhöhtes Risiko für Infektionen. Daher ist eine engmaschige Kontrolle der Patienten obligat. Präventive Maßnahmen zur Prophylaxe von Infektionen wie Impfungen sollten den Empfehlungen der Fachgesellschaften entsprechend umgesetzt werden. Bei Anzeichen infektiöser Komplikationen bei Patienten mit rheumatischen Systemerkrankungen unter Immunsuppression wäre die rasche Vorstellung der Patienten bei einem Rheumatologen wünschenswert.

Erschienen in: Der Allgemeinarzt, 2011; 33 (12) Seite 20-23