Für eine erfolgreiche Therapie bei Asthma und COPD ist es von immenser Bedeutung, die Diagnose korrekt zu stellen, penibel zu differenzieren und die Krankheitsaktivität wiederholt zu überprüfen. Nur so kann die Therapie an wechselnde Situationen adaptiert werden.
Bei ACO ist die Basis der Therapie die Eindämmung der asthmatischen Entzündung, wobei sich die Intensität der antientzündlichen Therapie nach der Intensität der asthmatischen Schleimhautentzündung richtet. Die symptomatische Therapie des COPD-Anteils ist dann "nur" noch Ergänzung bzw. Vervollständigung.
Die unterschiedlichen Therapiemöglichkeiten und Ziele sind die Gründe, warum es immens wichtig ist, eine korrekte Diagnose zu stellen und zwischen den "drei" Krankheitsbildern möglichst exakt zu unterscheiden:- Bei Asthma ist die antientzündliche Therapie mit einem ICS (Kortison zur Inhalation) ein MUSS, alle anderen Substanzen sind Ergänzung, niemals Ersatz.
- Beim leisesten Verdacht auf ACO gilt vorrangig eine Therapie wie beim Asthma.
- Bei COPD sind Bronchodilatatoren ein MUSS, alle anderen Substanzen Ergänzung.
- ICS ist indiziert bei Exazerbationen trotz dualer Bronchodilatation.
- Systemische Glukokortikoide sind
- bei akuter Exazerbation (AECOPD) ein MUSS,
- in der Langzeittherapie nicht sinnvoll (nur negative Effekte).
Für eine optimale Therapie gilt es somit, bei jeder obstruktiven Atemwegserkrankung ein Asthma oder eine asthmatische Entzündung mit Sicherheit nachzuweisen/auszuschließen und die Intensität der asthmatischen Entzündung für die korrekte Bemessung der Therapie zu erfassen.
Für die Therapie der COPD gilt es, die Symptomatologie und das Exazerbationsrisiko möglichst genau zu beurteilen und die Therapie darauf abzustimmen.
Die Entzündung beim Asthma
Beim Asthma handelt es sich überwiegend um eine eosinophile Schleimhautentzündung (Tabelle 2). Die Zahl der Eosinophilen im Sputum korreliert sehr gut mit der Schwere des Asthmas. Deren Nachweis signalisiert die Ansprechbarkeit auf ICS und deren Zahl die Intensität der Entzündung. Wegen ihres großen Aufwandes wird diese Methode jedoch nur in wissenschaftlichen Untersuchungen angewandt.
Die Lungenfunktion mit Bronchospasmolysetest gibt uns die Möglichkeit zur indirekten Beurteilung der Entzündungsintensität. Ein großes Δ-FEV1 ist der Hinweis auf eine starke Entzündung und das Verschmelzen der zwei Kurven bestätigt die totale Eindämmung der Entzündung (Abb. 1).
Die Peak-Flow-Messung (PEF) als "kleine" Lungenfunktion gibt vergleichbar zur Lungenfunktion Hinweise auf die Stärke der Entzündung. Ein Anstieg der Werte, eine Abnahme der Tagesschwankungen und bei Messung vor und nach Inhalation eines Bronchodilatators die Annäherung der Werte bzw. der zwei Kurven im Diagramm belegen eine Abnahme der Entzündung. Die Peak-Flow-Messung lässt sich auch gut zur Steigerung der Patienten-Mitarbeit nutzen. Rüstet man einen Patienten gleich zu Therapiebeginn mit einem Peak-Flow-Meter aus und bittet ihn, die Werte regelmäßig zu messen und zu dokumentieren, können die für den Patienten sichtbaren Verbesserungen einen wertvollen Beitrag zur Steigerung der Therapiebereitschaft und Adhärenz leisten.
NO in der Ausatemluft
Bei Vorhandensein von Eosinophilen wird in der entzündeten Schleimhaut NO gebildet, das in der Ausatemluft nachgewiesen und gemessen werden kann (FeNO = fraction exhaled NO). Die Höhe des gemessenen FeNO-Wertes ist proportional zur Stärke der Entzündung. Die Sensibilität der FeNO-Messung im Vergleich zur Lungenfunktion belegt Abb. 2. Bedauerlich ist, dass diese sensible Messung nur als IGeL-Leistung angeboten werden kann.
Bronchiale Provokation
Jeder Mensch reagiert bei einer bronchialen Provokation, d. h. nach Inhalation von Acetylcholin oder Methacholin, mit einer Bronchokonstriktion, der Kranke aber bei geringeren Konzentrationen als der Gesunde. Von Nachteil ist, dass die Menschen unterschiedlich auf die zwei Substanzen reagieren. Auch hier besteht eine gute Korrelation von Stärke der Entzündung und Konzentration des Inhalates (PC20 = Konzentration, die zu 20 % Abfall des FEV1 führt). Diese Untersuchung eignet sich wegen des Zeitaufwandes und des schnellen Verfalls der Untersuchungslösung nicht für die hausärztliche Praxis.
Die Beurteilung der Therapie bei der COPD
Bei der Therapie der COPD fehlen uns leider technische Untersuchungsmöglichkeiten zur Beurteilung der Therapieeffektivität. Auf der einen Seite ist die Therapie nicht so effektiv wie beim Asthma, so dass fast immer "Restbeschwerden" resultieren. Auf der anderen Seite fehlen überhaupt Möglichkeiten, die Intensität der Entzündung und damit den Therapieeffekt korrekt beurteilen und die Therapie darauf abstimmen zu können.
Aus diesen "schlechteren" Voraussetzungen resultiert leider zu oft eine Unterdosierung – oftmals erfolgt nach Ersteinstellung keine Anpassung mehr – oder eine Polypragmasie, bei der der Patient ungeachtet einer Notwendigkeit fast schon kritiklos alles erhält, was der Markt hergibt. In beiden Fällen besteht große Gefahr, dass eher mit negativen Effekten für die Patienten zu rechnen ist.
Die medikamentöse Therapie erfolgt in Stufen je nach Ausgangssymptomatik:- Beginn mit einem Bronchodilatator (LAMA oder LABA)
- Hinzufügen eines zweiten Bronchodilatators (LAMA + LABA = Duale Therapie) bei unzureichender Symptomlinderung bzw.sofortiger Beginn mit dualer Therapie bei ausgeprägter Symptomatik.
Bis zu diesem Punkt erfolgt die Therapie heute ungeachtet der Tatsache, ob es sich um einen Patienten mit oder ohne Exazerbationen handelt. Hier wird den neuesten Erkenntnissen Rechnung getragen, dass beide Bronchodilatatoren auch das Exazerbationsrisiko senken können. Im Gegensatz dazu gelingt dies mit einem ICS nur bei COPD im fortgeschrittenen Stadium (FEV1 > 40 %) [1]. Erst wenn unter ausreichender Bronchodilatation (mono oder dual) noch Exazerbationen auftreten, ist der Einsatz von ICS zu erwägen, aber bei ausbleibendem Erfolg innerhalb eines Jahres auch wieder zu beenden.
Die Steigerung der Therapie erfolgt nicht nach dem Ergebnis einer Lungenfunktionsuntersuchung, sondern in Abhängigkeit von noch vorhandenen Symptomen [2, 3]. Neben den Fragen nach "Restbeschwerden" bleibt uns in der Praxis nur der Untersuchungsbefund, die Zwerchfellhöhe, Atembreite und Auskultation, alles leider nur Beurteilungskriterien, aus denen eher ein Gefühl für das Befinden eines Patienten abgeleitet werden kann, als ein auch nur annähernd korrektes und reproduzierbares Urteil, an dem sich eine Therapie festmachen lässt.
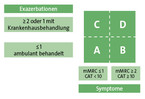
Die internationalen und nationalen Leitlinien empfehlen, die Symptomschwere und die Häufigkeit erlittener Exazerbationen zu ermitteln [2, 3]. Mit Hilfe der Ergebnisse wird der Patient einer Gruppe A–D (Abb. 3) zugeordnet und erhält die dafür angemessene Behandlung. Für die Bemessung der Symptomlast soll bevorzugt der CAT (COPD-Assessment-Test) verwendet werden, weil er im Gegensatz zum mMRC (modified Medical Research Council) nicht nur die Schwere der Dyspnoe erfragt, sondern auch Tätigkeiten im normalen Alltag bemisst.
CAT (COPD-Assessment-Test)
Der Fragebogen besteht aus acht Fragen (Tabelle 3), die in sechs Stufen graduiert beantwortet werden sollen. Aus den Antworten wird eine Punktzahl ermittelt, nach der dann die Gruppenzugehörigkeit ermittelt wird (Abb. 3). Leider ist der CAT nicht weit verbreitet und wird offensichtlich vor allem wegen des relativ hohen Aufwandes und der fehlenden Praktikabilität für die tägliche Arbeit in der Praxis wenig genutzt.
mMRC (modified Medical Research Council)
Ergänzend zum CAT kann die modified Medical Research Council (mMRC)-Dyspnoeskala verwendet werden (Tabelle 4). Mit ihr wird die Schwere der Atemnot beurteilt. Im Gegensatz zum CAT fehlt die Einschätzung des Alltagslebens. Dafür besticht dieser Test durch seine Praktikabilität und leichte und schnelle Durchführbarkeit im täglichen Praxisalltag. In einer Untersuchung mit der bisher größten Teilnehmerzahl (n = 26.230) konnte eine sehr große Korrelation von mMRC und Lungenfunktion nachgewiesen werden [4].
Bei aller Diskussion über Vor- und Nachteile dieser Vorschläge zur Ermittlung von Symptomlast, Exazerbationshäufigkeit und -risiko und Bemessung der Therapie sollten wir uns vor Augen halten, dass wir subjektive Eindrücke des Patienten zu quantifizieren versuchen. Die Ergebnisse werden unterschiedlich ausfallen, je nach gutem oder schlechtem Befinden des Patienten in den letzten Tagen. Erschwerend kommt hinzu, dass diese Ergebnisse praktisch nicht reproduzierbar sind.
Der Aufwand dieser Erhebungen steht zudem in keinem Verhältnis zur anfallenden Entscheidung. Letztendlich soll primär ausschließlich entschieden werden, ob der Patient mit einem Bronchodilatator ausreichend therapiert ist oder einen zweiten benötigt. Der Einsatz eines ICS kommt erst infrage, wenn unter der dualen Bronchodilatation noch Exazerbationen auftreten. Und jeder Arzt wird bei noch vorhandenen Beschwerden eine Steigerung der Therapie vornehmen ungeachtet der ermittelten Symptomlast.
Nach Kenntnis des Autors gibt es bis dato noch keine Vergleichsuntersuchung, die die geschilderten Verfahren vergleicht mit einer einfachen Steigerung der Therapie, in Abhängigkeit von anamnestisch erhobenen Informationen zu aktuellen Beschwerden oder Einschränkungen im Tagesverlauf.
Wollen wir eine bessere Versorgung unserer COPD-Patienten, besteht die dringende Notwendigkeit, eine Methode zu entwickeln, die dem Kollegen in der Praxis auf leichte Art und Weise schnell die Frage beantwortet, ob der Patient mit einer COPD gut eingestellt oder eine Steigerung der Therapie nötig ist.
Dr. med. Thomas Hausen
Interessenkonflikte: Der Autor hat Honorare für Beratung und Vorträge von Aerocrine, Bayer, Berlin-Chemie und Novartis erhalten.
Erschienen in: Der Allgemeinarzt, 2020; 42 (1) Seite 16-20