Achalasie bezeichnet eine beim Schluckakt unzureichende Erschlaffung des unteren Speiseröhrenschließmuskels. Sie zählt zu den primären Beweglichkeitsstörungen der Speiseröhre. Weil die Erkrankung selten und daher nicht jedem Behandler bekannt ist, verzögert sich oft die Diagnosestellung. Wir geben hier einige hilfreiche Tipps.
Klassische Symptome der Achalasie sind Dysphagie, Regurgitation und thorakale Schmerzen, die zu einer erheblichen Einschränkung der Lebensqualität und zu einer unzureichenden Ernährung führen können. Das Risiko für pulmonale Komplikationen und die Entstehtung eines Ösophaguskarzinoms ist erhöht.Der Beginn der Erkrankung ist oftmals schleichend, weshalb die Patienten sich mit langsam progressiven Symptomen arrangieren und individuelle Strategien entwickeln, um mit den Beschwerden zurechtzukommen [1].
Pathogenese
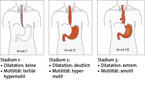
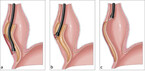
Aus bislang ungeklärter Ursache kommt es bei der Achalasie zu neurodegenerativen Prozessen im autonomen Nervensystem der Speiseröhre. Insbesondere die Nervenzellen, die für die Erschlaffung des unteren Speiseröhrenschließmuskels verantwortlich sind, sind bei der Achalasie geschädigt. Als ursächlich wird eine Autoimmunreaktion diskutiert. Die Erkrankung wird nach der Morphologie in drei unterschiedliche Stadien eingeteilt (Abb. 1).
Sekundäre Achalasie/Pseudoachalasie
Sekundäre Achalasien sind Erkrankungen, die ein ähnliches Krankheitsbild wie die Achalasie aufweisen, aber eine andere Ursache haben. Mögliche Ursachen sind Verengungen der Speiseröhre aufgrund von Krebs oder peptischen Stenosen. Andere Erkrankungen sind beispielsweise Amyloidose, Sarkoidose, Neurofibromatose oder eosinophile Ösophagitis. Eine Pseudoachalasie sollte grundsätzlich ausgeschlossen werden.
Diagnostischer Algorithmus
Zunächst sollte anamnestisch herausgearbeitet werden, um welche Form der Schluckbeschwerden es sich handelt. So ist die ösophageale Dysphagie abzugrenzen von "Schluckschmerzen" (Rachenschmerzen z. B. bei Angina oder Erkältung), dem "Globusgefühl" (Schilddrüsenerkrankung, Stress, Angst etc.), der "oropharyngealen Dysphagie" oder "Verschlucken" und der "Odynophagie" (retrosternale Schmerzen beim Schlucken ohne Steckenbleiben des Nahrungsbolus).
Anamnese
Bei der ösophagealen Dysphagie kommt es Sekunden nach dem Schlucken von fester oder flüssiger Nahrung zum Gefühl des Steckenbleibens. Begleitet wird dieses Symptom oftmals von Regurgitationen (dem Hochwürgen unverdauter Nahrung). Regurgitationen sind anamnestisch klar von Reflux (Aufstoßen von saurem Mageninhalt) abzugrenzen. Dysphagie und Regurgitation können mit Brustschmerzen und ungewolltem Gewichtsverlust einhergehen. Diese vier Beschwerden sollten mit gezielten Fragen erfasst und quantifiziert werden. Sie gehen in einen gemeinsamen Score zur Bestimmung des Schweregrades der Symptome ein [3].
Ösophagogastroduodenoskopie
Bei einer Schluckstörung (Dysphagie) oder Schmerzen beim Schlucken (Odynophagie) sollte grundsätzlich eine Endoskopie erfolgen. Bei älteren Patienten (ab 45 Jahren) sind als wichtigste Differenzialdiagnosen eine Krebserkrankung oder peptische Stenosen der Speiseröhre auszuschließen. Zeigt sich ein unauffälliges Bild, so sollte eine Stufenbiopsie der Speiseröhre zum Ausschluss einer eosinophilen Ösophagitis erfolgen.
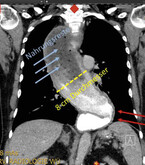
Typisch für die Achalasie ist eine Engstellung des Übergangs zwischen Speiseröhre und Magen. Zusätzlich kann eine Weitstellung der tubulären Speiseröhre vorliegen. Bei fortgeschrittenen Formen der Achalasie können Aussackungen der unteren Speiseröhre entstehen (sog. sigmoidale Transformation, Abb. 2). Oftmals können trotz ausreichender Nüchternheit verbliebene Speisereste in der Speiseröhre (Malclearance) endoskopisch detektiert werden. Ein Pilzbefall der Speiseröhre ("Soor-Ösophagitis) liegt bei Achalasie ebenfalls gehäuft vor. Zum Beginn der Erkrankung oder auch bei kurzer Erkrankungsdauer kann endoskopisch ein nahezu unauffälliger Befund vorliegen.
Funktionsdiagnostik (Manometrie)
Die ösophageale hochauflösende Manometrie sollte nach Ausschluss einer sekundären Achalasie bei allen Patienten mit einer vermuteten Motilitätsstörung der Speiseröhre zur Anwendung kommen, sie ist für die Diagnosesicherung der Goldstandard [1, 4]. Bei dieser Untersuchung wird eine Drucktopographie der Speiseröhre in Echtzeitmessung durchgeführt. Basierend auf den Messergebnissen der Manometrie wird die Achalasie nach Pandolfino in drei verschiedene Subtypen unterteilt [4]. Diese Klassifikation hat Auswirkungen auf die Prognose und die Therapieplanung.
Bei der Achalasie-Typ-I findet keine koordinierte Bewegungswelle der Speiseröhrenmuskulatur statt. Dies bezeichnet man auch als Aperistaltik. Bei einer Achalasie-Typ-II kommt es ausschließlich zu simultanen Muskelanspannungen. Es finden sich weder eine gerichtete Bewegungswelle noch ein Erschlaffen des unteren Speiseröhrenschließmuskels. Beim Typ III werden in der Manometrie ungerichtete, krampfartige Bewegungen im unteren Teil der Speiseröhre gemessen. Bei allen Formen der Achalasie erschlafft der untere Speiseröhrenschließmuskel am Ende des Schluckaktes nicht.
Breischluckuntersuchung
Die Breischluckuntersuchung dient dazu, die Nahrungspassage durch die Speiseröhre und den Magen während des Schluckens darzustellen. Demzufolge ist diese Untersuchung geeignet, Funktionsstörungen des Schluckakts darzustellen. Darüber hinaus werden auch krankhafte Veränderungen der Speiseröhren-Anatomie sichtbar, z. B. eine Aufweitung der Speiseröhre.
Therapie
Eine wirkungsvolle konservative und/oder medikamentöse Therapie steht nicht zur Verfügung. Muskelerschlaffende, sog. spasmolytische Medikamente können aber zusätzlich zur Verbesserung von Krämpfen und Brustschmerzen verschrieben werden. Die derzeitig zur Verfügung stehenden interventionellen und operativen Behandlungsmöglichkeiten können die Erkrankung zwar nicht ursächlich behandeln, führen aber zumeist zu einer sehr guten Beschwerdereduktion und verbessern die Lebensqualität betroffener Patienten im Langzeitverlauf [5–7] bei nur sehr geringem Risiko [8–13]. Generell ist zu empfehlen, dass Patienten in Zentren mit entsprechender diagnostischer und therapeutischer Expertise, die alle gängigen Verfahren in guter Qualität vorhalten und die Lernkurven der Verfahren erfolgreich durchlaufen haben, behandelt werden sollten [3–5].
Botox-Injektion (BTx)
Die endoskopische Injektion von Botulinumtoxin (Botox) hat keinen relevanten therapeutischen Stellenwert, da die muskelerschlaffende Wirkung meist nur wenige Wochen anhält. Das Verfahren kommt aber zur Diagnostik zum Einsatz: So kann eine versuchsweise Injektion von Botox bei unklaren Fällen klären, ob die so erzielte Muskelerschlaffung zu einer Verbesserung der Symptomatik führt.
Ballondehnung/Pneumatische Dilatation (PD)
Die endoskopische pneumatische Dilatation ist ein wirkungsvolles Verfahren. Eine prospektiv randomisierte Studie zeigt in einem Nachsorgezeitraum von bis zu fünf Jahren eine ähnliche Effektivität im Vergleich zur chirurgischen Myotomie [6]. Kritisch anzumerken ist allerdings, dass sich während der Studie und insbesondere im Vorfeld häufiger Ösophagusperforationen ereigneten [6, 16]. Eine aktuell publizierte Metaanalyse bescheinigt der gezielten chirurgischen Myotomie hinsichtlich einer niedrigeren Rate schwerwiegender Komplikationen Vorteile [17]. Die meisten Studien zur Ballondilatation zeigen im Langzeitverlauf eine niedrigere Effektivität als die Myotomie [12, 14, 15]. Viele Patienten benötigen mehrere Dilatationen im Verlauf [11, 14]. Die Anzahl der durchgeführten Dilatationen kann andererseits das Ergebnis und Risiko einer später doch notwendigen Myotomie negativ beeinflussen [18].
Laparoskopische Heller-Myotomie
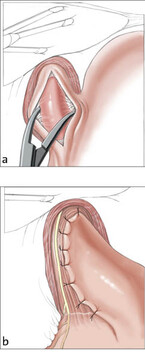
Ernst Heller publizierte bereits 1913 das chirurgische Prinzip der Myotomie (Muskelspaltung) des Übergangs von Speiseröhre und Magen (Abb. 4a, b). Die Operation wird heute routinemäßig laparoskopisch durchgeführt und zumeist mit einer der ventralen Fundoplicatio nach Dor kombiniert. Hiermit kann dem postoperativen Auftreten von Sodbrennen wirksam entgegengewirkt werden [19]. Diese Operation führt in bis zu 90 % der Fälle zu einer langfristigen Aufhebung oder relevanten Besserung der Schluckbeschwerden [5, 7, 14].
Perorale endoskopische Myotomie (POEM)
Bei der rein endoskopischen Durchführung der Myotomie wird mittels Endoskopie in der Speiseröhre die Schleimhaut eröffnet und ein Tunnel bis an den Übergang zum Magen geschaffen [8, 20]. In diesem Bereich erfolgt dann die Myotomie analog zur Operation nach Heller (Abb. 5a–c). Der entstandene Schleimhautdefekt wird anschließend wieder verschlossen.Bisherige Daten zeigen eine mindestens genauso gute Symptomkontrolle bezüglich der Dysphagie wie die Heller-Myotomie, jedoch ist eine erhöhte Rate für einen postoperativen Reflux beschrieben. Allerdings ist dieser Reflux meist konservativ gut zu beherrschen und häufig nicht belastend für die Patienten. Aufgrund technischer Vorteile und der Möglichkeit einer langstreckigen Myotomie scheint das POEM- Verfahren klare Vorteile für Patienten mit einer Typ-3-Achalasie zu bieten.
Falls es nach einer Operation nur zu einem unzureichenden Therapieansprechen kommt, können sämtliche interventionellen und operativ zur Verfügung stehenden Verfahren in Abhängigkeit von der vermuteten Ursache der Beschwerden nach ausführlicher Diagnostik und sorgsamer individueller Nutzen-Risiko-Einschätzung eingesetzt werden [5, 11, 14, 21].
Ösophagusresektion
Ist die Speiseröhre durch die ständige Nahrungsretention stark aufgeweitet und amotil, so ist es möglich, dass das chirurgische Prinzip der gezielten Myotomie keinen ausreichenden Therapieerfolg mehr bringt. In solchen Fällen kann als Ultima Ratio eine Teilentfernung der Speiseröhre indiziert sein. Grundsätzlich gilt, dass bei einer solchen Entscheidung eine sorgsame Nutzen-Risiko-Abwägung insbesondere unter Berücksichtigung des Leidensdrucks und des individuellen Risikoprofils des Patienten sowie der Expertise des Zentrums erfolgen sollte [2].
- Aufgrund der erschwerten Nahrungsaufnahme ist die Lebensqualität der Patienten mit Achalasie erheblich reduziert. Das Risiko für Pneumonien, sekundäre Essstörungen und die Entstehung eines Speiseröhrenkarzinoms ist erhöht.
- Bei Patienten mit Schluckstörung sollte als primäre Diagnostik eine Endoskopie zum Ausschluss einer Pseudoachalasie durchgeführt werden.
- Die Manometrie ist der Goldstandard zur Diagnostik einer Achalasie oder primären Motilitätsstörung der Speiseröhre.
- Patienten mit entsprechenden Symptomen sollten einem spezialisierten Behandlungsteam vorgestellt werden, um eine Verzögerung der Therapie zu vermeiden.
- Konservative und medikamentöse Therapien haben in der primären Behandlung der Achalasie einen untergeordneten Stellenwert.
- Mit den heute zur Verfügung stehenden interventionellen und operativen Verfahren kann meist eine gute Symptomkontrolle erreicht werden.
- Die laparoskopische Heller-Myotomie und die perorale endoskopische Myotomie bieten mittel- bis langfristig sehr gute Ergebnisse bezüglich der Symptomkontrolle bei einer Verfahrenssicherheit, die der endoskopischen Ballondilatation überlegen zu sein scheint.
- Das POEM-Verfahren bietet insbesondere Vorteile bei der spasmodischen Form (Typ 3) der Achalasie, die Heller-Myotomie hat Vorteile bei einer stark sigmoidalen Transformation der Speiseröhre.
- Bei nicht ausreichendem Therapieerfolg können Revisionsverfahren nach dezidierter Diagnostik in Abhängigkeit von der vermuteten Ursache nach individueller Nutzen-Risiko-Einschätzung gezielt eingesetzt werden.
Interessenkonflikte: Der Autor hat keine deklariert
Erschienen in: Der Allgemeinarzt, 2020; 42 (12) Seite 38-41