Eine diabetische Neuropathie besteht bei Diabetikern oft bereits im Frühstadium der Erkrankung. Zur Früherkennung ist ein regelmäßiges Screening erforderlich, das allerdings in der Praxis noch nicht konsequent umgesetzt wird. Um ein Fortschreiten der Nervenschäden zu verhindern und die Symptomatik zu verringern, sollten alle Möglichkeiten der Intervention genutzt werden. Dazu zählen eine Optimierung der Blutzuckereinstellung, die Anleitung zu einem gesunden Lebensstil, die Blockade pathogener Stoffwechselwege und eine adäquate Therapie neuropathischer Schmerzen.
Diabetische Neuropathien sind häufige Komplikationen bei Diabetes-Patienten und werden in der Praxis oft unterschätzt. Die Daten zur Prävalenz der diabetischen Neuropathie variieren stark. Ein Drittel bis zu 50 % der älteren Personen mit einem Typ-2-Diabetes können eine diabetische Neuropathie aufweisen [1]. 13 bis 26 % der Diabetiker weisen eine schmerzhafte Neuropathie auf [3]. Typisch sind auch Missempfindungen wie Kribbeln oder Taubheitsgefühle in den Extremitäten. In bis zu 50 % der Fälle kann die diabetische Neuropathie asymptomatisch verlaufen [22]. Aus diesem Grund wird die Diagnose häufig erst mit großer Verzögerung gestellt.
Formen der Neuropathie
Die Neuropathie kann- das somatische Nervensystem
- das autonome Nervensystem betreffen.
Beide Formen der diabetischen Neuropathie gehen nicht nur mit einer deutlich verringerten Lebensqualität einher, sondern korrelieren auch mit einem erhöhten Risiko für weitere Komplikationen und einer erhöhten Mortalität. Eine autonome Neuropathie kann jedes autonom innervierte Organ betreffen, z. B. Magen-Darm-Trakt, Blase, Geschlechtsorgane oder Herz und Gefäße. Bei Diabetikern mit kardiovaskulärer autonomer diabetischer Neuropathie (KAN) – Kennzeichen sind u. a. Ruhetachykardie, reduzierte Herzfrequenzvariabilität und orthostatische Hypotonie – ist das Sterberisiko im Vergleich zu Patienten ohne KAN im Verlauf von bis zu 15 Jahren um den Faktor 3,5 erhöht [3].
Die distal-sensomotorische Polyneuropathie (DSPN), die etwa drei Viertel aller diabetischen Neuropathien ausmacht, beeinträchtigt die Lebensqualität der Patienten zum einen durch quälende Schmerzen und Missempfindungen, zum anderen ist sie von größter Relevanz als Risikofaktor für ein diabetisches Fußsyndrom (DFS). Eine DSPN ist in 85 – 90 % der Fälle an der Ätiologie des diabetischen Fußsyndroms beteiligt und hat damit einen erstrangigen Stellenwert in der Risikokonstellation für Fußulkus und Amputation [3]. Zudem gibt es auch bei DSPN-Patienten Hinweise für eine erhöhte kardiovaskuläre Morbidität und Mortalität [3].
Pathogenese der diabetischen Neuropathie
Die diabetische Neuropathie ist eine Ausschlussdiagnose, da es sich um eine Schädigung der peripheren Nerven handelt, die infolge eines Diabetes mellitus ohne andere Ursachen auftritt. Zu den wichtigsten Risikofaktoren zählen Diabetesdauer und -einstellung (Hyperglykämie), aber auch arterielle Hypertonie und Hyperlipidämie (s. Übersicht 1) [3]. Eine Hyperglykämie führt zu zellschädigenden Prozessen wie oxidativem Stress und zur Aktivierung pathogener Stoffwechselwege wie den Polyol-, Hexosamin- und den Proteinkinase-C-Stoffwechsel sowie zur Akkumulation aggressiver Advanced Glycation Endproducts (AGEs), die Folgeerkrankungen verursachen. Aber: Nicht jede Neuropathie bei Diabetes-Patienten ist zwingend eine rein diabetische Neuropathie. Häufig liegt eine gemischte Pathogenese vor, z. B.:
- Kombination einer diabetischen und alkoholischen Neuropathie (Alkoholanamnese immer erheben!),
- Vitamin-B12-Mangel, vor allem unter Therapie mit Metformin oder Protonenpumpenhemmern (Vitamin-B12-Spiegel und/oder Holo-Transcobalamin bestimmen lassen) [4],
- Vitamin-B1-Mangel, der bei Diabetes-Patienten unter anderem aufgrund der erhöhten Ausscheidung von Vitamin B1 im Urin ebenfalls häufig ist [5]. Ein Defizit fördert Nervenschäden und Störungen im Glukose-Metabolismus, die wiederum pathogene Stoffwechselprozesse wie die Bildung gefäßschädigender AGEs forcieren [10].
Weitere mögliche Ursachen einer Neuropathie sind: Niereninsuffizienz, Hypothyreose, Paraproteinämie, berufstoxische Ursachen (Schwermetalle, Toxine) oder Arzneimittel (z. B. Chemotherapie). In einer retrospektiven Studie bei 103 Diabetikern mit DSPN wurden bei mehr als der Hälfte zusätzliche Neuropathie-Ursachen gefunden. Einer der häufigsten pathologischen Laborwerte war u. a. ein erniedrigter Vitamin-B1-Spiegel [6]. Auf diese Aspekte sollte anamnestisch und klinisch eingegangen werden.
Screening und Diagnostik
Eine diabetische Neuropathie ist keineswegs eine Spätkomplikation des Diabetes mellitus. Da bei einigen Patienten eine Hyperglykämie zum Zeitpunkt der Diabetesdiagnose schon jahrelang besteht, kann eine Neuropathie bereits zu diesem Zeitpunkt präsent sein. In einer Studie wurde bei jeder vierten älteren Person mit Prädiabetes eine diabetische Neuropathie nachgewiesen [7]. Insbesondere bei gleichzeitigem Vorliegen einer gestörten Nüchternglukose und Glukosetoleranz ist die Prävalenz einer DSPN und einer KAN erhöht [8].
Daher ist es notwendig, der Neuropathie in der Praxis mehr Aufmerksamkeit zu schenken und ein regelmäßiges Screening bereits in frühen Stadien des Diabetes bzw. bei Prädiabetes durchzuführen. Ein Screening auf eine sensomotorische und/oder autonome diabetische Neuropathie wird in der Nationalen Versorgungsleitlinie "Neuropathie bei Diabetes im Erwachsenenalter" [9] sowie von der Deutschen Diabetes Gesellschaft [3] bei Patienten mit Typ-2-Diabetes zum Zeitpunkt der Diabetesdiagnose und bei Patienten mit Typ-1-Diabetes spätestens fünf Jahre nach Diagnosestellung empfohlen.
Das Screening kann in der Hausarztpraxis oder beim Diabetologen entweder vom Arzt oder von einer speziell ausgebildeten medizinischen Fachangestellten oder Diabetesberaterin vorgenommen werden. Zum Screening gehört die Erhebung der neuropathischen Symptome und Defizite, die Inspektion und klinische Untersuchung der Füße sowie die Abklärung einer peripheren arteriellen Verschlusskrankheit (Tabelle 1). Es gibt Patienten, die nur Symptome, solche, die nur Defizite aufweisen, sowie eine weitere Kategorie von Patienten, die sowohl Symptome als auch Defizite haben. Aus diesem Grund sind für die Diagnose einer DSPN neben der Anamnese auch einfache neurologische Tests unabdingbar.
Typische Beschwerden im Rahmen der DSPN sind:
- Klinische Symptome in den Extremitäten (vor allem Füße, seltener Hände) wie einschießende oder stechende Schmerzen, Kribbeln, "Ameisenlaufen", Brennen, Krämpfe, Kälte- oder Taubheitsgefühl, Schmerzen bei einfacher Berührung, z. B. mit der Bettdecke.
- Defizite ("negative Symptome"), die vom Patienten nicht bemerkt werden können und daher vom Arzt aktiv durch gezielte neurologische Tests diagnostiziert werden müssen, wie Abnahme der Warm-/Kalt-, Berührungs- oder Vibrationsempfindung bzw. der Schmerzempfindung.
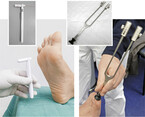
Für die einfache neurologische Untersuchung werden in der Regel fünf Tests angewendet: die Prüfung des Achillessehnenreflexes sowie die Beurteilung des Vibrationsempfindens (128-Hz-Stimmgabel), der Warm-/Kalt-Empfindung (z. B. TipTherm®) , des Druck- und Berührungsempfindens (10-g-Monofilament) und des Schmerzempfindens [9] (Abb. 1). Da bei manchen Patienten mit DSPN eine Schädigung der kleinen, nichtmyelinisierten Nervenfasern, bei anderen wiederum eine Schädigung der großen, myelinisierten Nervenfasern im Vordergrund steht, kann zum Screening jeweils eine spezifische Methode eingesetzt werden. Einfach und schnell durchzuführen ist z. B. die Testung der Vibrationsempfindung (große Nervenfasern) und der Warm-/Kalt-Empfindung (kleine Nervenfasern). Gekoppelt mit einer gezielten Schmerzanamnese und einer klinischen Untersuchung der Füße kann das Screening innerhalb weniger Minuten absolviert werden.
Ergibt sich kein Verdacht auf eine Neuropathie, sollte das Screening einmal jährlich wiederholt werden. Bei allen Patienten mit pathologischen Testergebnissen, auffälligen anamnestischen Befunden oder klinischen Symptomen werden weiterführende Untersuchungen empfohlen [3, 9]. Subjektive Symptome einer sensomotorischen Neuropathie werden klinisch mit dem Neuropathie-Symptom-Score (NSS) quantifiziert und der Schweregrad sensibler Defizite wird mit dem Neuropathie-Defizit-Score (NDS) erfasst. Die Messung der Schmerzintensität kann mittels der 11-Punkte-visuellen Analogskala (VAS) oder der Numerischen Ratingskala (NRS) erfolgen.
Als Minimalkriterien für die Diagnose gelten:- mäßig ausgeprägte neurologische Defizite (NDS 6–8 Punkte) mit oder ohne Beschwerden oder
- leichte neurologische Defizite (NDS 3–5 Punkte) mit mäßig ausgeprägten Beschwerden (NSS 4–6 Punkte) [3].
Ist die Diagnose einer DSPN trotz Durchführung der Basisdiagnostik nicht eindeutig, sollte eine weiterführende Diagnostik stattfinden.
Symptome, die auf eine autonome diabetische Neuropathie hindeuten, sollten bei Diabetes-Patienten ebenfalls im Rahmen des Screenings erfragt werden. Dazu zählen- Ruhetachykardie
- Störungen im gastrointestinalen Bereich (dyspeptische Symptome, Obstipation, Diarrhoe, Stuhlinkontinenz)
- Blasenfunktionsstörungen, sexuelle Funktionsstörungen
- gestörte Hypoglykämiewahrnehmung
- Schweißsekretionsstörungen oder
- anderweitig nicht begründete Blutglukoseschwankungen, die weiter abgeklärt werden sollten. Zur Erfassung einer KAN sind laut Praxisleitlinie mindestens zwei autonome Reflextests erforderlich: die Herzfrequenzvariabilität sowie der Orthostase-Test [3].
Häufig besteht eine Koinzidenz zwischen somatischer und autonomer Neuropathie: 50 % aller Patienten mit DSPN weisen auch eine KAN auf [3].
Defizite bei Diagnostik und Therapie
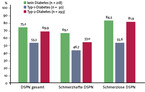
In der PROTECT-Studie mit 1.850 Teilnehmern, darunter 943 Typ-2-, 126 Typ-1- und 781 Nicht-Diabetiker, die ein Angebot zum Neuropathie-Screening nutzten, wurden große Defizite in der vorangegangenen Diagnostik der DSPN deutlich. Fast 70 % der Teilnehmer, bei denen eine Neuropathie nachgewiesen wurde, wussten zuvor nichts von einer Erkrankung der Nerven. Selbst von den Befragten, die Schmerzen oder Brennen in den Füßen als Beschwerden angaben, war die Ursache dafür zwei Dritteln nicht bekannt (Abb. 2) [17]. Rund ein Viertel der Teilnehmer mit nachgewiesener Neuropathie hatte eine schmerzlose Verlaufsform, rund 15 % eine atypische mit Schmerzen nur beim Gehen. Schmerzen nahmen in der Regel mit dem Schweregrad der Neuropathie zu [2].
Daten wie die Ergebnisse des KORA S-4 Surveys weisen auch auf eine deutliche Unterversorgung in der Therapie hin: Lediglich 38 % der Personen mit schmerzhafter DSPN erhielten Schmerzmittel, und nur 6 % der Teilnehmer mit DSPN eine Pharmakotherapie gegen die Neuropathie [24].
Therapie ruht auf drei Säulen
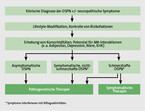
Die wichtigsten Ziele der Therapie sind die Linderung der oft stark lebensqualitätsmindernden Symptome, die Zurückbildung der Nervenschäden bzw. zumindest das Aufhalten der Progression der Erkrankung sowie die Prävention eines diabetischen Fußsyndroms. Da die Pathomechanismen einer diabetischen Neuropathie komplex sind, hat sich eine multifaktorielle Therapie bewährt (Abb. 3). Im Wesentlichen beruht sie auf drei Säulen.
Die erste Säule
senkt das Risiko durch Optimierung der Blutzuckereinstellung und Lebensstilinterventionen. Empfohlen werden Verzicht auf Alkohol und Nikotin sowie viel körperliche Bewegung. Zudem sollten kardiovaskuläre Risikofaktoren wie Hypertonie und Hyperlipidämie möglichst gut kontrolliert werden [3]. Eine normnahe Diabeteseinstellung wirkt insbesondere bei Typ-1-Diabetikern präventiv. In der DCCT-Studie wurde dadurch das Auftreten einer klinischen Neuropathie um 69 % (p=0,006) nach fünf Jahren im Vergleich zur Kontrollgruppe reduziert [11]. Die Progression der Neuropathie konnte um 57 % gebremst werden.
Bei Typ-2-Diabetikern schützt eine intensivierte Diabetestherapie nach bisherigen Studien weniger eindeutig vor einer Neuropathie, umso wichtiger scheint eine multifaktorielle Therapie inklusive Lebensstilintervention zu sein. In der Look-AHEAD-Studie konnte eine mehrjährige Lebensstilintervention bei Typ-2-Diabetikern mit einer Reduktion neuropathischer Symptome assoziiert werden [12]. In einer weiteren Studie bei Personen mit gestörter Glukosetoleranz und Neuropathie konnte nach einjähriger Lebensstilintervention mittels Hautbiopsie eine Zunahme der Nervenfaserdichte nachgewiesen werden [13], was für eine Nervenregeneration spricht.
Die zweite Säule
beinhaltet die Blockierung pathogener Stoffwechselwege, die durch Hyperglykämien aktiviert werden. Dazu werden in erster Linie das Vitamin-B1-Prodrug Benfotiamin und die antioxidativ wirkende Alpha-Liponsäure eingesetzt, da sowohl oxidativer Stress als auch ein Mangel an Vitamin B1 in diesem Zusammenhang eine zentrale Rolle spielen: Vitamin B1 ist Kofaktor verschiedener Enzyme des Glukosestoffwechsels. Ein Mangel, der bei vielen Diabetes-Patienten vorliegt, fördert daher pathogene Stoffwechselwege wie die Bildung von AGEs [5]. Benfotiamin ist zirka fünffach höher bioverfügbar als herkömmliches Vitamin B1 (Thiamin) [14]. Dadurch kann es einen Vitamin-B1-Mangel ausgleichen und so pathogene Stoffwechselwege hemmen [5, 10].
In einer sechswöchigen placebokontrollierten Studie bei 165 Patienten mit DSPN wurde mit hochdosiertem Benfotiamin in der Per-Protokoll-Analyse der Neuropathie-Symptom-Score signifikant verringert. Die Schmerzen der Patienten wurden am stärksten reduziert. Die Effekte waren bei hochdosierter Therapie ausgeprägter als bei einer niedrigeren Dosis (300 mg) und nahmen mit zunehmender Studiendauer zu [15]. Ähnliche Ergebnisse wurden in einer weiteren placebokontrollierten Studie über drei Wochen bei insgesamt 40 Diabetikern mit DSPN erzielt, die mit täglich 400 mg Benfotiamin behandelt wurden [16]. In einer weiteren Studie mit einer Behandlungszeit von bis zu 12 Monaten (600 mg/Tag über drei Monate, gefolgt von 300 mg/Tag) wurde eine kontinuierliche Verringerung neuropathischer Symptome beobachtet [25].
Mit Alpha-Liponsäure (ALA), intravenös oder oral, können sowohl neurologische Symptome als auch Defizite verbessert werden. Für eine i.v.-Therapie über drei Wochen wurde dies in einer Metaanalyse mit insgesamt 1.258 Personen mit DSPN belegt [19], für die orale Therapie (600 mg, 1.200 mg oder 1.800 mg/Tag) in einer fünfwöchigen Studie [20], wobei die Therapie mit 600 mg/d das beste Benefit-Risiko-Profil zeigte. In der Nathan-1-Studie, mit einer Dauer von vier Jahren die längste Studie bei DSPN, wurde unter oraler Therapie mit 600 mg ALA/Tag im Vergleich zu Placebo eine signifikante Reduktion von Defiziten nachgewiesen [21]. ALA ist ebenfalls wie Benfotiamin gut verträglich.
Die dritte Säule
bildet die symptomatische Therapie neuropathischer Schmerzen. Abhängig von der Intensität der Schmerzen und vom individuellen Risikoprofil des Patienten sollte das am besten geeignete Medikament ausgewählt werden. Als First-Line-Therapie kommen in der Regel Trizyklische Antidepressiva, Serotonin-Noradrenalin-Wiederaufnahmehemmer (z. B. Duloxetin), Antikonvulsiva (z. B. Gabapentin oder Pregabalin) oder Tramadol zum Einsatz. Die Wirksamkeit ist individuell zu erproben. Bei fehlender oder unzureichender Wirkung muss ein Medikationswechsel oder eine Kombinationstherapie erwogen werden. Sorgfältig zu beachten sind bei der systemischen Schmerztherapie das hohe Risiko für Nebenwirkungen, Arzneimittelinteraktionen und ggf. auch die Abhängigkeitsgefahr [3]. Die Progression der Nervenschädigung wird durch die rein symptomatische Therapie nicht beeinflusst.
Prävention der Entwicklung eines diabetischen Fußsyndroms
Patienten mit neurologischen Defiziten haben ein erhöhtes Risiko, ein diabetisches Fußsyndrom zu entwickeln. Zur Vorbeugung sollten die Patienten zu folgenden Maßnahmen angeleitet werden:
- Tägliche Inspektion der Füße
- Tragen von komfortablen, nicht zu engen Schuhen
- Regelmäßige Fußpflege unter Vermeidung von spitzen und scharfen Gegenständen
- Zeitnahe Vorstellung, sobald Wunden entstehen.
Patienten mit Ulzera oder präulzerativen Läsionen sollten regelmäßige podologische Komplexbehandlungen sowie stadien- und diabetesgerechte Schuhe und Einlagen verordnet bekommen. Diese werden in den Leitlinien empfohlen und in aller Regel von den Krankenkassen bezahlt.
Bei allen Patienten mit diabetischer Neuropathie sollten, abhängig von der individuellen Krankheitssituation, zumindest halbjährliche Verlaufskontrollen erfolgen. Liegen zusätzlich eine pAVK und/oder Fußdeformitäten vor, werden alle drei Monate Kontrollen empfohlen [3].
Interessenkonflikte: Der Autor hat Vortrags- oder Beraterhonorare von folgenden Firmen erhalten: Lilly Deutschland GmbH, Sanofi, Berlin-Chemie, Novo Nordisk, Wörwag Pharma.
Auf unserem CME-Portal www.kirchheim-forum-cme.de können Sie ab dem 22.10.2019 diesen Beitrag bearbeiten und bekommen bei Erfolg Ihre Punkte sofort gutgeschrieben.
Erschienen in: Der Allgemeinarzt, 2019; 41 (17) Seite 34-39