Wenn der Stuhlgang nicht mehr gehalten werden kann, bedeutet das für den Patienten einen hohen Leidensdruck. Bei Stuhlinkontinenz gibt es heute vielfältige konservative und operative Methoden, die aber immer individuell ausgewählt werden müssen.
Diagnostik und Therapie der analen Inkontinenz haben sich in den letzten Jahren stetig verbessert. Das Unvermögen des Patienten, Zeitpunkt und Ort der Darmentleerung zu kontrollieren, bleibt jedoch eine häufig unterschätzte Funktionsstörung, die sich auf das individuelle Wohlbefinden, die soziale Interaktionsfähigkeit und somit stark auf die Lebensqualität auswirkt. Dieses Leiden ist zudem stigmatisierend.
Etwa 2 % der Bevölkerung leiden an mangelnder Stuhlkontrolle [1]. Das Problem tritt mit zunehmendem Alter häufiger auf. Bis zu 11 % der Männer und 26 % der Frauen jenseits des 50. Lebensjahrs berichten über Stuhlinkontinenz [2], im Altersheim sind es sogar 40 % [3].
Die anale Inkontinenz geht häufig mit morphologischen und funktionellen Erkrankungen der benachbarten Beckenorgansysteme einher, z. B. mit einem Prolaps der gynäkologischen und urologischen Organe. Die aktuelle Definition der International Consultation of Incontinence beschreibt anale Inkontinenz als "unfreiwilligen Abgang von Stuhl und/oder Flatus und/oder Schleim". Sie lässt sich einteilen in: Stuhlinkontinenz (unfreiwilliger Abgang von Stuhl), Flatus-
inkontinenz (unfreiwilliger Abgang von Gas) und Schleiminkontinenz (unfreiwilliger Abgang nur von Schleim ohne Stuhl) [4].
Die Wahrung der Kontinenz ist abhängig von einer Vielzahl physiologischer Funktionen, die nicht nur auf das eigentliche Kontinenzorgan (Rektum, Anus und Beckenboden) beschränkt sind, sondern z. B. auch Ernährungsaspekte, Darmmotilität und Stuhlkonsistenz umfassen. Die Gewährleistung der Stuhlkontrolle und der Entleerung durch das Kontinenzorgan per se fußt auf einer koordinierten Interaktion verschiedener Organe: der Reservoirfunktion des Rektums und des vorgeschalteten Kolons sowie der Verschlussfunktion, die die Beckenbodenmuskulatur und der anale Sphinkterkomplex übernehmen – Letzterer besteht aus dem unwillkürlich kontrollierten glattmuskulären internen analen Sphinkter und dem willkürlich aktivierbaren (aber auch reflektorisch gesteuerten) quergestreift-muskulären externen analen Sphinkter.
Symptome und Basisdiagnostik
Anamnese und klinische Präsentation der Stuhlinkontinenz sind häufig schon richtungsweisend für die pathophysiologische Ursache der Erkrankung. Nach Ausschluss von Erkrankungen wie kolorektaler Karzinome, entzündlicher Darmerkrankungen (z. B. M. Crohn, Colitis ulcerosa) oder neurologischer Erkrankungen (z. B. Diabetes mellitus, MS), bei denen Stuhlinkontinenz als Sekundärsymptom auftreten kann, zielt die Initialdiagnostik darauf ab, den Schweregrad und die möglichen Ursachen der Beschwerden zu erfassen.
Die anale Inkontinenz hat eine weite Bandbreite. Sie reicht von eher unspezifischen Beschwerden im Analbereich, wie Brennen oder Jucken mit entsprechenden Hautaffektionen bis hin zur Mazeration, bis hin zu imperativem, nicht kontrollierbarem Abgang von Darminhalt, den der Patient entweder nicht spürt oder nicht verzögern kann.
Eine detaillierte Darstellung der Beschwerden erfolgt selten durch den Patienten und muss dezidiert erfragt werden. Erfasst der Arzt die Graduierung der Stuhlinkontinenz, sollte er unbedingt nachhaken, ob eine Inkontinenz für Gas, flüssigen oder festen Stuhl vorliegt. Die Wahrnehmung der Belastung durch die Inkontinenz variiert zudem individuell, was Symptomschwere und Einschränkung der Lebensqualität angeht. Für Betroffene ist eine Stuhlinkontinenz für flüssigen Stuhl in der Regel belastender als für festen.
Bei der Einordnung der Funktionsstörung muss man zudem differenzieren zwischen der Unfähigkeit, den unkontrollierbaren Stuhlverlust zu spüren (sensorische Inkontinenz, passive Inkontinenz: sensorisches Defizit), und dem Unvermögen, spürbar einsetzenden Stuhldrang zu verzögern (Dranginkontinenz). Eine Dranginkontinenz kann durch ein Defizit der Willkürkontraktion oder ein sensorisches Defizit infolge zu später Wahrnehmung der einsetzenden Stuhlentleerung bedingt sein. Dies ist in der Regel auf eine reflektorische Relaxation des unwillkürlichen internen analen Sphinkters zurückzuführen. Wichtig ist auch zu erfragen, ob die Inkontinenzproblematik mit einer Stuhlentleerungsstörung einhergeht (z. B. fraktionierte Entleerung, Gefühl der inkompletten Entleerung, Notwendigkeit der digitalen Mithilfe, wiederholte, zum Teil frustrane Stuhlentleerungen) und ob diese bei festem Stuhl auftritt und möglicherweise durch Episoden der Inkontinenz für flüssigen oder weichen Stuhl maskiert ist. Diese Symptomkombination – Inkontinenz und Stuhlentleerungsstörung – kann auf eine morphologische Veränderung wie inneren Rektumprolaps, Rektozele oder Enterozele hindeuten [5]. Diese Befundkon-stellation erfordert einen anderen Diagnose- und Therapieweg als die reine anale Inkontinenz. Davon abzugrenzen ist die sogenannte "Überlaufinkontinenz", bei der dünnflüssiger Stuhl an impaktiertem Stuhl vorbei unkon-trollierbar austritt.
Da die Ursachen der Stuhlinkontinenz vielfältig und komplex sein können, ist eine strukturierte Anamneseerhebung zu empfehlen, die bei Frauen obligat gynäkologische, geburtshilfliche und urologische Aspekte (Anzahl der Entbindungen, Art der Entbindung, Geburtsgewicht, Hormonstatus, Vorliegen von Miktionsbeschwerden etc.) beinhalten sollte. Beim Mann – und weil bei ihm iatrogene Sphinkterschäden in bis zu 25 % ursächlich für die Inkontinenz sind [6] – ist die Frage nach bisherigen analen Eingriffen wesentlich.
Weitere Diagnostik
Die Diagnose der analen Inkontinenz basiert auf der allgemeinen und fokussierten Anamnese sowie der klinischen Untersuchung. Diese beinhaltet Proktoskopie, Rektoskopie sowie Inspektion und Palpation der Anal- und Perinealregion. Inspektion und Palpation sind beide ohne und mit willkürlicher Aktivierung des Sphinkters ("Kneifen") sowie beim Pressen ("Valsalva") vorzunehmen. Die Prüfung der perianalen Sensorik hinsichtlich Spitz-Stumpfdiskriminierung (Streichen mit der Nadel und mit der Nadelspitze) und des Vorliegens einer reflektorischen Kontraktion des Anus/Beckenbodens infolge des sensorischen Reizes der Perianalregion ergänzt diese Kontrolle. Sie gibt Aufschluss über die Defizite der Sensorik, der Motorik (afferente und efferente Innervation) und des Reflexverhaltens von Sphinkterkomplex und Beckenboden.
Lässt sich eine sekundäre Form ausschließen, erfolgt die Therapie der eigentlichen analen Inkontinenz. Diese Behandlung sollte an die individuellen Bedürfnisse und Erwartungen des Patienten angepasst sein. Zielsetzungen sind die Symptomlinderung und eine verbesserte Lebensqualität. Im Allgemeinen folgt die Therapiewahl den Prinzipien "von konservativer zu operativer Therapie" und "vom weniger Invasiven zum Invasiven". Chirurgische Maßnahmen sind nur indiziert, wenn konservative nicht zur adäquaten Symptomlinderung führen. Die konservative Therapie ist pragmatisch und folgt oft dem Versuch-und-Irrtum-Prinzip. Sie sollte sich an Patientenakzeptanz und Compliance orientieren und daran angepasst sein, ob der Betroffene die Behandlung durchführen kann.
Konservative Therapie
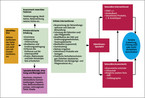
Als Erstlinientherapie gilt die konservative Therapie (Abb. 1), außer wenn der Befund zeigt, dass wegen Ursache, Ausmaß und Schweregrad der Inkontinenz konservative Maßnahmen aussichtslos sind. Mit diesen lassen sich die Symptome aber meist lindern. Die konservativen initialen Maßnahmen zielen – neben der allgemeinen Beratung – darauf ab, Stuhlkonsistenz und -passagegeschwindigkeit, Darmentleerung, rektale Füllung, Sphinkterfunktion sowie deren Wahrnehmung zu beeinflussen. Dieses Vorgehen hat sich empirisch durchgesetzt, dessen Evidenz ist jedoch beschränkt [7]. Kombinationsverfahren sind nicht unüblich und können effektiver als Einzelverfahren sein [8].
Lokale Maßnahmen:
- Hautschutz: konsequente anale Hygiene, Hautschutz (Lotion, Creme, weiche Vorlagen).
- Analstöpsel: in der Regel schlecht akzeptiert: nur etwa 10 – 20 % der Patienten wollen Analstöpsel regelhaft tragen. Häufig werden sie bei verminderter Sensibilität besser akzeptiert (z. B. Spina bifida) [9]. Neue, flexible Silikon-Plugs scheinen die Akzeptanz zu erhöhen und zu einer stärkeren Reduktion der Inkontinenz zu führen [10].
Regulation der Darmentleerung
Abführende Zäpfchen oder retrograde Lavage verfolgen zwei Ziele: die mechanische Reinigung des distalen Enddarms und die Besserung der rektalen Reservoirfunktion. Diese wird durch Distension des Rektums und verbesserte Perzeption infolge eines definierten Stimulus erreicht. Zu einem bestimmten Zeitpunkt soll so eine ausreichende Darmentleerung initiiert und ausscheidungsfreie Zeitintervalle geschaffen werden.
Regulation der Stuhlkonsistenz
Faserarme Kost, nicht blähende Kost und motilitätsbremsende Medikation (z. B. Loperamid, Codein) sollen zu einer täglich regelhaften Entleerung führen.
Beckenbodenmuskeltraining
Dieses Training ist bei reduzierter Willkürleistung des Beckenbodens/Analsphinkters indiziert. Die Übungen unter krankengymnastischer Anleitung sollte man wegen ihres nicht-invasiven Charakters, ihrer Komplikationsfreiheit und der geringen Kosten als frühe Intervention in Betracht ziehen – auch wenn die Evidenz ihrer klinischen Effizienz gering ist.
Biofeedback
Basierend auf dem Prinzip des operanten Konditionierens werden dem Patienten durch visuelle oder akustische Signale eine verbesserte Wahrnehmung und der Einsatz bestimmter physiologischer Funktionen vermittelt, um so die Restfunktionen des Kontinenzorgans besser zu nutzen. Motorische und sensorische Funktionen können hier angesteuert werden. Der therapeutische Effekt basiert auf einer gesteigerten Stärke und Dauer willkürlicher Kontraktion, verbesserter Koordination und Perzeption. Auch wenn die Ergebnisqualität variabel ist und das Verfahren kontrovers diskutiert wird, erscheint ein Behandlungsversuch – wie beim Beckenbodenmuskeltraining – aufgrund der geringen Invasivität und Morbidität bei überschaubaren Kosten als sekundäre Therapie vertretbar.
Spezielle Diagnostik und weiterführende Therapie
Bleiben konservative Therapieversuche erfolglos, sind weiterführende diagnostische – in der Regel ambulante – Maßnahmen nötig. Die Beschwerdesymptomatik sollte dabei mittels standardisierter Stuhltagebücher sowie inkontinenz- und krankheitsspezifischer Lebensqualität-Scores erfasst werden. Bildgebende Untersuchungen des Kontinenzorgans mit Darstellung der anatomischen Einzelkomponenten (endoanaler Ultraschall, MRT) schließen sich daran an – ebenso wie eine anorektale Manometrie (Funktionsquantifizierung der Muskelleistung des externen und des internen analen Sphinkters). Die Messung der Wahrnehmungsschwellen des Rektums, die Prüfung der Reflexinteraktion vom Enddarm und Sphinkterkomplex und – bedarfsabhängig – die dynamische Untersuchung der Stuhlkontrolle und -entleerung (konventionelle Defäkographie, dynamisches MRT) sind ebenfalls relevant. Eine urologische/urogynäkologische Diagnostik und Therapie kann zudem indiziert sein. All diese Untersuchungsmethoden bieten z. B. sogenannte Kontinenz- und Beckenbodenzentren an, die von den beruflichen Fachgesellschaften zertifiziert sind.
Chirurgische Therapie
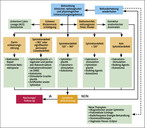
Die Wahl des chirurgischen Verfahrens orientiert sich immer an der Pathophysiologie (Abb. 2) [11]. Heute stehen Methoden im Fokus, die auf die Aktivierung funktioneller Reserven der Organsysteme zielen: Mit der Stimulation der peripheren Innervation des analen Kontinenzsystems durch ein implantiertes Stimulationssystem (Sakralnervstimulation) gelingt bei der Mehrzahl der Patienten eine deutliche, auch auf Dauer nachgewiesene Symptombesserung [12]. Ein wesentlicher Vorteil dieses minimal invasiven Verfahrens: Der Patient kann die Therapie zunächst zwei bis drei Wochen testen. Erst danach erfolgt gegebenenfalls eine Dauerbehandlung [13]. Basierend auf der Idee der funktionellen Rehabilitation mittels peripherer Elektrostimulation und Neuromodulation entwickeln sich aktuell weitere Techniken, wie die Nervus-tibialis-posterior-Stimulation. Wie wirksam sie ist, lässt sich noch nicht abschließend bewerten.
Klassische, bei Defekten der Anatomie organrekonstruierende (Sphinkterplastik) oder sphinkterersetzende Op.-Verfahren (dynamische Graziloplastik, Artificial Bowel Sphincter) sind weiterhin bedeutsam. Ihr Stellenwert wird derzeit jedoch aufgrund von Langzeitergebnissen (Sphinkterplastik) und/oder erheblicher Komorbidität (Sphinkterersatzverfahren) neu bewertet. Auch die Patientenselektion erfolgt hier restriktiver. Lokale Injektionsverfahren zur Augmentierung des Sphinkters (Bulking Agents) scheinen bei geringergradiger Ausprägung der Inkontinenz geeignet.
Interessenkonflikte: Der Autor ist als ärztlicher Berater (Strategie, Unterricht) für Medtronic tätig und Boehringer Ingelheim.
Erschienen in: Der Allgemeinarzt, 2019; 41 (2) Seite 24-27