Ob bei Tag oder bei Nacht: Der Stoffwechsel ändert sich ständig und reagiert – je nach Tageszeit – unterschiedlich auf Kohlenhydrate und Fette. So kommt es etwa zu einer ausgeprägten Abnahme der Glukosetoleranz am Nachmittag. Aber heißt das dann, dass sich eine hohe Aufnahme von Kohlenhydraten am Abend in jedem Fall ungünstig auswirkt, wie Fitnesstrainer es oft behaupten? Dies soll im folgenden Beitrag näher beleuchtet werden.
In unserem Körper tickt eine innere Uhr, die sogenannte zirkadiane Clock (lateinisch: circa diem, deutsch: "ungefähr ein Tag"). Sie spielt u. a. eine wichtige Rolle für die Stoffwechselregulation, besonders in stoffwechselaktiven Organen wie Muskeln, Fettgewebe, Leber und Pankreas. In der Leber sind z. B. während der Schlaf- bzw. Nüchternphase die Glukoneogenese- und Glykogenolyseraten erhöht, während in der Wach- bzw. Essphase die Glykogensyntheseraten höher liegen. Im Fettgewebe ist am Tag die Lipogenese und in der Nacht die Lipolyse stärker aktiv. Das moderne Leben führt jedoch häufig zu einer Desynchronisation zwischen der inneren Uhr und dem Metabolismus, was das Risiko für metabolische Erkrankungen erhöht.
Wie funktioniert die innere Uhr?
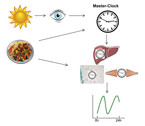
Jeder Mensch hat eine zentrale zirkadiane Uhr: die Master-Clock. Sie ist im suprachiasmatischen Nucleus des ventromedialen Hypothalamus zu finden und reguliert die zahlreichen peripheren Uhren, die sich nahezu in jeder Körperzelle befinden (Abb. 1). Das zirkadiane System wird durch verschiedene Stimuli (Zeitgeber) täglich an die äußere Umwelt angepasst. Der wichtigste Zeitgeber für die zentrale zirkadiane Uhr ist Licht. Zeit und die Komposition der Nahrungsaufnahme scheinen vor allem die peripheren Uhren, aber auch die zentrale zirkadiane Uhr zu beeinflussen. Gerade die Uhren der stoffwechselaktiven Organe werden durch Nahrung synchronisiert und können von der zentralen Uhr abweichen. Die zugrunde liegenden Mechanismen und ihre Bedeutung für die Gesundheit werden derzeit intensiv untersucht [1].
Der molekulare Mechanismus der inneren Uhr basiert auf sogenannten Transkriptions-Translations-Rückkopplungsschleifen, die einen 24-Stunden-Rhythmus erzeugen. Dieser Mechanismus reguliert sogenannte "Clock Controlled Genes". Diese zeigen als Folge zirkadiane Rhythmen in ihrer Expression, also wiederkehrende Abfolgen, die etwa 24 Stunden andauern. Die Clock Con-
trolled Genes geben diese Rhythmik an Stoffwechselgene und -prozesse weiter. So zeigen zahlreiche metabolische Hormone und Enzyme in ihrer Expression, Sekretion und/oder Aktivität zirkadiane Rhythmen.
Gene und Stoffwechselprozesse beeinflussen sich gegenseitig
Untersuchungen an Mäusen mit Mutationen in den einzelnen Uhrengenen zeigen, dass sich verschiedene dieser Gene an der Regulierung unterschiedlicher Stoffwechselprozesse beteiligen. Diese Regulation ist auch gewebsspezifisch. So haben zum Beispiel Mäuse, die eine Mutation im Clock-Gen tragen, einen stark veränderten Rhythmus in der täglichen Futteraufnahme mit Hyperphagie und entwickeln unter einer Hochfettdiät ein metabolisches Syndrom. Das Bmal1-Gen ist in der Leber für die Glukosemobilisierung wichtig und Rev-erbα (NR1D1) wird für die Differenzierung der Adipozyten benötigt [2]. Dass die zirkadiane Uhr auch selber einer metabolischen Kontrolle unterliegt, konnten Versuche bestätigen, in denen Mäuse auf eine Hochfettdiät gesetzt wurden, die Übergewicht hervorruft. Bei den Tieren kommt es zu einer Zerstörung des täglichen Fressrhythmus und zu veränderten Tagesrhythmen verschiedener Gene und Metabolite sowie zur Rhythmusänderung der metabolischen Hormone Leptin und Insulin [3, 4]. Auch bei Menschen kann die geänderte Diätkomposition von einer kohlenhydrat- zu einer fettreichen Diät die Oszillationen peripherer und zentraler Clock-Marker beeinflussen [5]. Bei Übergewicht und Diabetes mellitus fand man zudem ein verändertes Expressionsmuster der Uhrengene in Fettgewebe und Blutzellen.
Zeit der Nahrungsaufnahme
Aufgrund der engen Interaktion zwischen Clock und Stoffwechsel ist die Zeit der Nahrungsaufnahme ein wichtiger Faktor. Nachtaktive Nagetiere nehmen normalerweise 80 % der täglichen Nahrung während der Dunkelphase zu sich. Bietet man den Tieren jedoch Futter nur in der Lichtphase (also zur "falschen" Tageszeit) an, kommt es zu einer Entkopplung der peripheren Uhr von der zentralen Clock. Das führt zur Desynchronisation metabolischer Prozesse und zu metabolischen Krankheiten [6]. So werden Mäuse, die eine fettreiche Diät nur während der Lichtphase bekommen haben, schneller adipös als Tiere, die nur während der Dunkelphase gefüttert wurden [7].
Ähnliche Daten demonstrieren epidemiologische Studien bei Menschen: Schichtarbeit oder chronischer Jetlag – hier wird regelmäßig zur falschen Tageszeit gegessen – erhöhen das Risiko für Adipositas, Diabetes Typ 2 und kardiovaskuläre Krankheiten [8]. Der extreme Fall der falschen Esszeit ist als "Night Eating Syndrome" bekannt: eine Essstörung, bei der Patienten von Heißhungerattacken in der Nacht geplagt werden, die mit Adipositas einhergehen. Im Gegensatz dazu erhöht die Futteraufnahme im "richtigen" Zeitfenster die Amplitude der zirkadianen Rhythmen und schützt Mäuse, obwohl sie eine fettreiche Diät erhalten, vor Adipositas, Glukoseintoleranz und anderen metabolischen Störungen [9]. Neuere Studien weisen darauf hin, dass bestimmte Zeitfenster für den Verzehr einer kohlenhydrat- und fettreichen Kost aus gesundheitlicher Sicht besser geeignet sind als andere. So hatten Mäuse, die eine fettreiche Diät am Ende der aktiven Phase bekamen, ein erhöhtes Körpergewicht und eine niedrigere Glukosetoleranz im Vergleich zu Nagern, die das fettreiche Futter zu Beginn der aktiven Phase verzehrten [10]. Die humanen Daten zu diesem Thema sind umstritten. Populär ist ein Diätkonzept, das den abendlichen Verzicht auf Kohlenhydrate propagiert: Diese sollten am besten morgens gegessen werden. Humane Diätinterventionsstudien zeigen hingegen, dass kohlenhydratreiches Essen abends die Gewichtsabnahme unterstützt und den metabolischen Status verbessert [11].
Gestörter Glukosestoffwechsel: keine Kohlenhydrate nach 17 Uhr?
Um diese Frage zu klären, führten wir eine Ernährungsstudie an 29 Männern durch [12]. Sie waren nicht adipös, hatten keinen Diabetes und machten keine Schichtarbeit. 18 Studienteilnehmer hatten eine normale Glukosetoleranz und elf Probanden erhöhte Nüchtern-Blutzuckerwerte und/oder eine gestörte Glukosetoleranz.
Die Probanden mussten für jeweils vier Wochen zwei unterschiedliche isokalorische Diäten einhalten. Beide Diäten lieferten dieselbe Menge an Kalorien, Kohlenhydraten, Fetten und Eiweiß, jedoch unterschieden sie sich darin, zu welcher Tageszeit vorwiegend Kohlenhydrate oder Fette gegessen wurden. Bei einer Diät aßen die Teilnehmer vormittags kohlenhydratbetonte (65 % Kohlenhydrate, 20 % Fette und 15 % Eiweiß), nachmittags und abends fettreiche Mahlzeiten (35 % Kohlenhydrate, 50 % Fette und 15 % Eiweiß). Bei der zweiten Diät nahmen sie umgekehrt vormittags fettbetontes und nachmittags und abends kohlenhydratreiches Essen zu sich.
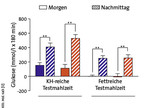
Es zeigte sich, dass es zumindest für Probanden mit einer Glukosestoffwechselstörung relevant ist, zu welcher Tageszeit sie eine kohlenhydratreiche Mahlzeit verzehren. So lagen in dieser Probandengruppe die Blutzuckerwerte nach der Diät, in der die Teilnehmer abends kohlenhydratbetont aßen, um durchschnittlich 7,9 % höher als nach der Diät, die abends fettreiche Mahlzeiten beinhaltete. Bei gesunden Personen ließ sich dieser Effekt nicht beobachten. Die erhöhten Blutzuckerwerte belasten den Stoffwechsel insgesamt, besonders die insulinproduzierenden Betazellen (Glukosetoxizität). Wir postulieren deshalb, dass sie die Progression von Stoffwechselkrankheiten verstärken und beschleunigen.
Nachweisbar war auch, dass metabolische zirkadiane Rhythmen bei gestörtem Glukosemetabolismus anders sind als bei metabolisch gesunden Menschen, was offensichtlich zu dem genannten Diäteffekt führt. In der Tat stellten wir bei den gesunden und auch den vorbelasteten Personen eine Abnahme der Glukosetoleranz im Tagesverlauf fest, die bei letzteren deutlich stärker ausfiel (Abb. 2). Zusätzlich zeigten die vorbelasteten Männer am Nachmittag eine Abnahme des Inkretinhormons Glucagon-like peptide-1 (GLP-1) und des Sättigungshormons Peptid YY (PYY). Diese Hormone tragen zur Regulation des Zuckerstoffwechsels bzw. des Körpergewichts bei, und ihre Ausschüttung folgt einer bestimmten Tagesrhythmik [12].
Die Studie zeigt, dass die zirkadiane Rhythmik der Hormonausschüttung beeinflusst, wie der Stoffwechsel auf Kohlenhydrate reagiert. Diese Ergebnisse sind hochrelevant und deuten an, dass Patienten mit einer Störung des Glukosestoffwechsels große, kohlenhydratreiche Mahlzeiten am Abend vermeiden sollten.
- Innere Uhr und Stoffwechsel regulieren sich gegenseitig.
- Die Glukosetoleranz nimmt nachmittags ab. Diese Abnahme ist bei gestörtem Glukosemetabolismus stärker ausgeprägt.
- Die Tageszeit, zu der vorwiegend Kohlenhydrate bzw. Fette verzehrt werden, kann die glykämische Kontrolle bei Menschen beeinflussen.
- Kohlenhydratreiche Kost am Abend hat einen ungünstigen Effekt auf die Blutzuckerspiegel und die glykämische Kontrolle bei gestörtem Glukosestoffwechsel. Es wird Patienten mit einer Zuckerstoffwechselstörung deshalb nahegelegt, abends auf große, kohlenhy-dratreiche Mahlzeiten zu verzichten.
Interessenkonflikte: Die Autoren haben keine deklariert.
Erschienen in: Der Allgemeinarzt, 2018; 40 (7) Seite 30-32