Opioide sind aus der Therapie akuter und chronischer Schmerzen nicht mehr wegzudenken. Inzwischen steht eine ganze Palette hochwirksamer Substanzen zur Verfügung. Aber auch mögliche Nebenwirkungen sind zu bedenken. Zudem weisen die Substanzen unterschiedliche pharmakokinetische Eigenschaften auf, die bei deren Einsatz zu berücksichtigen sind.
Als Opiate bezeichnen wir Substanzen mit morphintypischen Wirkungen, die der Rohsubstanz des Opiums entspringen oder durch chemische Prozesse verändert sind. Opioide gelten als chemische Syntheseprodukte mit Bindungsverhalten an entsprechende Opioidrezeptoren. In diesem Beitrag wird für sie durchgängig der Begriff "Opioide" verwendet.
Die Entdeckung von Endorphinen hat unser Verständnis über Opioidrezeptoren, welche G-Protein-gekoppelt auf die prä- und postganglionäre Signalübertragung Einfluss nehmen, vertieft.
Die Wirkung von Opioiden lässt sich heute durch µ-Kappa- und Deltarezeptoren sowie MOR (morphin-receptor-like) mit ihren individuellen Variationen besser verstehen. Die Bedeutung der jeweiligen Opioidrezeptoren ist allerdings bis heute nicht in allen Einzelheiten aufgeklärt. Durch die Vermittlung von Analgesie, aber auch Atemdepression steht der µ-Rezeptor im Fokus unseres Interesses, zumal alle Opioidanalgetika über diesen Rezeptor ihre schmerzlindernde Wirkung entfalten. Zwar sind unsere Vorstellungen von der analgetischen Wirksamkeit der Opioide inzwischen weit fortgeschritten, ihre zentralen Wirkungen wie die Einflussnahme auf das Immunsystem, den Hormonhaushalt, das Hervorrufen von Juckreiz, Antidiurese und Mikrozirkulation bleiben jedoch weitgehend offen. Der Nutzen oder der Schaden für das Individuum ist somit letztlich nicht geklärt. Die peripheren und zentralen Opioidwirkungen zeigt Tabelle 1.
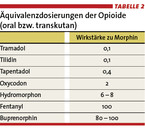
Opioidrezeptoren finden sich vor allem im Bereich des Zentralnervensystems. Allerdings sind derartige Rezeptoren auch in der Körperperipherie nachweisbar und dies umso mehr, als nozizeptive Reize andauern. Gerade im entzündeten Gewebe ist die Opioidrezeptorendichte hoch. Sie stimmt auch mit unserer Alltagserfahrung hinsichtlich der Wirksamkeit lokal applizierter Morphinlösung überein. Diese erfolgt etwa im Rahmen der Mundspüllösung bei Entzündungen der Schleimhäute im Mund- und Rachenbereich (Mucositis), z. B. infolge einer Chemotherapie. Aufgrund der unterschiedlichen Ausstattung jedes Menschen mit Opioidrezeptoren und besonders deren Subtypen wirken die einzelnen Substanzen individuell durchaus unterschiedlich. Auf dieser Kenntnis beruht auch der Rat zum Opioidwechsel bei unzureichender Wirkung oder vermehrten Nebenwirkungen. Bei der Umstellung von einem Opioid zum anderen sind deren Äquivalenzdosen zu beachten (Tabelle 2).
Es stellt sich die Frage, inwieweit wir heute auf der breiten Klaviatur verfügbarer Substanzen spielen müssen. Opioide unterscheiden sich zunächst in ihrer Pharmakokinetik. Während moderne Opioide wie Fentanyl und Alfentanil sehr effektiv, aber dennoch nur kurz am µ-Rezeptor binden, liegen die Halbwertszeiten der sonstigen Opioide bei circa vier bis sechs Stunden. Die Wirkdauer konnte erst durch das Prinzip der Retardierung ausgedehnt werden. So weisen z. B. Fentanyl- oder Buprenorphin-Pflaster eine träge Kinetik auf. Manche orale Zubereitungen setzen Wirkstoffe verzögert frei aufgrund unterschiedlich großer bzw. sich verzögert auflösender Substanzkügelchen oder durch eine Hartkapsel, aus der durch Flüssigkeitszufuhr die Substanz (hier: Hydromorphon, Jurnista®) über viele Stunden herausgepresst wird. Inzwischen gibt es Retardtabletten und -kapseln mit einer Halbwertsdauer von acht bis 24 Stunden.
In der Tumorschmerztherapie sollte der Patient einerseits eine kontinuierliche morphintypische Wirkung zur Schmerzlinderung erhalten, andererseits aber auch effektiv ultrakurzwirksame Medikamente (z. B. Fentanyl) gegen Schmerzattacken, welche die ansonsten befriedigende Schmerzreduktion durchbrechen. Da allerdings das schnelle Erreichen hoher Blutspiegel bzw. deren rasanter Abfall abhängig machen kann, sollte die Kombination von retardierten und nichtretardierten Opioiden nur Patienten im Rahmen der Tumorschmerztherapie in einer Palliativsituation vorbehalten bleiben.
Pharmakokinetische Überlegungen müssen bei der Vielzahl vorhandener Substanzen auch hinsichtlich ihrer Metabolisierung angestellt werden. Bei eingeschränkter Leberfunktion werden oral aufgenommene Opioide effektiver wirken, da die Verstoffwechselung im Rahmen des First-Pass-Effekts in der Leber geringer ausfällt. Eine fortschreitende Niereninsuffizienz verhindert das Ausscheiden der Substanzen bzw. deren aktiver Metabolite, wobei die Wirkung bzw. Nebenwirkungen hierdurch erhöht sind. Dies wird besonders am Beispiel des Morphins deutlich: Die Ausscheidungskapazität der Niere für Morphin-3- und Morphin-6-Glucoronid ist begrenzt und bei eingeschränkter Nierenfunktion (GFR) schnell überschritten. Damit kumulieren die Substanzen mit dem Effekt zunehmender Sedierung und Ateminsuffizienz beim Patienten. Morphin ist deshalb bei Niereninsuffizienz kon-traindiziert.
Substanzen und Differenzialindikationen
Morphin ist die Substanz, an deren Wirkung und Nebenwirkungen sich alle anderen Opiat-analgetika im Sinne eines Goldstandards messen lassen müssen. Ein negativer Einfluss auf unser Immunsystem scheint bei Morphin zu bestehen, ohne dass derartige Wirkungen klinisch ins Auge stechen. Bei Niereninsuffizienz darf Morphin, wie erwähnt, nicht gegeben werden.
Oxycodon haben Freund und Speyer 1916 in Frankfurt synthetisiert. Es wurde, wohl nicht zuletzt durch das Pharmakomarketing in den USA, zum Opioid Nummer eins, wobei seine Wirkung und Nebenwirkungen diesen Siegeszug kaum begründen. Die etwas geringere Rate an opioidbedingter Übelkeit sowie die verbesserte Wirksamkeit bei neuropathischem Schmerz gegenüber Morphin ist möglicherweise durch die zusätzliche Wirkung am Kappa-Rezeptor bedingt. Bei zunehmender Niereninsuffizienz muss man die Dosis von Oxycodon reduzieren. In der Kombination Oxycodon/Naloxon (Targin®) wird eine Verringerung opioidbedingter Obstipation erreicht. Patienten mit Leberinsuffizienz sollte man diese Zubereitung nur mit Vorsicht geben. Denn es ist nicht auszuschließen, dass Naloxon nicht vollständig metabolisiert wird und es zu einem Wirkverlust oder zu Entzugssymptomen kommen kann.
Hydromorphon, das schon 1920 in Deutschland synthetisiert und vier Jahre später eingesetzt wurde, hat in der Bundesrepublik seit Mitte der 1990er-Jahre nicht ohne Grund große Verbreitung gefunden. So kann es auch bei ausgeprägter Niereninsuffizienz gegeben werden, da aktive Metabolite nicht bekannt sind. Hydromorphon wird in der Leber alternativ zu vielen anderen Substanzen verstoffwechselt und nur im geringen Maß an Transporteiweiße gebunden. Interaktionen mit anderen Medikamenten sind dadurch geringer ausgeprägt. Hydromorphon kann einmal täglich oral eingenommen werden und zeigt eine gute 24-Stunden-Galenik (Jurnista®, Hydromorphon Aristo long®).
Methadon (1937 durch Bockmühl und Ehrhart in Deutschland synthetisiert) und L-Methadon (Polamidon®) sind Reserveopioide. Neben der Bindung an den Opioidrezeptoren blockieren sie weitere, die Schmerzwahrnehmung beeinflussende Rezeptoren (z. B. NMDA-Rezeptoren). Gerade bei neuropathischen Schmerzen sind diese Substanzen vorteilhaft.
Als Reserveopioide sollten sie insofern gelten, als ihre Pharmakokinetik nicht banal ist. Mit ihrer Einnahme strömen diese Substanzen zunächst als lipophile Opioide in die unterschiedlich vorhandenen Fettspeicher ab. Nach anfänglich regelmäßiger Gabe wird deshalb eine Dosisreduktion nötig, um eine Kumulation zu vermeiden. Bei einzelnen Patienten zeigt sich allerdings eine extrem lange Halbwertszeit. Beide Substanzen sind in der Therapie neuropathischer Schmerzen jedoch einen Behandlungsversuch wert. Inwieweit Methadon auch antineoplastische Eigenschaften aufweist, werden Studien in den kommenden Jahren offenlegen. Die Behandlung unter derartiger Erwartung sollte kritisch mit dem Patienten diskutiert werden, zumal gerade Methadon unter dem Verdacht steht, QT-Zeit-Verlängerungen am Herzen mit der Folge tachykarder Herzrhythmusstörungen auslösen zu können.
Fentanyl (1960 durch Paul Janssen in Belgien synthetisiert) ist ein reiner µ-Agonist. Die schnell anflutende und nur kurz wirksame Substanz ist in der Tumordurchbruchschmerzbehandlung inzwischen etabliert und aus der Anästhesie und dem Rettungsdienst nicht mehr wegzudenken. Seinen Durchbruch erlangte das Präparat in der Schmerztherapie durch die transkutane Applikation. Die Substanz kann bei mittelgradiger Niereninsuffizienz angewendet werden. Aktive Metabolite sind nicht bekannt.
Buprenorphin ist ein halbsynthetisches Opioid, das aus dem Alkaloid Thebain gewonnen und 1969 von Reckitt und Colman eingeführt wurde. An seinem Beispiel lernen schon Medizinstudenten den sogenannten Ceiling-Effekt – ein Phänomen, bei dem mit steigender Dosierung ab einem bestimmten Punkt die Wirkung nicht weiter zu-, sondern abnimmt. Die Substanz wird deshalb auch als partieller µ-Agonist bezeichnet. Buprenorphin hat ein deutlich verstärktes Bindungsverhalten am Opioidrezeptor. Das Antagonisieren der Substanz mit Naloxon bedarf deshalb einerseits höherer Naloxon-Dosen, andererseits führt Buprenorphin bei der Hämodialyse weniger schnell zu einer Schmerzzunahme (durch Entfernung aus dem Plasma) gegenüber anderen, durch die Dialyse entfernten Analgetika.
Buprenorphin hat bei neuropathischen Schmerzen seine Wirksamkeit zeigen können. Ein negativer Einfluss auf das Immunsystem wird ihm nicht zugeschrieben. Die Substanz ist als Sublingualtablette verfügbar. In der transkutanen Applikation sind Pflaster mit einer bis zu siebentägigen Wirksamkeit (Norspan®) im Handel. Im Vergleich zu TTS Fentanyl werden leider höhere Raten an lokalen allergischen Reaktionen sowohl vom Sofort- als auch vom Spättyp beobachtet, weshalb der Arzt die beklebten Hautareale der Patienten über Wochen beobachten muss.
Tapentadol wurde 2006 patentiert. Im Rahmen der Opioide hat es eine Sonderstellung. Eine neue Substanzklasse, die Tapentadol neben den Opioiden einnimmt (sogenannte MOR-NRI), hat an Bedeutung gewonnen. Die starke analgetische Wirkung der Substanz entfaltet sich wirksam durch eine Kombination von nur mäßig effektiver Bindung am µ-Rezeptor und gleichzeitiger Noradrenalin-Wiederaufnahmehemmung. Hierdurch fallen in der Anwendung – bei vergleichbarer analgetischer Potenz – die opioidtypischen Nebenwirkungen (u. a. Übelkeit, Benommenheit, Verstopfung) deutlich geringer aus. In der Therapie neuropathischer Schmerzen ist die Substanz wirksam, bei mittelstarker Niereninsuffizienz kann Tapentadol noch angewandt werden.
Nach dem WHO-Stufenschema der Tumorschmerztherapie trennen wir starke von mittelstark wirksamen Opioiden. Beispiele für mittelstarke Substanzen sind Tramadol, Tilidin, Codein und Dihydrocodein. Allen ist gemeinsam, dass sie sogenannte Prodrugs sind: Die wirksame Substanz entsteht erst nach Metabolismus in der Leber. Codein und Tramadol wirken bei circa 10 % der Patienten wenig, da diese Personen über eine unzureichende Enzymausstattung mit CYP2D6 ("Poor Metabolizer") verfügen und damit die Synthese der wirksamen Metaboliten ausbleibt. Viel seltener trifft der Arzt auf sogenannte "Ultra Rapid Metabolizer", die Tramadol und Codein besonders schnell verstoffwechseln und damit Überdosierungen provozieren. Durch die zusätzliche Wirkung auf die Serotonin-Wiederaufnahmehemmung ist die Wirksamkeit von Tramadol bei neuropathischen Schmerzen bedingt.
Tramadol steht im Verdacht, in Kombination mit SSRI und SNRI sowie MAO-Hemmern das lebensbedrohliche Serotoninsyndrom (u. a. Angst, Halluzinationen, Tachykardie, Unruhe, Muskelzuckungen, gesteigerte Reflexe, Schwitzen, Tremor) hervorrufen zu können. Tilidin wird in der Leber zur wirksamen Substanz Nor-Tilidin verstoffwechselt. Somit ergibt sich eine verminderte Wirksamkeit bei Patienten mit Leberinsuffizienz. Vorteilhaft für Tilidin ist, dass man es bei Niereninsuffizienz geben kann. Tilidin ist in geringem Maß der Opioidantagonist Naloxon mit dem Ziel zugesetzt, bei nicht sachgerechter Anwendung eine ansonsten tödliche Ateminsuffizienz zu vermeiden. Tilidintropfen haben ein hohes Abhängigkeitspotenzial und sollten nur kurzfristig eingesetzt werden. Aufgrund vielfältiger Missbrauchsfälle und Abhängigkeit hat der Gesetzgeber diese Zubereitung der Betäubungsmittel-Verschreibungsverordnung (BtMVV) unterstellt.
Zusammenfassung
Opioide sind peripher und zentral wirksame Substanzen, die analgetisch wirken, allerdings eine Vielzahl weiterer therapeutisch gewünschter und nicht gewünschter Wirkungen entfalten. Bei ihrem Einsatz sollten pharmakodynamische und -kinetische Eigenschaften bedacht werden, damit eine wirksame und sichere Behandlung stattfinden kann.
Interessenkonflikte: Dr. Lux hat Zahlungen für Vortragstätigkeit und Beratung von folgenden Firmen erhalten:
Biogen, Grünenthal, Hexal, Indivior, Janssen-Cilag, Kyowa Kirin, Mundipharma, OMT, TAD, TEVA
Erschienen in: Der Allgemeinarzt, 2017; 39 (20) Seite 30-34