Die jährlichen Grippewellen verlaufen unterschiedlich und fordern mal mehr, mal weniger Opfer. Den besten Schutz bietet nach wie vor eine Impfung, wobei quadrivalente Impfstoffe ein größeres Erregerspektrum abdecken.
Die Schwere der Influenzawellen schwankt von Jahr zu Jahr erheblich. Nach Schätzungen des Robert Koch-Instituts wurden in Deutschland während der schweren Grippewelle in der Saison 2012/2013 32.000 Menschen wegen einer Influenza im Krankenhaus behandelt [1]. Im darauffolgenden Jahr nahm die Influenzawelle einen milden Verlauf mit etwa 3.000 Krankenhauseinweisungen [1].
Die höchste Krankheitslast geht von Influenza-A-Viren aus. Die als Antigenshift bekannten, ständig ablaufenden minimalen Veränderungen der Virusoberflächenproteine Hämagglutinin und Neuraminidase lassen neue Virusvarianten entstehen, die die saisonalen Influenza-A-Wellen bestimmen. Die jährliche Anpassung der beiden Influenza-A-Subtypen A/H1N1 und A/H3N2 an die epidemiologische Situation soll für eine optimale Übereinstimmung der Impfstoffkomponenten mit den voraussichtlich zirkulierenden Virusstämmen sorgen.
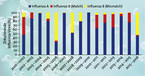
Die Influenza B galt früher als eine mildere Form einer Grippe. Diese Annahme hat sich als falsch erwiesen. Man weiß heute, dass die Influenza B bezüglich ihrer klinischen Auswirkungen zwischen Influenza A/H3N2 und A/H1N1 einzuordnen ist [2]. Es können alle Altersgruppen betroffen sein, wenn auch ältere Kinder und junge Erwachsene die höchsten Erkrankungsraten haben [2]. Epidemiologisch unterscheiden sich Influenza-B- von den -A-Viren vor allem dadurch, dass ihr einzig epidemiologisch relevantes Reservoir der Mensch ist, so dass kein Antigenshift stattfindet und folglich auch keine Pandemien auftreten. Es kommt aber zu Veränderungen im Hämagglutinin-Gen der B-Viren. Dieser langsam ablaufende Prozess hat schließlich dazu geführt, dass seit 1983 zwei genetisch und antigenetisch unterschiedliche B-Linien vorkommen: Victoria-Linie und Yamagata-Linie. Seit 2001 zirkulieren beide Linien mit unterschiedlicher Dominanz weltweit. Für die Auswahl der Viruskomponenten der saisonalen trivalenten Influenzaimpfstoffe, die neben den beiden A-Komponenten A/H1N1 und A/H3N2 nur eine der beiden B-Linien enthalten, ist es praktisch unmöglich, die relevante Komponente vorherzusagen. Folglich stimmten zwischen 2003/2004 und 2015/2016 lediglich in fünf Saisons Impfvirus und zirkulierende B-Linie überein. In fünf Saisons bestand keine, in drei Saisons eine partielle Übereinstimmung [1] (Abb. 1).
Der Anteil der Influenza-B-Viren am Infektionsgeschehen schwankt sowohl regional als auch jährlich erheblich. Surveillance-Daten europäischer Länder für den Zeitraum von 2001/2002 bis 2010/2011 lassen auf eine durchschnittliche Inzidenz der Influenza B von 23 % (1 bis 60 %) schließen [3].
Die Saison 2015/2016 war in Deutschland und einigen Nachbarländern, wie z. B. in Österreich, durch eine ungewöhnlich starke Influenza-B-Welle geprägt. Mit 56 % aller isolierten Influenzaviren dominierten Influenza-B-Viren, von denen über 90 % der Yamagata-Linie angehörten. Da diese Linie in der vorhergegangenen Saison keine Rolle spielte, war sie im trivalenten Impfstoff nicht enthalten. Dieser Mismatch war sicherlich mitverantwortlich für die insgesamt niedrige bis moderate Impfeffektivität. Es gibt zwar eine gewisse Kreuzimmunität zwischen den beiden B-Linien, ihr Ausmaß ist jedoch von vielen Faktoren abhängig und schwierig einzuschätzen.
Die einzige Möglichkeit, den häufigen Mismatch der Influenza-B-Komponente zu umgehen, besteht in der Anwendung von Impfstoffen, die beide B-Linien enthalten. Im März 2013 erhielt eine erste quadrivalente inaktivierte Influenza-Vakzine (QIIV) für Personen ab drei Jahren die Zulassung in Deutschland. Im Dezember 2013 wurde der bisherige attenuierte Lebendimpfstoff für Kinder von 2 bis 17 Jahren durch eine Vierfachformulierung (Q/LAIV) ersetzt. Eine weitere, inaktivierte quadrivalente Influenzavakzine erhielt im Sommer 2017 die Zulassung.
Die inaktivierten Vierfachimpfstoffe sind die ersten Influenzaimpfstoffe, die nach den neuen Kriterien bzw. Prüfmethoden der Europäischen Arzneimittelagentur EMA für die Zulassung neu entwickelter Influenzaimpfstoffe getestet wurden [4]. Die klinische Prüfung der neuen Vierfachimpfstoffe ergab bei Kindern und Erwachsenen eine gleichwertige Immunantwort gegen beide B-Linien, ohne dass die Antikörperbildung gegen die anderen im Influenzaimpfstoff enthaltenen Virusstämme negativ beeinflusst wurde. Die inaktivierten tri- und quadrivalenten Impfstoffe unterschieden sich nicht bezüglich ihres Sicherheitsprofils [5]. Für die Anwendung des quadrivalenten Lebendimpfstoffes bei Kindern zwischen 2 und 17 Jahren konnte ebenfalls eine gute Immunogenität sowie ein gutes Sicherheitsprofil nachgewiesen werden [6].
Nach einem dynamischen Simulationsmodell könnten durch quadrivalente Impfstoffe 4 % mehr Influenza-Fälle, 5,7 % mehr Hospitalisierungen und 6,4 % mehr Todesfälle als durch trivalente Impfstoffe verhindert werden [7].
Obwohl die Grippe-Impfung nur etwa die Hälfte der Risikopersonen vor einer Influenza-Erkrankung schützt, ist die saisonale Influenzaimpfung nach wie vor die beste Präventionsmaßnahme, um das Risiko von Erkrankungen zu vermindern [8]. Die Vierfachimpfstoffe könnten dazu beitragen, die Impfeffektivität zu erhöhen.
- Die Impfung ist derzeit die wirksamste und kostengünstige Präventionsmaßnahme zum Schutz vor Influenzaerkrankungen.
- Die jährlichen Grippewellen werden durch Influenza-A- und -B-Viren verursacht, von denen zwei unterschiedliche Subtypen (Influenza A) bzw. Linien (Influenza B) zirkulieren.
- Der Impfschutz der klassischen trivalenten Grippeimpfstoffe gegen Influenza B ist wegen der häufigen Diskrepanz zwischen Impfvirus und zirkulierenden Virusstämmen nicht optimal.
- Die neuen Vierfachimpfstoffe induzieren bei Kindern und Erwachsenen eine gleichwertige Immunantwort gegen beide B-Linien, ohne dass die Antikörperbildung gegen die anderen im Influenzaimpfstoff enthaltenen Virusstämme negativ beeinflusst wird.
Interessenkonflikte: PW: Honorare für Advisory Board bzw. Vorträge von Pfizer und Bristol-Myers Squibb,
MK: Beratertätigkeit für GSK, Pfizer, Baxter, Novartis, Astra Zeneca, MedImmune, SPMSD, SANOFI, MSD u. a.
UK: Beratertätigkeit für Baxter, Pfizer, Sanofi, GSK u. a.
KW: Beratungs- und Vortragstätigkeiten für SANOFI, GSK, MSD,
AHL: Honorare/Reisekostenunterstützung von Pfizer, Novartis und Sanofi-Pasteur-MSD
Erschienen in: Der Allgemeinarzt, 2017; 39 (19) Seite 62-64